
急性胰腺炎是消化系统的常见病、多发病,因其严重程度不一、并发症多样,故具有潜在的致死风险。随着2012新亚特兰大指南的广泛应用,对于急性胰腺炎的影像学报告提出了新的要求。笔者着重介绍四川省医学影像重点实验室、川北医学院附属医院的急性胰腺炎影像结构化报告,皆在提高对本病的系统化认识,并规范地书写CT/MRI报告。

本刊刊出的所有论文不代表本刊编委会的观点,除非特别声明
急性胰腺炎(acute pancreatitis,AP)是一种常见的急腹症,由于病情严重度多样、并发症多样,且具有潜在的致死性,至今仍是颇具挑战性的疾病之一。随着对AP病理生理机制的深入研究,传统的胰腺炎相关影像学报告术语已在2012新亚特兰大国际共识中得到更新[1],这对于放射科医生来说,既是机遇也是挑战。在新指南下,如何规范化书写AP的影像学报告呢?笔者结合自身单位的临床实践和科研心得,皆在通过本文介绍AP的影像结构化报告(CT、MRI)模板,以利于影像报告书写的规范化和临床多学科的交流。
大多数AP患者有典型的临床发病过程、症状与体征、血清酶学特征,故影像学检查并非首选或必选[1]。但对于急腹症鉴别诊断存疑、患者血清酶学水平未达相关阈值、怀疑有胆石症及其他肿瘤性疾病伴存时,则需及时行影像学检查。此外,AP严重程度的评估、AP后期出现的各种局部并发症的检出及治疗后疗效评价也属于影像学检查的范畴[1]。
对于影像科医生来说,首先应了解患者的一般信息(性别、年龄、诱因、既往史、伴随疾病等),这些对于胰腺疾病的诊疗至关重要。譬如,男性易因酗酒发生酒精性AP,而女性易罹患胆石性AP;青少年AP的发生或与遗传因素、胆胰管解剖变异有关,而老年人AP可因高龄因素及多种基础疾病伴存而严重化、复杂化;妊娠、外伤、内镜下逆行胰胆管造影术(endoscopic retrograde cholangiopancreatography,ERCP)术等病史对于AP的病因判断很重要。此外,伴肾脏基础疾病/肾功能不全的患者则需避免行CT增强检查[1]。
新亚特兰大国际共识认为增强CT检查是AP患者首诊的主要影像学检查方法[1]。增强CT能明确AP的诊断,对胰腺坏死、局部并发症和AP严重程度均能作出较好的评价。对于有碘过敏史或急性肾功能不全的患者,可先行CT平扫;CT检查的相关参数见表1。对于孕妇、儿童和需要多次复查的患者,可运用MRI来评价胰腺及胰周情况。针对AP患者,笔者所在单位采用以下MRI序列和参数来综合评价(表2、表3),主要涵盖了T1WI(观察解剖、坏死、出血、肝脏脂肪变)、T2WI(观察坏死、积液)、磁共振胰胆管造影术(magnetic resonance cholangiopancreatography,MRCP)(观察胰胆管系统、积液)和增强扫描(观察血供情况)。由于每家医学中心拥有的MRI设备不一致(如购置于不同的厂家),成像序列和参数不尽相同,因此笔者推荐的序列与参数供借鉴参考(可结合自家设备灵活运用)。通过临床实践,大多AP患者是能完成MRI检查的;相对于增强CT,MRI对AP有如下优势:(1) MRI平扫对胰腺坏死的诊断能力可媲美增强CT[2];(2)MRI脂肪抑制T2WI对胰周脂肪坏死检出敏感性胜过CT[2];(3) MRI压脂T1WI对胰腺/胰周出血诊断敏感性超过CT[3];(4) MRI压脂T2WI对急性坏死性液体积聚和包裹性坏死内少量“非液性”物质的显示能力明显优于CT[2];(5)MRCP对主胰管改变及主胰管与假性囊肿/包裹性坏死的通连性方面优于CT;(6)无电离辐射。但MRI也存在扫描时间长、对某些重症AP患者难以完成检查或图像伪影过重、检查费用相对较高等缺点。值得一提的是,临床医生需明确各种影像学检查技术的优缺点,方可针对每个AP患者个体化选择适合的检查方法。

胰腺多排CT扫描参数
胰腺多排CT扫描参数
| 参数 | 具体细节 |
|---|---|
| 扫描类型 | 螺旋扫描 |
| 层厚 | 最好是亚毫米(0.5~1 mm) |
| 层间距 | 同层厚保持一致 |
| 静脉对比剂 | 最好是高浓度碘对比剂(>300 mgI/mL)且注射率为3~5 mL/s |
| 扫描时相(双期) | 胰腺实质期:40~50 s;门静脉期:65~70 s |
| 图像重建 | (1)轴位图像:层厚2~5 mm;(2)多平面重组:冠状面层厚2~3 mm,矢状面依据各中心自身需求确定;(3)最大密度投影或三维容积厚层重建(用于血管评价) |
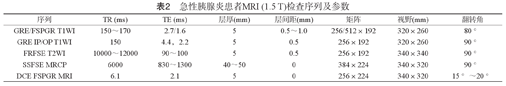
急性胰腺炎患者MRI (1.5 T)检查序列及参数
急性胰腺炎患者MRI (1.5 T)检查序列及参数
| 序列 | TR (ms) | TE (ms) | 层厚(mm) | 层间距(mm) | 矩阵 | 视野(mm) | 翻转角 |
|---|---|---|---|---|---|---|---|
| GRE/FSPGR T1WI | 150~170 | 2.7/1.6 | 5 | 0.5~1.0 | 256/512×192 | 320×260 | 80 ° |
| GRE IP/OP T1WI | 150 | 4.4,2.2 | 5 | 0.5 | 256×192 | 320×260 | 90 ° |
| FRFSE T2WI | 10000~12000 | 90~100 | 5 | 0.5 | 256×192 | 340×340 | 90 ° |
| SSFSE MRCP | 6000 | 830~1300 | 40~50 | 0 | 384×224 | 340×320 | 90 ° |
| DCE FSPGR MRI | 6.1 | 2.1 | 5 | 0 | 256×224 | 340×320 | 15 °~20 ° |

急性胰腺炎患者MRI (3.0 T)检查序列及参数
急性胰腺炎患者MRI (3.0 T)检查序列及参数
| 序列 | TR (ms) | TE (ms) | 层厚(mm) | 层间距(mm) | 矩阵 | 视野(mm) | 翻转角 |
|---|---|---|---|---|---|---|---|
| LAVA-Flex T1WI | 4.2 | 2.6,1.3 | 5 | 0 | 320~384×224 | 330×260 | 12 ° |
| FRFSE T2WI | 10000~12000 | 90~100 | 5 | 0.5 | 256×192 | 330×260 | 90 ° |
| SSFSE MRCP | 6000 | 1300 | 40~50 | 0 | 384×224 | 330×260 | 90 ° |
| DCE 3D-LAVA | 4.0 | 1.9 | 4~6 | 0 | 320×224 | 330×260 | 15 ° |
针对AP首次CT检查,新共识推荐在发病3 d后检查较好(最佳检查时机为起病后3~ 5 d)[1];理由是此时对胰腺坏死的确诊更可靠,且利于急性胰周液体积聚和急性坏死性积聚的鉴别。但本研究也发现在3 d内行CT或MRI检查(尤其是MRI),同样对AP严重程度的判断和预后评价有帮助[2,3]。
对于AP影像结构化报告需涵盖对胰腺本身、胰周情况、相关并发症和严重程度评分的描述;若有前片,还需对治疗前后病变的变化情况加以描述,具体见表4。

急性胰腺炎CT/MRI影像学结构化报告模板
急性胰腺炎CT/MRI影像学结构化报告模板
| 内容 | 描述 | ||
|---|---|---|---|
| 胰腺本身 | |||
| 形态 | 正常;弥漫性增大、局限性增大(胰头、颈或体、尾) | ||
| 边缘 | 清晰、欠清、不清 | ||
| 密度/信号 | 稍低/低、等、稍高/高密度(信号);增强后(若有):无强化或有强化(勾画感兴趣区测量均匀强化区CT值增加情况) | ||
| 胰腺坏死 | 有或无;若有,则描述以下内容 | ||
| 部位 | 胰头、颈、体、尾 | ||
| 范围 | <30%、30%~50%、>50%(胰腺坏死灶面积最大层面占整个胰腺面积的比例) | ||
| 密度/信号 | 稍低、低、水样密度;稍长T1稍长T2、长T1长T2信号;增强后(若有)是否强化 | ||
| 胰周改变 | 有或无 | ||
| 肾筋膜及腹膜 | 肾前筋膜/肾后筋膜/侧锥筋膜增厚(有或无);邻近侧腹壁腹膜增厚(有或无);若有增强,腹膜有无强化 | ||
| 胰周脂肪间隙 | 清晰、欠清、不清 | ||
| 胰周脂肪坏死1 | 有或无;若有,描述脂肪坏死的部位(腹膜后间隙、横结肠系膜、小肠系膜)、量(斑点状、斑片状、大片状)[2];有无合并出血,胰周脂肪坏死合并出血诊断标准:平扫CT上,出血液体密度超过35 HU;MRI压脂T1WI上,胰腺/胰周出现明显增高的液性信号[3] | ||
| 胰周(外)积液 | 有或无;若有,描述积液部位2、量[线条状、斑片状、大片状或包裹性的圆形、椭圆形(液性病灶直径或最长径)]、内容物(均匀液体密度/信号、不均质混杂密度/信号) | ||
| 局部并发症 | 有或无 | ||
| (1)胰腺/胰周积液(分类) | 部分特征见上述胰周(外)积液 | ||
| 急性胰周液体积聚(acute peripancreatic fluid collection,APFC) | 是或否 | ||
| 急性坏死性积聚(acute necrotic collection,ANC) | 是或否 | ||
| 胰腺假性囊肿(pancreatic pseudocyst,PP) | 是或否;囊壁厚度(最厚径,mm)、壁是否均匀,是否紧邻、推挤邻近脏器如胃、十二指肠 | ||
| 包裹性坏死(walled-off necrosis,WON) | 是或否;病灶壁厚度(最厚径,mm)、壁是否强化及强化方式,WON内“非液性物质”所占比(<10%、10%~40%、>40%)[4];WON是否紧邻、推挤邻近脏器如胃、十二指肠、升降结肠 | ||
| (2)积液合并感染 | 有或无;提示感染的征象(气泡征、气液平征) | ||
| 合并肠瘘 | 有或无;若有,描述积液与肠瘘处肠管的关系,指出肠瘘肠管段(如十二指肠、升结肠、降结肠) | ||
| (3)胰管中断综合征 | 有或无;若有,描述主胰管中断部位(如胰头颈、胰体)、中断上游/胰尾侧主胰管是否扩张(最大径,mm)及与相邻PP/WON的关系 | ||
| (4)血管并发症 | 有或无 | ||
| 静脉血栓形成 | 若有,描述累及静脉(如脾静脉、肠系膜上静脉、门静脉) | ||
| 胰源性门脉高压 | 若有,描述侧枝血管网(胃网膜左/右静脉、胃结肠干、胃短静脉、胃底贲门区黏膜下静脉、胃冠状静脉)的建立 | ||
| 假性动脉瘤 | 若有,描述受侵动脉(脾动脉、胰十二指肠动脉、胃十二指肠动脉、肠系膜上动脉、腹腔干等)及动脉瘤的直径 | ||
| 器官并发症/合并症 | 有或无 | ||
| 肝脏 | 脂肪肝[测量CT平扫肝实质最低区的CT值(HU);MRI上肝脏同反相位的信号差异] | ||
| 胆囊和胆管 | 胆囊肿大(最大横径)、胆囊结石(如泥沙状、颗粒状、填满型)、胆囊窝积液;胆总管结石(位置、数目、最大径)及最大管径 | ||
| 脾脏 | 脾梗塞、出血、假性囊肿等 | ||
| 肠管 | 肠郁张、肠梗阻、肠瘘(见上述积液合并感染部分) | ||
| 肺部 | 若同时行胸部CT,描述双肺炎变范围、胸腔积液与压迫性肺不张 | ||
| 皮下及肌间隙 | 胁腹壁的皮下、肌间隙水肿/积液 | ||
| 严重程度评分 | |||
| 急性胰腺炎严重度影像评分(CTSI/MRSI)[3] | 分(0~10分) | ||
| 以下评分系统为可选项 | |||
| 胰腺外炎症程度评分(extrapancreatic inflammation on CT,EPIC)[5] | 分(0~7分) | ||
| 出血评分(hemorrhage severity index,HSI)[3] | 分(0~3分) | ||
| 横结肠系膜受累评分(transverse-mesocolon involvement,TMI)[6] | 分(0~2分) | ||
| 小肠系膜受累评分(mesenterical involvement,MI)[7] | 分(0~2分) | ||
| 腹壁水肿评分(abdominal wall edema,AWE)[8] | 分(0~4分) | ||
| 与前片比较 | 若为AP复查,描述治疗后胰腺/胰周的改变;若为手术治疗,可描述外引流管和内覆膜金属支架的位置、液体积聚量改变情况 | ||
| 影像诊断(总体印象) | 若为治疗后,则描述变化 | ||
| (1)分型 | 间质水肿性或坏死性胰腺炎(胰腺和胰周坏死型、仅胰周坏死型、仅胰腺坏死型) | ||
| (2)坏死程度及影像评分 | 胰腺坏死者,坏死范围(<30%、30%~50%、>50%);CTSI/MRSI= (分) | ||
| (3)局部并发症 | (1)胰腺/胰周积液者,积液范围及命名(APFC、ANC、PP、WON);(2)是否合并感染;(3)血管并发症 | ||
| (4)器官并发症/合并症 | 其他器官阳性征象 | ||
注:1胰周脂肪坏死:CT上,表现为胰周积液内含有小圆形、斑片状、条状游离脂肪密度影;MRI上,系积液内含有上述形态的游离脂肪信号影,增强扫描无强化[2];2积液的部位包括:左/右肾旁前间隙、肾周间隙、肾旁后间隙、小网膜囊、双侧结肠旁沟、横结肠系膜、小肠系膜、大网膜、腹腔其他间隙、盆腔腹膜外间隙与盆腔、胸腔及纵隔。
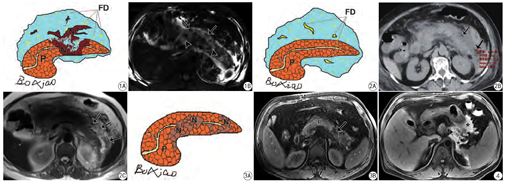
既往谈到坏死性胰腺炎,总想到“胰腺本身”坏死的严重度,即Balthazar提出的基于胰腺实质坏死程度的评分系统。然而,新亚特兰大共识将胰腺坏死重新划分为3个亚型:(1)胰腺和胰周坏死型/混合型(图1);(2)仅胰周坏死型(图2);(3)仅胰腺坏死型(图3)。尽管混合型在临床上最多,但后面两种亚型也需留意。正如近年来Meyrignac等[9]提出的胰周坏死量比Balthazar提出的胰腺坏死评分更适合AP严重度判定和预后分析。

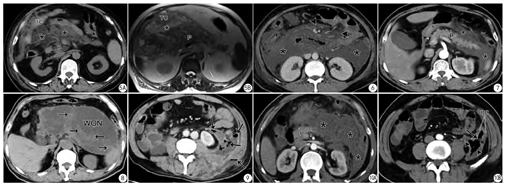
虽然在2012亚特兰大分类中未提及关于AP出血的术语,但病理学上仍划分为水肿性与出血坏死性胰腺炎(即病理上坏死灶的形成常伴随出血灶)。在临床工作中,发现胰周脂肪坏死合并出血是能够被影像学检出的。尽管早期发现这一病理状态可能不会影响患者的治疗,但笔者前期研究发现影像学上发现的胰腺/胰周出血(图4)与AP的严重程度有较好的相关性[3],对预后判定有帮助。
AP除了腹膜后间隙的相应变化外,还要观察腹膜下间隙的改变。对此笔者开展过临床研究:AP易累及横结肠系膜(发生率为61.9%)(图5);横结肠系膜评分(TMI score)与MRSI评分及APACHE-II评分均具有较好的相关性[6]。此外,AP也容易累及小肠系膜(发生率为67.9%)(图6);小肠系膜评分(MI score)与MRSI评分和APACHE II评分也具有较好的相关性[7]。这些腹膜下间隙受侵犯的征象同样有助于本病预后的评估。

新亚特兰大共识对AP的4种局部液体积聚进行了重新命名,值得注意的是,患者首次症状发作至CT/MRI检查的时间需弄清楚,这对液性积聚的命名很重要。通常,APFC(图7)或ANC(图1)发病4周后(含4周)就需报告为PP或WON(图8)。在描述WON的内容物特征时,需观察固体状坏死物占整个液性积聚的百分比,这对患者治疗方式的选择有价值。Rana等[4]通过对43例有症状的WON行内镜超声引导下治疗,WON坏死碎片占比<10%时,仅需一次内镜引流;而坏死碎片占比达10%~40%时需至少两次内镜引流方能治愈;当实性坏死碎片占比>40%时,要么需在超声内镜下行坏死组织清除术、要么需行外科手术坏死组织清除术。即随着实性碎片量的增多,经超声内镜操作的次数也明显增加[4]。
因为胰周液性积聚合并感染会导致AP患者的死亡率明显增高[1],故当APFC/ANC或PP/WON内出现气体影时,需在CT/MRI报告中予以描述并提示为感染性积聚(图9)。此外,胰周长期的液性积聚可能会腐蚀邻近的消化管而继发肠瘘,故需报告可能并发肠瘘的肠管段(图10)。合并有肠瘘的患者是外科手术的适应症。
胰腺/胰周的包裹性液性积聚若累及胰腺的全程(透壁性坏死),常可使主胰管破裂中断(图11),继发所谓的“主胰管中断综合征”。出现此类并发症也常常需要外科手术处理。
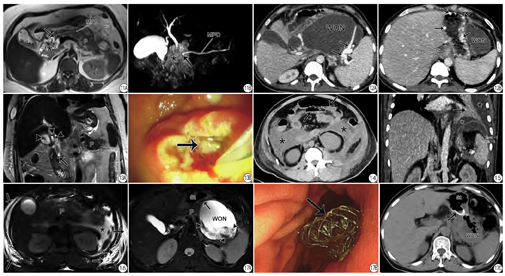

尽管慢性胰腺炎和胰腺癌是引起胰源性门脉高压的主要原因,但AP相关的胰源性门脉高压需要重视(图12)。笔者对633例连续AP患者行MRI检查发现胰源性门脉高压发病率为3.3%(21/633);且在轻度、中度、重度AP中的发病率逐渐增加[10]。此种并发症可能与患者后期消化道出血有关,故而在报告中予以描述。
肝脏大部分由门静脉系统供血,当发生AP时,很多炎性因子和游离脂肪酸可短时间内汇集于肝脏,故可见脂肪肝的CT/MRI表现。笔者前期研究发现66%的AP患者在MR上可检出脂肪肝征象;且通过IP/OP图像定量的肝脏信号差异值与MRSI呈正相关;随着血浆甘油三酯水平的降低,脂肪肝表现可逐步恢复正常[11]。胆系结石尤其是胆总管结石的诊断对临床治疗方式的选择有提示作用[12],故针对胆石性胰腺炎(图13)需着重描述。此外,AP炎症渗液对胃肠道影响也较大,常致肠管郁张、不全肠梗阻(图14)[13],这与患者腹胀、腹内压增高相关。
就胸部CT而言,AP多合并胸腔积液及压迫性肺不张的表现(图15),这可能与患者出现呼吸功能不全有关联;AP还可引起腹壁皮下水肿、积液改变(图16)。研究发现53.8%的AP患者在MR上出现胁腹壁水肿;且腹壁水肿评分与MRSI评分呈正相关,即腹壁水肿程度能间接反映AP的严重性[8]。
无。



























