
利用结构磁共振成像(structural MRI,sMRI)提取的区域特征来研究自闭症患者的大脑发育异常情况。
收集59例年龄2~ 4岁的自闭症儿童和50名年龄4~ 10岁的正常儿童的结构磁共振数据,利用freesurfer软件提取大脑皮层厚度、灰质和白质区域体积以及从预定义的感兴趣区域(region of interest,ROI)提取的若干皮层下结构等区域特征,最后经统计分析方法计算两组的差异。
通过对150项脑皮层与体积指标进行t检验组分析,发现自闭症患儿与正常对照组在其中66项上存在显著差异(P<0.05),与年龄较大的正常发育中的儿童相比,自闭症儿童的大脑表现出明显的过度生长模式,特别是在顶叶、枕叶、额叶、颞叶和楔前叶等区域。
本研究证实自闭症儿童存在大脑结构过度发育现象,增加的大脑尺寸是自闭症患儿早期大脑发育的重要结构特征,这将为自闭症的早期诊断和病情评估提供了有力工具。

本刊刊出的所有论文不代表本刊编委会的观点,除非特别声明
自闭症谱系障碍(autism spectrum disorder,ASD)是一种高度异质性的神经发育疾病[1],当前关于ASD的诊断标准集中在两个核心症状上:社交沟通障碍,利益受限和重复行为[2]。近年来,ASD的患病率迅速增加[3],据统计,每68名儿童中就有1名受到这种疾病的影响[4]。自闭症谱系障碍具有多种发病原因和病程表现,无法由单一的自闭症表型所定义[5],使得其神经解剖学本质难以描述。在之前的研究文献中,一些影响自闭症的核心脑结构被反复强调,例如额叶、顶叶和边缘系统的异常,以及基底节和小脑的异常[6]。目前一个普遍的共识是,对于自闭症患儿的早期诊断和早期干预至关重要,这将对患者生存质量的改善产生重大影响[7]。
MRI允许在不使用电离辐射的情况下评估发育中的大脑的解剖和生理结构。人脑的成熟是一个长期而持久的过程,不同的大脑结构、组织类型和神经回路具有不同的发展轨迹,在整个生命历程中经历着动态的变化。典型发育中的青少年的纵向MRI扫描显示,白质体积随年龄持续增加,而灰质体积发展呈现倒U形轨迹,峰值会出现在不同时间与不同脑区[8]。对于幼儿早期大脑发育以及头围差异的研究表明,自闭症患者的大脑会经历和年龄相关的大脑异常增长[9]。对于2~ 4岁自闭儿童以及家族性自闭症高风险幼儿的结构磁共振成像(structural MRI,sMRI)研究证实,自闭症新生儿在出生时的全脑体积(total brain volume,TBV)正常或偏小,而在2~ 4岁时90%的自闭症儿童的平均TBV大于正常儿童,与之相比,成年自闭症患者并不比正常人有更大的TBV[10]。一项关于1.5 ~5岁儿童大脑生长的纵向研究发现,自闭症儿童大脑灰质和白质显著增大,表明这种大脑的快速生长开始于2岁之前[11]。另一项纵向研究发现,在2岁和4~ 5岁时,自闭症儿童的大脑颞叶白质有所增大,但在这个年龄区间内,大脑的生长速度与正常人相仿。然而,目前关于自闭症患儿早期大脑过度发育的研究在特定脑区上的结果还存在着诸多不一致性,除去在颞叶、顶叶区域自闭症患儿的大脑异常增长相对确定之外,在其他脑区的比较研究结果仍然是多样化和混杂的。本研究通过sMRI提取的区域特征来研究自闭症患者的大脑发育异常。涉及区域特征包括大脑皮层厚度、灰质和白质区域体积以及从预定义的感兴趣区域提取的若干皮层下结构,本研究得出的结果验证和拓展了之前相关自闭症研究的结论。
自闭症病例组:2018年1~6月就诊于我院的59例自闭症儿童,年龄2.2~ 4岁,平均年龄3.55岁。入选标准符合ICD-10中自闭症的诊断标准[12]。排除特发性语言发育迟缓、儿童少年精神分裂症、强迫症、雷特综合征和儿童瓦解性精神障碍、精神发育迟滞、阿斯伯格综合征等疾病患者。均无癫痫发作史。由家长根据患儿的日常行为填写修订版儿童行为评估量表[13],分值越高症状越严重。
正常对照组:2018年1~6月通过招募选取年龄、性别、智商(intelligence quotient,IQ)与自闭症尽量匹配的健康儿童50名。年龄4~ 10岁,平均6.07岁。与家长进行访谈,询问儿童的出生史、语言及运动发育史、有否异常行为史;与孩子面谈,并进行行为学观察、详细的体格检查,排除躯体疾病、神经系统疾病、精神发育迟滞、注意力缺陷多动障碍、学习障碍等疾患以及有头部外伤的儿童。
两组儿童在本研究前均没有接受精神药物治疗。患儿监护人均明白本研究目的和方法,并签署知情同意书,本研究得到本医院伦理委员会的批准。
本课题为病例-对照研究。
由2名资深儿童科医师依据自闭性障碍诊断访谈以及ICD-10中有关自闭性障碍的诊断标准进行诊断,诊断不一致者不入组;然后使用Binet智力测试对两组儿童进行IQ测试,使用CBQ-R进行行为评估。
使用Philips 1.5 T Achieva超导型磁共振仪,以海绵垫固定受试者头部,对病例组中不能合作者给予10%的水合氯醛口服入睡后进行扫描。每例先行常规T1、T2头颅MRI扫描定位并排除脑部肉眼可见病变,再行头部高分辨率3D矢状位T1扫描,层厚1 mm,分辨率1 mm×1 mm×1 mm,各向同性。
使用安装在Linux工作站上的FreeSurfer6.0商用软件(FreeSurfer,http://surfer.nmr.mgh.harvard.edu/)对所有数据进行预处理与自动分割。FreeSurfer软件为sMRI数据提供完整的处理流,包括:颅骨剥离,B1偏置场校正和灰白质分割;重建皮质表面模型(灰白色边界表面和软脑膜表面);标记皮质表面上的区域以及皮层下的大脑结构;用立体定位图非线性配准个体的皮质表面;统计分析形态测量差异。
预处理后的数据使用Matlab 2018a进行统计学分析。正态性检验应用Jarque-Bera检验。因为有部分指标在样本中差异较大,不满足正态分布,故采用Wilcoxon秩和检验[14]来评价两组数据中对应脑区的统计差异。P<0.05表示差异有统计学意义。
经统计分析,在150项脑皮层与体积的指标对比中,ASD组与正常对照组有66项存在显著差异。其中差别最大的部分集中在顶叶、枕叶、额叶、颞叶、楔前叶、小脑、脑干和杏仁核等。
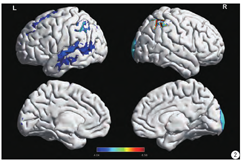
与正常对照组比较,虽然自闭症儿童平均年龄更小,但在额叶、顶叶、枕叶、颞叶、楔前叶部分的皮层厚度显著高于正常儿童,表现出和年龄相关的大脑异常发育(图1,第1~2行)。同时,自闭症儿童在右外侧枕叶、右侧顶上区、左侧颞中回、右侧额下回三角部的脑体积显著高于正常人(图1,第3行),在小脑、脑干和杏仁核部分,自闭症儿童的数值低于正常儿童。


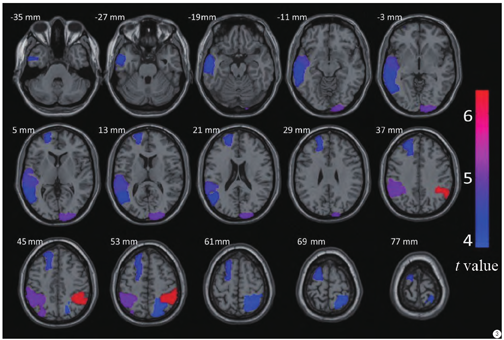
通过对FreeSurfer计算得到的结果进行t检验分析,结果见图2和图3,自闭症与正常儿童皮层厚度差异最大的部位集中于双侧顶下小叶、右侧枕叶、右侧额上回、左侧额中回上部以及左侧颞中回。


sMRI是自闭症临床评估的重要影像学方式[15],与其他更先进的功能影像相比,它通常更容易获得且成本更低。因此,ASD儿童结构磁共振相关研究对ASD的早期诊断和评估至关重要。
过往的研究表明ASD患者是存在大脑容量的增加[16],其他一致的发现包括额叶和颞叶的脑容量增加[17,18]、脑脊液和侧脑室容量增加[19]等,这与脑部过度生成理论是一致的。本文利用sMRI数据考察自闭症患儿的大脑异常发育。对于自闭症儿童的早期脑生长的相关研究表明,大脑体积并非以一致的均匀方式变化,不同脑区的体积增加、灰质和白质异常表明分布于全脑的过度生长。其中,增加的额叶体积[20]是最为可靠的发现之一。一项对13例自闭症男孩与28例的对照组(14例典型发育,14例语言障碍)的sMRI研究发现,所有脑叶的放射白质外区的体积均有所增加,但主要增大的部分位于额叶[21],这与本文得到的自闭症儿童双侧大脑在额中回下部与上部以及额上回皮层厚度的增加结果一致。
之前的研究已发现颞叶在自闭症患者中的影响,且与自闭症患者典型的社会活动异常有关[22]。这与本研究中发现的自闭症儿童左侧颞中回在体积和皮层厚度上的增加一致。这些结果证实了在之前的研究中确定的这两个区域的重要性,即额叶和颞叶体积对自闭症最有鉴别力。另外,本研究给出的其他自闭症儿童大脑增长较快的区域包括顶叶下回、枕叶外侧与楔前叶,对于这些区域的增大或减小,已有研究中存在相互不一致的结论,这可能是源于自闭症在病因上的复杂性。
颞叶是受自闭症影响最为显著的脑区域之一,在13项回顾性研究中发现,颞上回、颞中回和颞下回的灰质体积有所增加[16]。关于自闭症儿童大脑异常发育过程中颞叶的参与在以前已经被注意到,并且可能与自闭症的典型的社会情感异常有关。另外9项研究中也报告了眶额皮层和中/上/下额叶的灰质体积增加[23],这些部位与自闭症导致额叶增大的结论一致。在另一项关于自闭症的研究中[24],这两个区域的重要性进一步得到巩固。因此可以认为,额叶和颞叶体积增加是自闭症最具辨别性的特征。
此外,在4项研究的顶叶区域和另外4项研究的枕叶区域观察到灰质体积降低。而目前尚不清楚区域白质体积是否导致了自闭症儿童大脑的这种过度增长。与区域性白质体积相关的最一致的发现表明,自闭症脑岛部位的白质增加,而脑干中的白质减少。在包含17项基于体素形态学的同质队列(4~ 64岁,主要是男性)研究中,最常见的是颞叶的灰质体积增加(76%)和额叶的灰质体积增加(41%),而顶叶、枕叶和边缘叶的灰质变化大多并不明显(64%~76%)[23]。
本研究结果表明,ASD儿童的大脑结构表现出明显的过度生长模式,特别是额叶和颞叶体积的增加是其最具辨识性的特征,这为ASD的早期诊断提供了有力参考。最近几年也确实出现了比较多的研究[25,26,27,28],其利用先进的机器学习、深度学习算法,通过收集ASD与正常儿童的sMRI数据识别早期ASD患者。2017年JAMA上发表的一项研究表明对24个月或更早的婴儿进行早期脑部扫描可以预测自闭症谱系障碍的迹象[26]。另外有两项研究也有类似的看法,其中发表在Nature上的一项研究发现在15名高危婴儿中,在12~ 24个月之间观察到的大脑体积过度增长先于6~ 12个月大的皮质表面积,他们开发的一种深度学习算法利用6个月的婴儿大脑sMRI的表面积信息,预测了个别高危儿童在24个月时的自闭症(阳性预测值为81%,敏感性为88%)[27]。另一项发表在Science Translational Medicine的研究对所有48例未诊断为ASD的6个月大婴儿均预测正确,特异性为100%(95%CI:90.8~ 100),阴性预测值为96.0%(95%CI:85.1~ 99.3)[28]。另外还有一些研究结合sMRI和功能影像数据一起预测ASD,也取得了不错的效果[29,30]。但考虑到功能MRI影像采集时间较长,标准不统一,同时ASD患儿年龄普遍偏小,配合度差,临床可行性欠佳,所以sMRI仍然是未来ASD早期预测的最佳手段。
磁共振检查使研究人员和临床医生能够无创地检查大脑解剖结构,sMRI检查因其高对比敏感度和空间分辨率而被广泛用于研究脑形态学,在ASD的早期诊断和干预中也起着越来越重要的作用。但值得注意的是,在多数区域所观察到的灰质和白质变化,有相当数量的研究发现,自闭症中这些区域的体积变化是相互矛盾的。这可能反映了自闭症的异质性和可能的细微结构效应,但也可能是由于体素形态学方法的潜在局限性。有几种方法可以解决这一问题,例如使用大型的公开数据集,如孤独症脑成像数据交换倡议,以克服统计能力的局限性。或者使用更大规模的特征,如全脑或特定脑叶的ROI,可以大大减少进行的统计测试数量,并减少多重比较校正的影响。此外,使用标准统计检验来比较ROI的体积也提供了有效脑区大小的度量,这有助于发现阐明自闭症的临床意义的生物标志物,而不仅仅是统计意义上的生物标志物。
无。



























