
通过氢质子磁共振波谱技术(proton magnetic resonance spectroscopy,1H-MRS)离体及在体检测异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)突变后产生的代谢物2-羟基戊二酸(2-hydroxyglutarate,2HG),探索临床3.0 T核磁共振机应用长回波时间(echo time,TE)单体素不对称自旋回波点解析波谱(point-resolved spectroscopy,PRESS)序列检测2HG的效能。
配制包含不同代谢物的两组体外水模,于T2WI液体衰减反转恢复序列(fluid attenuated inversion recovery,FLAIR)像上对各水模中心位置进行MRS感兴趣定位,采用长TE PRESS序列进行MRS成像。使用相同扫描参数,结合患者T1WI、T1WI增强图像,对拟诊为低级别胶质瘤的4例患者进行脑MRS成像,以术后基因检测获得的IDH基因突变状态作为金标准。水模及在体波谱中代谢物的绝对浓度值均通过LC model软件拟合后获得。
体外水模扫描结果显示,当2HG配制浓度在2~ 16 mmol/L时,均能有效检测出2HG,相比2HG配制的真实浓度值,通过LC model计算得到的2HG绝对浓度值降低,而水模中2HG/谷氨酸(glutamate,Glu)的浓度比值与实际比值接近。在体扫描结果显示,在符合入组标准的3例患者中,2例IDH突变型胶质瘤患者均有效检测出2HG蓄积,1例IDH野生型胶质瘤未检测出2HG蓄积。
水模扫描结果表明,临床环境中通过长TE PRESS序列检测2HG浓度水平时,低浓度2HG会被掩盖,从而增加假阴性的结果。而2HG/Glu的比值与实际比值较为接近,提示用比值替代绝对浓度可能更具准确性。结合在体扫描结果表明,临床环境中,在常规胶质瘤影像序列中加入长TE PRESS序列检测2HG蓄积水平,从而间接预测IDH基因突变状态具有较好的可行性,这对于胶质瘤分子分型的术前无创诊断、指导治疗策略及预后评估具有重要意义。

本刊刊出的所有论文不代表本刊编委会的观点,除非特别声明
异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)基因的突变常发生在约80%的低级别胶质瘤和约85%的继发性胶质母细胞瘤中[1,2,3]。IDH基因突变后催化α-酮戊二酸产生新的代谢物2-羟基戊二酸(2-hydroxyglutarate,2HG),继而通过一系列下游代谢途径促进肿瘤的发生发展[4,5,6,7]。相比于野生型胶质瘤或健康脑组织,IDH突变型胶质瘤患者2HG蓄积水平升高10~ 100倍(5~ 35 mmol/L)[3],超过了磁共振波谱(magnetic resonance spectroscopy,MRS)检测的阈值1 mmol/L[8],使得通过MRS无创检测2HG成为可能,这对于胶质瘤分子分型的术前无创诊断、指导治疗策略及预后评估具有重要意义。
目前利用MRS检测2HG的方法多种多样,主要包括基于单体素不对称自旋回波点解析波谱(point-resolved spectroscopy,PRESS)序列的长回波时间(echo time,TE)[9,10,11,12,13,14](TE=97 ms)及短TE[15,16,17,18,19,20](TE=30~ 35 ms)、差分谱编辑[8, 12]及二维法[8, 21]。尽管如此,由于2HG分子具有复杂的J-偶联相互作用,MRS检测中表现为多重谱线,且与目前常见脑内化合物峰有明显的信号重叠,因此清晰显示2HG仍具有挑战性。此外,2HG的在体MRS检测方法仍存在一些准确性及假阳性等问题。在临床3.0 T磁共振可准确显示2HG的MRS方法尚未得到普遍应用,判断IDH突变的阈值尚未确立。与在体研究相比,离体水模内的代谢物浓度已知,代谢物之间独立存在,不会发生相互转化,从而能更加简单有效地对检测结果进行对比分析,因此本研究旨在通过离体水模及在体研究探索在临床3.0 T核磁机上应用长TE PRESS序列检测2HG蓄积的效能。
配置体外水模1(PH=7.0),加入N-乙酰天冬氨酰酸(N-acetylaspartate,NAA,12.5 mmol/L)、肌酸(creatine,Cr,10.0 mmol/L)、胆碱(choline,Cho,3.0 mmol/L)、2HG (9 mmol/L)、谷氨酸(glutamate,Glu,12.5 mmol/L)、谷氨酰胺(glutamine,Gln,12.5 mmol/L)、γ-氨基丁酸(γ-aminobutyric acid,GABA,2.0 mmol/L)。
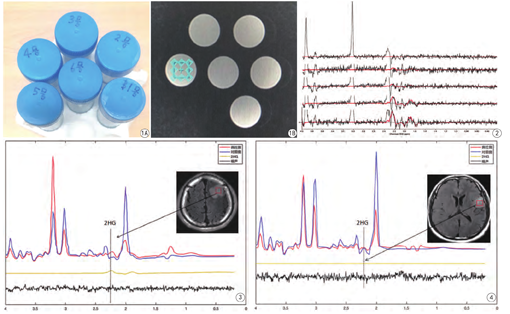
配置一组梯度水模2(图1A),共6个50 mL圆柱体(PH=7.2~7.4),均加入Glu 10 mmol/L,Cr 10 mmol/L,再分别加入2HG 0.5、1、2、4、8、16 mmol/L。

本研究已通过北京天坛医院伦理委员会批准,所有患者检查前均被告知本研究的检查目的、方法和注意事项,并签署知情同意书。
纳入标准:(1)术前MRI检查初步诊断为低级别胶质瘤的患者,未进行过针对胶质瘤的任何治疗;(2)拟在北京天坛医院进行肿瘤切除手术可获取病理结果的患者;(3)获得IDH基因突变信息的患者。
排除标准:(1)经手术病理证实非胶质瘤患者;(2)存在明显伪影而不能进行图像后处理的患者;(3)体内存在影响MRI检查的植入物,如起搏器、动脉瘤夹和颅面部植入物等;(4)术前检查患有心肺肾功能衰竭患者。
采用GE 3.0 T (Discovery MR750)磁共振机,常规MRI扫描及长TE PRESS序列扫描均采用32通道相控阵头线圈,MRI常规平扫参数:T2WI FLAIR (TR 8000 ms,TE 145 ms,FOV 24 cm×24 cm,矩阵256×224,层厚5 mm,激励次数1,成像时间129 s);T1WI轴位(TR 1750 ms,TE 19.6 ms,FOV 24 cm×24 cm,矩阵320× 256,层厚5 mm,激励次数1,成像时间92 s);T1WI增强后的轴位(TR 1750 ms,TE 24 ms,FOV 24 cm× 24 cm,矩阵320×256,层厚5 mm,激励次数=1,成像时间62 s)、冠状位(TR 1946 ms,TE 24 ms,FOV 24 cm×24 cm,矩阵320×192,层厚6 mm,激励次数= 1,成像时间38 s)、矢状位(TR 1850 ms,TE 24 ms,FOV 26 cm×26 cm,矩阵320×256,层厚5 mm,激励次数=1,成像时间50 s)。
长TE PRESS序列:在参考文献的基础上[14],由GE工程师协助通过计算机模拟计算临近不同TE值下的谱图,最终确定总TE时间为97 ms (TE1=26 ms,TE2= 71 ms)。在基本相同的条件下,于T2WI FLAIR像上对各水模中心位置进行MRS感兴趣区(region of interest,ROI)定位(图1B),ROI大小为20 mm×20 mm×20 mm。其余成像参数:TR 1500 ms,层厚20 mm,FOV 24 cm×24 cm,激励次数2,成像时间为222 s。采用相同扫描参数,由2名经验丰富的放射科医师对4例患者肿瘤区进行定位,结合患者T1WI、T1WI增强图像,选择T2WI FLAIR上肿瘤最大层面作为MRS定位的层面,ROI尽量放置于肿瘤实性区,避开肿瘤内出血、坏死及囊变的区域,镜像对称脑组织正常区放置同样大小的ROI。
经LC model 6.3版本(Stephen Provencher,Oakville,Ontario,Canada)软件对谱线进行拟合[22],谱线半高宽均<0.08,并以未抑制的水峰信号峰值作为内部参考,估算代谢产物浓度的绝对定量。LC model基础集包含18种代谢物,分别是:2-羟基戊二酸、谷氨酸、谷氨酰胺、γ-氨基丁酸、N-乙酰天冬氨酰酸、肌酸、丙氨酸、天门冬氨酸、葡萄糖、甘氨酸、甘油磷酰胆碱、胆碱磷酸、谷胱甘肽、肌醇、乳酸、N-乙酰天冬氨酰谷氨酸、青蟹肌醇以及牛磺酸。波谱的分析范围为0.2~ 4.0 ppm。以克拉美-罗下界(cramer-rao lower bound,CRLB)评估所得到的绝对代谢物浓度的可信度。设定当2HG绝对浓度小于1 mmol/L或者2HG的CRLB >50%时所得结果不可信,将其视为无2HG存在[9,15]。患者图像的绘制均通过Matlab进行。
组织病理均采用苏木精和伊红(H&E)染色,并根据2016年世界卫生组织中枢神经系统肿瘤进行分类和分级。
基于北京市神经外科研究所分子病理检测平台,采用聚合酶链反应(polymerase chain reaction,PCR)焦磷酸测序法对提取的肿瘤样本DNA进行IDH1和IDH2基因突变的检测(均采用QIAamp DNA Mini Kit试剂盒提取,提取产物采用NanoDrop ND-1000紫外分光光度仪进行DNA的定量测定,1%琼脂糖凝胶电泳检测DNA的完整性,并将合格样品储存于-80℃冰箱中)。IDH1 R132位点及R172位点经过PCR扩增(IDH1正向引物: 5′ -GCTTGTGAGT-GGATGGGTAAAAC-3′ ,反向引物:Biotin-5′TTGCCAACATGA CTTACTTGATC-3′;IDH2正向引物:5′ -ATCCTGGGGGGGACTGTCTT-3′ ;反向引物:Biotin-5′ -CTCTCCACCCTGGCCTACCT- 3′ ),进而将PCR产物经过纯化后得到单链的DNA,与40 μL测序溶液进行混合,80℃变性2 min后,使用PyroMark Q24 ID测序仪进行测序分析(IDH1测序引物:5′ -TGG-ATGGGTAAAACCT-3′ ;IDH2测序引物:5′ -AGCC-CATCACCATTG-3′ )。
对于体外水模1,谱线经过LC model拟合后,得到2HG (6.2 mmol/L,8%),Glu (12.4 mmol/L,3%),Gln (5.2 mmol/L,5%),GABA (5.2 mmol/L,5%),NAA(15.1 mmol/L,2%),Cr (9.8 mmol/L,1%),Cho (2.5 mmol/L,4%)。梯度水模得到的参数如表1,图2为梯度水模中2HG波峰的单独显示,随着水模中2HG浓度的增加,2.25 ppm及1.9 ppm处可见逐渐明显的2HG波峰。
梯度水模采集参数
Parameters of gradient phantoms
梯度水模采集参数
Parameters of gradient phantoms
| 编号 | 代谢物浓度(mmol/L) | S/N | FWHM | 测定浓度(mmol/L,CRLB%) | 2HG/Glu |
|---|---|---|---|---|---|
| 1 | 2HG0.5+Glu10+Cr10 | 30 | 0.019 | 2HG0+Glu6.6(4%)+Cr8.6(1%) | 0.00 |
| 2 | 2HG1.0+Glu10+Cr10 | 24 | 0.019 | 2HG0.4(98%)+Glu6.4(5%)+Cr8.9(2%) | 0.06 |
| 3 | 2HG2.0+Glu10+Cr10 | 30 | 0.019 | 2HG1.6(25%)+Glu7.9(4%)+Cr9.3(1%) | 0.20 |
| 4 | 2HG4.0+Glu10+Cr10 | 29 | 0.024 | 2HG2.1(12%)+Glu6.8(5%)+Cr10.2(1%) | 0.31 |
| 5 | 2HG8.0+Glu10+Cr10 | 32 | 0.038 | 2HG4.8(6%)+Glu6.8(4%)+Cr9.6(1%) | 0.71 |
| 6 | 2HG16.0+Glu10+Cr10 | 26 | 0.019 | 2HG9.7(5%)+Glu5.9(6%)+Cr9.2(2%) | 1.64 |
注:S/N:信噪比;FWHM:半高宽;CRLB:克拉美-罗下界;2HG:2-羟基戊二酸;Glu:谷氨酸;Cr:肌酸。
在术前诊断为低级别胶质瘤的4例患者中,共3例患者入组,患者信息见表2. 1例患者病理结果为脑组织胶质细胞增生,根据排除标准,未入组。图3为IDH1基因突变型胶质瘤患者之一,经过LC model拟合后的谱线,于2.25 ppm处出现明显的2HG蓄积波峰。图4为IDH野生型胶质瘤患者,谱线经过LC model拟合后于2.25 ppm处未见2HG蓄积波峰。
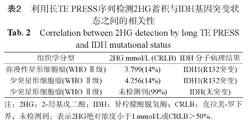
利用长TE PRESS序列检测2HG蓄积与IDH基因突变状态之间的相关性
Correlation between 2HG detection by long TE PRESS and IDH mutational status
利用长TE PRESS序列检测2HG蓄积与IDH基因突变状态之间的相关性
Correlation between 2HG detection by long TE PRESS and IDH mutational status
| 组织学分型 | 2HG mmol/L (CRLB) | IDH分子病理结果 |
|---|---|---|
| 弥漫性星形细胞瘤(WHO Ⅱ级) | 3.799(14%) | IDH1(R132突变) |
| 少突星形细胞瘤(WHO Ⅱ级) | 4.256(14%) | IDH1(R132突变) |
| 少突星形细胞瘤(WHO Ⅱ级) | 未检测到(99%) | IDH(无突变) |
注:2HG:2-羟基戊二酸;IDH:异柠檬酸脱氢酶;CRLB:克拉美-罗下界;未检测到:表示2HG绝对浓度小于1 mmol/L或CRLB>50%。
目前,检测IDH突变的金标准为免疫组织化学方法及基因检测,均需通过手术或活检组织取样,显然存在一定的风险。此外,术中所取样本仅为肿瘤的部分组织,由于肿瘤存在异质性,可能会增加假阴性的结果。MRS技术作为目前唯一能够体外进行检测活体化学物质的方法,已经成为广泛应用于监测不同类型恶性肿瘤代谢的定量分析工具[23],其中MRS非侵袭性检测2HG的研究初见成效,目前2HG MRS主要应用于对IDH突变型胶质瘤的诊断[10]、复发与假性进展的鉴别[11]、治疗方案的制订[24,25]、靶向治疗效果的监测[26,27,28,29]等多个方面,表现出广阔的临床应用前景,因此2HG MRS作为一种简便、可重复且灵活的无创检测在体IDH基因突变状态的方法成为研究热点。
目前利用MRS检测2HG的方法多种多样。在使用常规的短TE MRS时,2HG在2.25 ppm的信号常与周围的信号,比如GABA、Glu、Gln出现重叠[12,13,14]而出现假阳性,假阳性率可高达26%[17],虽然短TE在临床中广泛应用,但由于假阳性检出率过高,限制了短TE MRS法检测2HG的实际应用潜力。Choi等[12]通过调节TE1与TE2的值,使2HG在2.25 ppm处的峰达到最高,有效地克服了2HG信号与其他代谢物在短回波时间内发生重叠的问题,从而有效降低了假阳性率,其灵敏度和特异性可达到100%。但在使用长TE时,常需要2HG达到一定的浓度(1.5~ 2.0 mmol/L)才可有效显示2HG峰[16]。二维相关谱(correlation spectroscopy,COSY)具有解决重叠代谢物的最高分辨率,但扫描时间长且量化复杂。差分光谱法提高了灵敏度,量化较简单,但易受到减法误差的影响。最新Meta分析表明[24],目前,在对2HG MRS的序列选择中,多数采用基于长TE及短TE的PRESS序列,长TE的敏感性为92%,特异性为97%,而短TE的敏感性为90%,特异性为88%,因此,在未来的临床使用中,选择长TE或许能更有效地用于检测2HG。
本研究通过体外水模试验探索常规临床工作中应用长TE PRESS序列检测2HG的精确度及准确度。水模1实验的结果中,2HG能够较好地从易与其信号发生重叠的物质中分离鉴别,但是检测出的浓度低于实际浓度,主要原因除了其他代谢物的混淆效应之外,为了最大程度模拟常规临床工作中的状态,本研究采用的是GE的自动匀场,临床工作中的环境因素及硬件设备的使用状态均会影响场强的稳定性,从而影响检测的精准度。因此,本研究同时设置了一组梯度水模,用于确立在临床环境中长TE PRESS序列有效检测2HG的浓度下限,本试验结果表明,当2HG配制浓度达到2 mmol/L时,长TE PRESS序列能可靠有效检测出2HG,而IDH突变型胶质瘤中的2HG蓄积水平会升高几百个数量级(5~ 35 mmol/L)[3],本方法可以有效检测该浓度范围内的2HG。此外,在梯度水模实验中,当2HG的实际浓度大于2 mmol/L时,2HG/Glu的比值与实际比值较接近,间接证实本研究结果的准确性及可信度,提示用比值替代绝对浓度测量可能更具有准确性。使用MRS对体外水模进行试验的研究相对较少,其中Bertolino等[30]利用短TE的方法对水模进行体外试验的结果显示,由于NAA及Glu的混淆作用,在体检测2HG将会低估1~ 2 mmol/L的2HG,从而增加假阴性的结果。Berrington等[31]通过体外水模试验表明,当2HG浓度在0.1 mmol/L时,相比于长TE PRESS序列53%的CRLB值,优化后的semi-LASER (TE=110)序列CRLB值达到19%,尽管如此低的2HG浓度在体内难以检测,但说明2HG浓度较低时,semi-LASER序列相比于长TE PRESS序列可能可以有效改善检测性能,有利于提高小体积胶质瘤检测的敏感性。相比于之前的研究,本研究所使用的长TE方法相比于短TE能够有效减少其他代谢物对2HG的混淆效应,在定量2HG方面更有优势[32]。且本研究配制的梯度水模中加入了代谢物Glu,用于检测其他代谢物对2HG的混淆效应,在一定程度上真实反映了在体MRS检测2HG客观存在的情况。
但本研究进行的梯度水模试验中仍存在以下几方面的限制:首先,本研究配制的梯度水模仅包含2HG、Glu以及Cr,而在脑实质中,脑内其他临近2.25 ppm处的代谢物同样会产生混淆效应,比如GABA、Gln、NAA等,从而影响MRS检测2HG的准确性。且本研究仅设定了不同浓度的2HG,其他代谢物的含量均为一定值,未探究不同浓度的Glu或其他代谢物对MRS检测2HG的影响。其次,脑内代谢物会受到内环境的影响而发生不断变化,但水模内的PH值、代谢物的浓度以及对磁场的敏感性在一定时间内不会产生变化,代谢物之间是独立存在的,不会发生相互转化,从而无法完全实时模拟脑内真实的代谢情况。尽管由水模试验产生的固有限制不可避免,但是由于可以对代谢物进行单独分析,从而可以更加简单有效地检验长TE PRESS序列检测2HG的效能。在后续的研究过程中,配制更多含有不同浓度及不同代谢物的水模试验模型是必要的,从而能够更详细地分析其他代谢物对MRS检测2HG的影响,为MRS在体检测2HG提供更多的理论支持。
在体试验中,入组的3例患者均有效地预测了IDH基因的突变状态。本研究主要着重于通过水模判断测量的可行性及精准度,并初步应用于在体探索该序列在实践中的有效性和可操作性,所以纳入人数较少。本研究的后续工作将会纳入更多的胶质瘤患者进行进一步的研究,为临床无创性判断IDH基因突变状态、动态观察IDH突变型胶质瘤患者的治疗效果、判断预后情况确立新的影像学指标。
总之,本研究通过离体水模实验表明,在临床环境中,使用长TE PRESS序列检测2HG,由于代谢物的混淆效应以及环境、硬件因素对检测结果的影响,使得浓度低于2 mmol/L的2HG无法有效检出,从而导致出现假阴性结果。但该方法具有较高的特异性,表明一旦有效检测出2HG即存在IDH基因突变。结合在体研究表明,利用长TE PRESS序列可以有效地检测IDH突变胶质瘤患者的2HG蓄积水平,这对IDH突变型胶质瘤患者的临床管理具有重要意义。
感谢吴仁华教授、高培毅教授在课题实施过程中给予的指导和帮助。
无。



























