
探讨成人髓母细胞瘤多模态MRI表现,加深对该肿瘤的认识及提高术前诊断水平。
搜集经手术病理证实的16例成人髓母细胞瘤患者的临床资料及MR图像进行回顾性分析。
1例位于桥小脑角区,1例位于右枕顶叶伴出血,7例位于小脑半球,6例位于蚓部-四脑室,1例多发;8例有小血管穿行。肿瘤均有囊变,实性成分T1WI呈等或稍低信号,T2WI及液体衰减反转恢复序列(fluid attenuated inversion recovery,FLAIR)序列呈等或稍高信号;扩散加权成像(diffusion weighted imaging,DWI)为高信号,平均ADC值为0.589×10-3 mm2/s;5例中度强化,4例明显强化,5例斑片状或片絮样轻度强化。7例有磁共振波谱(MR spectroscopy,MRS),Cho峰明显升高,NAA峰明显降低,Cho/NAA值(≥4.8)明显增高;3例行扩散张量成像(diffusion tensor imaging,DTI)检查,瘤周白质纤维束推移、部分断裂。
成人髓母细胞瘤多模态MRI表现有一定的特征,有助于术前对该肿瘤做出准确诊断。

本刊刊出的所有论文不代表本刊编委会的观点,除非特别声明
髓母细胞瘤(medulloblastoma,MB)是最常见的儿童中枢神经系统恶性肿瘤,占儿童脑肿瘤的10%~25%[1],好发于小脑上蚓部及四脑室。与儿童相比,成人髓母细胞瘤发病率低,文献报道在成人脑肿瘤中占0.5%~1 %[2]。影像学表现无特征性,容易误诊。笔者搜集2013年1月至2019年8月术后经病理证实的16例成人髓母细胞瘤患者资料,回顾性分析其MRI、扩散加权成像(diffusion-weighted imaging,DWI)、氢质子波谱成像(1H-magnetic resonance spectroscopy,1H-MRS)、扩散张量成像(diffusion tensor imaging,DTI)表现,以提高对其术前诊断水平。
回顾性分析兰州大学第二临床医院经病理证实的16例成人髓母细胞瘤患者,男性8例,女性8例;年龄17~47岁,平均27.5岁。病程7 d至13个月,伴有头晕、头痛、恶心、呕吐及步态不稳等表现。
本组使用Siemens 3.0 T VERIO MRI扫描仪,检查前患者均未接受放化疗及手术治疗。15例行MR平扫、增强及DWI扫描,8例行液体衰减反转恢复序列(fluid attenuated inversion recovery,FLAIR)扫描,1例行MRI直接增强扫描,7例行MRS扫描,3例行DTI检查(弥散梯度场取256个不同方向)。主要观察肿瘤的位置、信号特点、强化方式、水肿程度及DTI表现。分析肿瘤表观扩散系数(apparent diffusion coefficient,ADC)图,手动绘制3个感兴趣区,面积约为10~ 40 mm2,不含囊变、坏死及出血区。三个ADC值的平均值作为平均ADC值,最低值作为肿瘤的最小ADC (ADCmin)值。
本组15例位于幕下,1例位于右侧枕顶叶,1例多发,6例位于蚓部-四脑室。7例位于小脑半球,与小脑表或小脑幕宽基底相连;位于桥小脑角(cerebellopontine angle,CPA)区1例,累及同侧内耳道。16例均有囊变,可伴有不同程度的脑积水,无脑脊液转移。
本组病例中,肿瘤实性成分T2WI表现等信号2例,稍高信号12例(图1A);T1WI表现等信号1例,稍低信号13例(图1B);FLAIR序列等信号4例,稍高信号4例(图1C)。8例伴有小血管穿行征(图2)。肿瘤周边或中心均有大小不等囊变区,形态多样;无明显钙化。8例轻度水肿,2例中度水肿,5例无水肿。5例中度强化,4例明显强化,5例斑片状或片絮样轻度强化,1例呈葡萄串样;囊变或坏死区未见强化。位于小脑半球7例与脑膜或小脑幕宽基底相连或贴边走形,未见脑膜尾征。右枕顶叶1例伴出血(图3A、图3B),壁厚、不规则,2个月后复查明显不规则环形强化(图3C、图3D)。CPA区1例伴同侧内耳道扩大,增强后内见多发灶状轻度强化影(图4)。
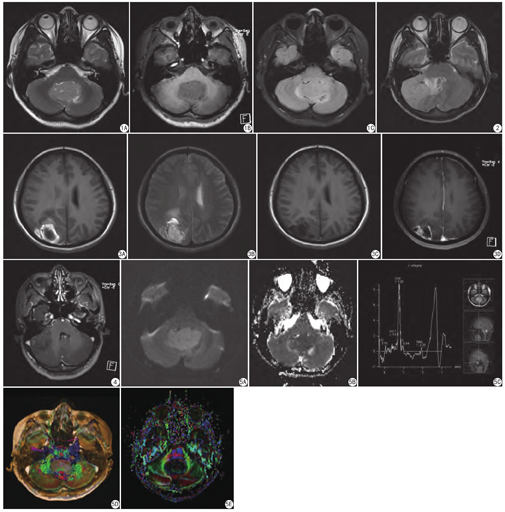

15例行DWI (b=1000 s/mm2)检查,实性部分均呈高信号(图5A),ADC图呈低信号(图5B),平均ADC值为0.578×10-3 mm2/s ;囊性部分DWI呈低信号。
7例行MRS检查,表现胆碱(Cho)峰明显升高,乙酰天冬氨酸峰(NAA)峰明显降低;5例肌酸(Cr)峰明显降低(图5C),Cho/NAA值(≥4.8)及CHO/Cr值(≥5.1)明显增高。
MB是一种高度恶性、侵袭性的原始外胚层肿瘤,属于WHO Ⅳ级;起源有争议,或起源于四脑室顶后髓帆原始神经上皮细胞残余;或起自于小脑外颗粒细胞层。儿童髓母细胞瘤好发于小脑蚓部,多见于5~ 15岁。而成人MB有50%发生于小脑半球或脑桥,20~ 40岁好发,50岁以上罕见,男与女发病率的比值约为3︰2[3,4,5]。临床表现无特异性,常有头痛、头晕、恶心呕吐或共济失调等症状。本组8例男性,8例女性,无50岁以上患者,平均年龄27.5岁,14例单发,最短病程约1周,7例有走路不稳表现。
2007年WHO分类中MB组织学类型分为经典型和促纤维增生/结节型、弥散结节型、间变型和大细胞型[6]。成人以经典型多见,显微镜大量小细胞,见菊行团结构[7]。在2016年版世界卫生组织中枢神经系统肿瘤分类中,MB增加了四种分子亚型:Wingless型、Sonic Hedgehog (SHH)型、组3、组4。成人以SHH多见,5年生存率在60%~80%之间[8]。
典型的儿童MB常见于小脑蚓部,可压迫四脑室并突入脑室继发脑积水,易沿脑脊液转移至脊髓、马尾部位;T2WI呈等或稍高信号,T1WI呈等或稍低信号,DWI扩散受限,ADC呈低信号。成人MB表现不典型,中心或边缘可见囊变或坏死区,可能与血供不足和自身分泌功能相关[9]。本组肿瘤实性部分T1WI和T2WI平扫表现同儿童MB,DWI均呈高信号,8例FLAIR检查呈稍高或等信号;均有大小不等、位置不定的囊变,呈类圆形、斑片状、棒状、弧带状等。16例中有7例局限于小脑半球,1例多发。髓母细胞瘤位于CPA区者罕见,本组中只有1例,其发生有两种说法,或从小脑表/脑桥外生性生长所致,或从四脑室经外侧孔生长至桥小脑角[10]。右侧枕顶叶MB 1例伴出血,囊壁厚薄不均,未见明显壁结节。增强扫描后,典型儿童髓母细胞瘤多呈均匀显著强化,而成人MB强化方式多样,可表现无强化、片絮状轻度强化或明显强化。有研究报道MB的强化方式可能与肿瘤的血供及组织学分型相关[11]。经典型多有强化,常表现轻度线状强化,而多发灶状、葡萄样强化仅见于弥漫结节型。肿瘤可侵犯脑膜或小脑幕延伸至幕上,可表现脑膜尾征。本组15例位于幕下,除4例呈斑片状或片絮样轻度强化外,余均有中度或明显强化,1例呈葡萄样改变,1例多发灶状强化。7例局限于小脑半球,与脑膜或小脑幕宽基底相连,均未见脑膜尾征,其中4例与脑膜或小脑幕贴边走形。发生于CPA 1例呈轻度强化,累及同侧内耳道。右侧额顶叶1例表现明显环形强化。同时,8例瘤内见强化的小血管穿行。
DWI是一种能够反映人体组织内水分子扩散速率的无创性检查方法,与细胞密集性成反比。MB瘤细胞质较少,细胞密集,DWI呈高信号,ADC值较低。有学者通过META分析发现,与毛细胞星形细胞相比,MB的平均ADC较低,通常小于0.95×10-3 mm2/s[12]。Pierce等[13]也报道,当阈值为0.675×10-3 mm2/s时,鉴别髓母细胞瘤与室管膜瘤是准确率为97.6%;ADCmin阈值为0.66×10-3 mm2/s时,诊断髓母细胞瘤的准确率达93.2%。本组16例DWI均呈高信号,平均ADC值为0.589×10-3 mm2/s,ADCmin为0.413×10-3 mm2/s,结果与文献相符。
1H-MRS可以提供肿瘤代谢有关的信息。MB常表现Cho峰明显升高,高于毛细胞星形细胞瘤和室管膜瘤;相反,NAA峰降低,低于毛细胞星形细胞瘤和室管膜瘤[14]。但Schneider等[15]认为单独使用1H-MRS对于区分小儿后颅窝MB、低级别胶质瘤及室管膜瘤无特异性。尽管MRS是否能单独对髓母细胞瘤做出诊断存在争议,但其有助于与脑外肿瘤鉴别及恶性程度判断。有关研究认为胶质瘤Cho/Cr、Cho/NAA≥4提示恶性[16]。本组7例行MRS检查,均表现为Cho峰明显升高,NAA峰明显降低。其中5例Cr峰明显降低,Cho/NAA值(≥4.8)及CHO/Cr值(≥5.1)明显增高,提示肿瘤恶性度高,有较高的侵袭性,与文献相符。
DTI是一种无创的反映活体脑白质纤维束走形、病理状态及解剖的先进技术,可以判断纤维束被侵润、破坏的程度,对临床诊疗有重要指导意义。各向异性分数(fractional anisotropy,FA)是常用的参数之一。依据脑白质纤维束变化类型及FA彩图相应颜色变化,判断肿瘤的良恶性。肿瘤恶性度越高,纤维束破坏越严重[17,18,19]。该组中3例行DTI检查,可见肿瘤边缘脑白质纤维束移位,部分破坏,FA彩图相应颜色消失。
本组病例中,3例误诊为脑膜瘤,误诊的主要原因是病灶宽基底贴于小脑表面或小脑幕,增强后明显强化,忽视了肿瘤贴边走形的特点。脑膜瘤起源于脑膜的蛛网膜粒细胞,紧连脑膜,增强后明显强化,多有典型的脑膜尾征,DWI扩散受限不明显,MRS示CHo升高,NAA峰缺失。
1例误诊为多形性黄色星形细胞瘤,其多表现为大脑表浅部位的单囊或多分隔样病灶,伴有壁结节,增强后壁结节及实质部分明显强化,而囊壁及分隔无强化。本例误诊原因主要是忽略了"壁结节"的重要性,MB无明显强化的"壁结节",囊壁与分隔有强化。
1例误诊为CPA区神经鞘瘤,误诊原因主要是本例与内耳道关系密切及该区MB罕见,忽视了常见肿瘤的典型征像,临床影像诊断思维较局限。听神经鞘瘤常表现听神经增粗及内耳道扩大,增强后明显强化,伴有多发囊变区,小脑半球可呈外压表现。而MB属于脑内肿瘤,从小脑半球向外生长至CPA区。
1例误诊为额顶叶脑出血。青年人脑出血多伴有血管畸形或肿瘤,而本例未见明确的血管畸形及占位表现;再者,国内外有关幕上原发性MB的报道鲜有,缺乏对其影像特征的认识,所以造成误诊。回顾分析发现,本例囊壁厚薄不均匀,未见明显壁结节,但DWI表现高信号。笔者认为,较厚的囊壁即为肿瘤的实性成分,推测原发于幕上者可能易伴发出血,这还需大量病例去证实。
该肿瘤还应和室管膜瘤、淋巴瘤鉴别。室管膜瘤位于第四脑室,形态不规则,呈"铸型"生长,信号混杂,常伴有坏死、出血及大囊变,DWI信号相对较低,可沿侧孔或正中孔生长。淋巴瘤位于小脑少见,一般位置较深,有握拳征、缺口征表现,MRS可见乳酸峰和脂质峰。
总之,成人髓母细胞瘤较少见,发生于CPA区罕见,位于幕上者更少见,常规MRI、DWI表现及平均ADC值有一定特征性,联合1H-MRS及DTI对其术前准确诊断有重要价值。
无。



























