
心脏磁共振特征追踪技术(cardiac magnetic resonance-feature tracking,CMR-FT)是一种基于磁共振常规电影序列的新兴心肌应变技术,其操作简单,图像空间分辨率高,且无需增做特殊序列,因此在心脏各房室心肌应变测量中广泛应用,并对心血管疾病的诊断与预后评估有一定的指导作用。本综述对CMR-FT新技术的应用及其研究进展进行归纳总结。

本刊刊出的所有论文不代表本刊编委会的观点,除非特别声明
近年来,关于心脏心肌应变成像技术的研究犹如雨后春笋,从最初应用超声斑点追踪技术,到磁共振Tagging技术的出现(目前认为是磁共振心肌应变测量的金标准),再发展到如今的磁共振特征追踪技术(cardiac magnetic resonance-feature tracking,CMR-FT)。有关心脏应变的研究与应用日趋完备,并有望走向临床,协助各类心血管疾病的早期诊断与治疗。而在诸多应变成像技术中,CMR-FT技术由于其成像便捷,后处理基于常规的电影图像,独立于不同场强磁共振成像设备等独特优势受到越来越多的关注[1,2],关于其可行性、重复性、疾病诊断和评估预后等研究层出不穷,推陈出新。本综述旨在汇总最新的有关CMR-FT的研究,阐述其参数指标以及在诊断、鉴别不同心血管疾病及评估其预后中的作用,以期完整地阐述相关研究进展,抛砖引玉,指导在此基础上进一步的研究,推动CMR-FT技术从科研走向临床。
应变也称应力或应变力,指在外力作用下物体相对变形的能力,心肌应变是指在指定时间内心脏节段从原始形状(L0,通常指舒张末期)延展至最大长度(L,通常指收缩末期)的变形程度,并以百分数表示[1]。计算公式如下:应变=(L-L0)/L0。应变速率:心肌组织在单位时间内的变形速度(单位:1/s)。两者分别反映了心肌形变的程度和速度。CMR-FT技术是一项基于常规电影图像的后处理方法,通过光流法识别图像的特征并在连续图像序列上追踪这些特征[3,4],因此可以精确测量目标心肌的位移,并获得整体或节段心肌的应变及应变率,从而反映心脏目标心肌的收缩及舒张功能。
常用心肌应变技术包括超声斑点追踪技术、磁共振Tagging技术以及CMR-FT技术。应用较多的超声斑点追踪技术与CMR-FT技术原理类似,但受到超声成像的空间分辨率低、声窗不佳、操作者技术等限制,且需实时处理,因此其心肌应变测量准确性与便捷性仍有待提升[5]。磁共振Tagging技术作为磁共振心肌应变成像的金标准,组内和组间可重复性较好,但图像获得复杂,后处理繁琐,费时费力。新出现的CMR-FT技术无需增做额外序列,依靠空间分辨率高的电影成像,后处理程序便捷,能够评估心肌整体和节段应变[6,7]。且多项研究表明CMR-FT测量应变参数与超声斑点追踪技术和磁共振Tagging技术有很好的一致性,有望替代这两种技术成为新的测量心肌应变的可靠技术[5,6,8]。
CMR-FT技术测量左右心室的心肌应变,分为纵向应变(长轴方向心肌纤维从基底段到心尖段的缩短,以负值表示)、径向应变(心肌纤维向心腔中心的形变,反映心脏周期中心肌纤维的厚度变化,以正值表示)以及周向应变(同一短轴层面心肌纤维沿着圆周向内缩短的变化,以负值表示)。纵向应变在长轴位(两腔心,四腔心)获得,径向应变在长轴位和短轴位均可获得,周向应变在短轴位获得[9]。CMR-FT可以检测心肌整体应变变化,也可以根据划分的17节段测量感兴趣节段心肌应变,故而反映心脏局部功能改变。而心肌应变对应的应率包括收缩期峰值应率、舒张早期峰值应率和舒张晚期峰值应率,分别反映心脏的整体或局部收缩和舒张功能[10],突破传统磁共振检查识别心脏舒张功能的限制。
目前有关心室各应变参数的精确性、敏感性和可重复性尚处于研究中。不同研究得出左右心室正常应变值列举在表1中。多项研究表明心肌应变与性别相关,正常女性高于男性,低龄人群高于高龄人群[11,12];在可重复性方面,整体应变>节段应变,周向应变>纵向应变>径向应变,这可能与二尖瓣结构复杂性有关[12,13]。此外,由于不同研究采用的CMR-FT后处理软件的不一致,诸如TomTec、circle等,导致心内膜、心外膜轮廓识别的不一致,这也就可以解释不同研究应变值的变异。Schuster等比较了不同后处理软件得出的心室应变值,结果表明,TomTec得出的周向应变最低,但可重复性最高,而Circle的纵向应变变异性最低[14,15,16],未来对不同后处理软件标准的划定对于准确认识心脏功能有重要意义。总的来说,研究表明左室周向和纵向应变分别大于-17%和-20%可被认定为异常[5]。右室的周向与径向应变普遍低于左室应变[17],可能跟右室的几何特征有关,右室室壁更薄,且游离壁弧线对应的半径更大。除了应变及应变率等指标外,CMR-FT技术还可用于一些常规参数的测量,如左室容积、左室运动速率及位移,评估心脏的形态学和功能改变。
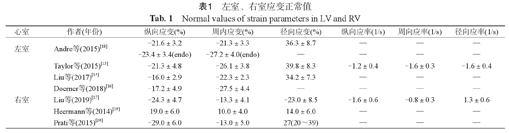
左室、右室应变正常值
Normal values of strain parameters in LV and RV
左室、右室应变正常值
Normal values of strain parameters in LV and RV
| 心室 | 作者(年份) | 纵向应变(%) | 周内应变(%) | 径向应变(%) | 纵向应率(1/s) | 周向应率(1/s) | 径向应率(1/s) |
|---|---|---|---|---|---|---|---|
| 左室 | Andre等(2015)[18] | -21.6±3.2 | -21.3±3.3 | 36.3±8.7 | — | — | — |
| -23.4±3.4(endo) | -27.2±4.0(endo) | — | — | — | — | ||
| Taylor等(2015)[13] | -21.3±4.8 | -26.1±3.8 | 39.8±8.3 | -1.2±0.4 | -1.6±0.3 | -1.6±0.4 | |
| Liu等(2017)[15] | -16.0±2.9 | -22.3±2.3 | 34.2±7.3 | — | — | — | |
| Doerner等(2018)[16] | -17.2±4.9 | -27.5±4.4 | — | — | — | — | |
| 右室 | Liu等(2019)[17] | -24.3±4.7 | -13.3±4.1 | -23.0±8.5 | -1.6±0.6 | -0.8±0.3 | 1.3±0.6 |
| Heermann等(2014)[19] | 19.0±6.0 | 10.0±4.0 | 14.0±6.0 | — | — | — | |
| Prati等(2015)[20] | -29.0±6.0 | -13.0±5.0 | 27(20~39) | — | — | — |
心室应变衍生参数:心室壁启动收缩应变时间差(启动延迟),心室壁达峰值应变时间差(应变延迟),心室壁达峰值应变时间标准差,室间隔收缩期反弹拉伸(室间隔启动收缩后收缩拉伸的最大值),收缩拉伸指数(室间隔收缩拉伸最大值+侧壁收缩拉伸最大值)等参数[6],对于客观、定量评估心肌节段运动不同步性及早期认识心脏功能异常具有重要意义。但目前此类衍生参数研究尚处于开拓阶段,对于不同后处理软件的正常值划定仍需开展大样本、多中心实验。
旋转参数:左室旋转收缩对左室收缩功能的维持起着重要作用,如心尖部旋转与左室收缩功能相关。目前关于旋转参数的CMR-FT研究较少,旋转参数常用Φ表示,旋转参数包括扭转力、标化扭转力和周向纵向剪切角[21],及相应的收缩期峰值扭转应率和舒张期峰值应率。Kowallick等[21]研究了16名正常人的旋转参数,结果指出CMR-FT技术测量的峰值扭转力和收缩期峰值扭转速率具有较好的可重复性,有望在未来的纵向研究中从心肌扭转运动角度评估心脏的收缩功能,进而认识全方位认识心脏功能改变。与反映心脏运动同步性参数类似,对于旋转参数的研究目前较少,仍需开展进一步大规模的研究。
目前,CMR-FT主要用来评估心室的应变改变,然而关于左房应变的重要性也逐渐受到重视,对于其研究也逐渐增多。左房应变主要包括:左房储备功能:总应变和峰值应率;左房传导功能:被动应变和被动收缩峰值应率;左房升压泵功能:主动应变和主动收缩峰值应率(表2)。Truong等[22]研究利用CMR-FT技术测量了112名健康志愿者的左房应变和左房容积参数,结果表明左房应变具有良好的组内组间一致性,且能更高效分析左房功能。通过对左房功能的追踪,除了可以定量评估左房功能变化,还可以间接评估左室的舒张功能,左房传导功能和左房升压泵功能分别对应左室舒张早期和舒张晚期的舒张功能,打破了磁共振评估心脏舒张功能的限制,为临床诊断与干预提供了早期证据。目前左房应变的应用正在广泛开展,不同人群、不同后处理软件的正常值、心血管疾病的左房功能改变正在研究,可重复性均较好,相信不久的将来能够指导临床应用。
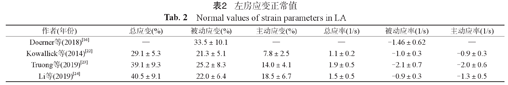
左房应变正常值
Normal values of strain parameters in LA
左房应变正常值
Normal values of strain parameters in LA
| 作者(年份) | 总应变(%) | 被动应变(%) | 主动应变(%) | 总应率(1/s) | 被动应率(1/s) | 主动应率(1/s) |
|---|---|---|---|---|---|---|
| Doerner等(2018)[16] | — | 33.5±10.1 | — | — | -1.46±0.62 | — |
| Kowallick等(2014)[22] | 29.1±5.3 | 21.3±5.1 | 7.8±2.5 | 1.1±0.2 | -1.0±0.3 | -0.9±0.3 |
| Truong等(2019)[23] | 39.1±9.3 | 25.2±8.3 | 14.0±4.1 | 1.9±0.5 | -2.1±0.7 | -2.0±0.6 |
| Li等(2019)[24] | 40.5±9.1 | 22.0±6.4 | 18.5±6.7 | 1.5±0.5 | -0.9±0.3 | -1.3±0.5 |
CMR-FT技术通过测量心肌应变及其衍生参数、旋转及其衍生参数,实现对心肌运动功能和同步性的评估,从而有助于在不同个体间、不同心肌节段间实现对各种亚临床病变、缺血性心脏病、非缺血性心脏病、早期心力衰竭及先天性心脏病术后等进行早期诊断、鉴别并评估其预后(表3)。

CMR-FT技术的临床应用
Clinical application of CMR-FT technique
CMR-FT技术的临床应用
Clinical application of CMR-FT technique
| 疾病类型 | 适应证及优势 | 劣势 | |
|---|---|---|---|
| 亚临床疾病 | 早期评估心脏功能异常;定量评估,线下后处理;不受操作人员技术限制 | 磁共振检查费用高;患者对疾病意识不高 | |
| 缺血性心脏病 | 定量评估心肌节段运动异常;评估心脏运动不同步性;预测预后情况,指导早期干预;识别冠脉狭窄区域 | 节段应变研究较少,尚缺乏标准参考;磁共振检查费用高 | |
| 非缺血性心脏病 | |||
| 肥厚型心肌病 | 早期识别收缩,舒张功能障碍;预测不良终点事件;测量心房功能改变 | 径向应力可重复性不高;心房应变研究较少 | |
| 扩张型心肌病 | 评估预后;定量分析收缩,舒张功能受损程度 | 仍需进一步开展研究 | |
| 限制型心肌病 | 定量分析收缩,舒张功能受损程度;早期诊断;评估微循环异常 | 仍需进一步开展研究 | |
| 心肌炎 | 早期诊断;定量分析收缩,舒张功能受损程度 | 预后研究较少,仍需开展 | |
| 射血分数保留心力衰竭 | 定量分析收缩,舒张功能受损程度;早期诊断;预测预后 | 仍需进一步开展研究 | |
| 先天性心脏病术后 | |||
| 法洛四联症术后 | 定量评估心脏功能改变;评估手术疗效和必要性;定量评估心脏形态学改变 | 仍需进一步开展研究 | |
| Fonton术后 | 评估运动不同步性;预测预后 | 仍需进一步开展研究 | |
CMR-FT在识别亚临床疾病所引起的心脏功能改变中发挥的作用主要体现在一个"早"上。在高血压、糖尿病、高脂血症等疾病早期,传统影像学难以识别心脏功能改变,但心肌应变已经出现异常,表现在心肌纵向应变往往首先受损,由于心外膜纤维功能尚保存,因此周向应变在这些疾病早期并没有受损,甚至会出现增长来代偿纵向收缩功能的异常,以维持左室射血分数[5]。Mordi等[25]研究通过CMR-FT技术测量了62例射血分数保留型心衰患者(heart failure with preserved ejection fraction,HFpEF),22例高血压患者和28名正常志愿者的左室应变改变,发现左室周向应变值在高血压患者与正常人之间并没有出现显著差异,而在与相匹配的HFpEF患者比较中发现,周向应变值出现了明显的受损[(-15.10±2.62)% vs (-18.50±1.21)%],这也进一步证实了高血压发展过程中,周向应变的由保留到逐渐受损的变化过程。Hu等[26]研究了104例2型糖尿病患者,包括14例右室射血分数保留和90例射血分数非保留型患者,以及26名正常人,发现糖尿病患者右室功能(三向应变)明显受损,且相对于射血分数保留型患者,非射血分数保留型患者的右室功能也出现了损伤异常,表明右室应变指标是比右室射血分数更加灵敏的指标区识别右室功能异常。综上,CMR-FT技术能够早于射血分数降低之前识别心脏功能改变,对于此类疾病的早期干预具有重要意义。
缺血性心脏病的主要代表性疾病是冠心病。冠心病早期静息状态下,心肌周向应变在冠状动脉狭窄段、狭窄远段以及正常段无显著差异,而在中-高剂量多巴酚丁胺负荷灌注磁共振扫描检查下,CMR-FT可以检出冠脉狭窄段、狭窄远段及正常段心肌周向应变的显著区别,并能协助区分不同节段心肌异常运动,能够早期识别冠脉病变引起的心肌异常[27]。在急性心肌梗死患者中,CMR-FT技术在测量整体和节段心肌的周向和纵向应变具有较好的一致性,所测量的心室应变与心肌整体梗死面积,节段梗死范围和节段心肌水肿具有显著相关性。此外,心肌应变能够准确预测心肌透壁性梗死范围[28]。在冠心病心脏节段性功能异常的诊断上,CMR-FT技术测量的节段心肌应变能够做到对异常心肌的定位,从而早期识别心肌异常,及早采取干预措施,改善预后。目前节段应变的可重复性尚低于整体应变,但已有大量研究证实节段应变的可行性,未来仍需更多大样本研究来确定节段应力的正常标准,已实现科研到临床的转化。
肥厚型心肌病:肥厚型心肌病室壁压力增加以及心内膜缺血,伴随心肌纤维化改变引起心内膜运动异常,从而导致纵向应变受损。因此纵向应变能够有效地区分病理性和生理性心肌肥厚,后者的纵向应变常处于正常范围。应用CMR-FT技术,Hinojar等[29]发现肥厚型心肌病患者左室纵向[(-13± 4.2)% vs (-19±2.8)%,P<0.001]、周向[(-15±4.1)% vs(-19±2.8)%,P<0.001]及径向应变[(29±9)% vs (36±9)%,P<0.001]相较于正常人均出现不同程度的受损,且心肌应变能够独立预测肥厚型心肌病患者不良预后,所有发生终点事件的患者心肌应变均显著受损。尽管射血分数保留,但应用CMR-FT技术研究心室应变,发现此类患者心脏收缩功能已经发生改变,并且影响患者预后,因此心肌应变技术有望为早期肥厚型心肌病患者提供早期干预的证据,协助改善预后。
扩张型心肌病:CMR-FT相关研究表明受损的纵向应变能够评估扩心病患者预后并指导针对其靶向治疗[30]。Romano等[30]通过研究来自4个不同医学中心的1012例缺血性和非缺血性扩张型心肌病患者,应用CMR-FT评估其纵向应变,并随访中位时间4.4年,结果有133例患者死亡,纵向应变每损伤1%单位,患者死亡风险增加约89.1%(调整临床和影像危险因素,射血分数和延迟强化程度之后)。多因素分析表明,纵向应变能够独立预测缺血性(风险比值比:1.942%,P<0.001)和非缺血性扩张型心肌病患者的死亡事件(风险比值比:2.101%,P<0.001)。扩张型心肌病患者心肌的舒张功能、收缩功能均受损,但CMR-FT技术能定量协助早期诊断与预后评估扩张型心肌病,为延缓疾病进展发挥作用。
限制型心肌病:限制型心肌病常起于淀粉样变、Fabry病等,左室纵向应变总是受损的,周向、径向应变可处于代偿正常范围内[31]。限制型心肌病最常见的病因是淀粉样变。Li等[32]研究了42例轻链淀粉样变患者和35名正常人,发现淀粉样变患者心肌应变均出现显著受损。26例射血分数保留的淀粉样变患者心尖段心肌纵向应变未出现明显受损而基底段和中段心肌纵向应变受损。异常的心肌应变与左室心肌微循环障碍相关,相较于射血分数保留的患者,左室射血分数降低的患者首过灌注基底段、中段和心尖段的斜率更低(2.52±0.83 vs 3.59±1.44,3.01±1.00 vs 4.09±1.58,和3.68±1.06 vs 4.92±1.48,P<0.05)。由此可知,心肌应变在识别限制型心肌病左室节段心肌功能异常方面具有显著的优势,及早发现心肌微循环障碍。
心肌炎:Baessler等[33]研究了31例急性心肌炎患者和20名正常志愿者,测量其纵向及周向应变,结果提示均明显受损,且左室周向应变及右室基底段周向应变能独立诊断射血分数保留的心肌炎患者。左室周向应变>-29%和右室基底段周向应率>-0.53/s可以划分射血分数保留型心肌炎和健康志愿者(灵敏性89%,特异性80%)。对于磁共振表现不明显的急性心肌炎患者,右室基底段周向应率界值(-0.77/s)同样能鉴别心肌炎患者。Doerner等[16]纳入86例急性心肌炎患者和30名志愿者,结果表明左房被动应变降低,左室纵向,周向和径向应变均不同程度显著受损,且左房被动应率和右室基底段周向应变能独立诊断射血分数保留型心肌炎患者。相关研究同样表明心肌炎患者左室应变以及左房应变均出现不同程度受损[34,35],心肌应变指标是早期诊断急性心肌炎且识别节段心肌运动异常的客观有效的指标,并有望评估其预后。
射血分数保留型心力衰竭是心力衰竭的一种特殊亚型,占心衰患者总数的40%~50%[36]。CMR-FT技术在心力衰竭诊断及预后中的作用通常表现在对HFpEF的诊断、鉴别及预后评估上。近期相关研究发现HFpEF患者尽管射血分数未见降低,心脏收缩功能也出现不同程度损伤[37]。高血压等潜在病因的不断进展会导致左室各向应变受损进而发展成为射血分数降低型心力衰竭。Kraigher等[38]研究了219例HFpEF患者,44例年龄、性别匹配的舒张功能障碍高血压患者和50名正常对照组,结果发现HFpEF患者纵向、周向应变相较于高血压组和正常人组均明显受损,提示心肌应变可以协助HFpEF患者的鉴别与诊断,从而有利于早期干预。目前MRI对于心脏舒张功能的评价研究较少,现有的评价类似于超声斑点追踪技术的评价指标包括左室心肌舒张早期应率和心室心肌从收缩末期到舒张末期的舒张时间[39]。此外,左室舒张功能也可以通过左房的被动收缩功能得以体现。射血分数保留型心力衰竭诊断复杂,常规影像学难以识别形态功能改变,CMT-FT技术有望追踪此类患者心脏舒张和收缩功能异常,并指导改善预后。
Kutty等[40]使用CMR-FT技术测量了171例法洛四联征修复术后患者右房纵向应变和右室纵向应变,试图追踪法洛四联征修复术后患者的心脏运动功能恢复情况,结果发现右房及右室纵向应变确实出现受损,且受损的纵向应变提示右房的储备功能损伤。Orwat等[41]研究了372例法洛四联征修复术后患者,并测量其左右室纵向、周向及径向应变,随访中位时间为7.4年,结果表明左室周向应变和右室纵向应变能够预测患者预后并独立于左右室射血分数或容积、心功能分级及最大氧耗等因素,并且能够识别死亡高风险人群。但Hagdorn等从左室应率角度提示左室收缩期周向应率能独立预测主要终点事件(持续性室速或需介入治疗的非持续性室速),但并不能提示心室功能异常。其他研究发现法洛四联症修复术后患者,残余右心室流出道梗阻可以维持右心室应变进而导致更加紧密的右室-左室相互作用和更少的心室间运动不同步,并且有可能因此而对于右心室重构具有早期保护作用,且心室内和心室间运动的不同步性可以通过标准电影CMR进行定量研究[42,43]。
Fontan术后患者心脏功能的恢复对于评估手术疗效和预后具有重要意义。Ishizaki等[44]致力于探索CMR-FT技术测量的单心室功能能否预测此类患者的预后不良事件,研究共纳入100例Fontan术后患者,测量其心肌纵向应变和不同步指数(不同节段心肌达峰值时间标准差),终点事件为心源性死亡和非计划住院;随访中位时间为62个月,18例患者发生了终点事件。多因素分析表明,纵向应变和不同步指数能独立预测终点事件。当心肌纵向应变≥11.8%或不同步指数≥ 63.5 ms时,术后患者发生终点事件风险更低。因此,Fontan术后患者单心室纵向应变及其衍生的不同步参数可以预测预后,并进行危险分层,从而指导靶向干预。
在先天性心脏病中,CMR-FT作为一种无创影像学成像,测量的应变参数主要对患者术后心肌功能的恢复及预后起到一个衡量评估作用,评价先心病手术疗效和手术必要性,对于患者精准治疗,改善预后具有显著意义。
综上所述,CMR-FT技术因扫描简单,图像空间分辨率高,应用范围广,参数测量方式灵活,可重复性不亚于Tagging技术、超声斑点追踪技术等优点,目前已成为补充常规CMR且有望代替TAG技术和超声斑点追踪技术的定量分析手段。此项技术能够早期识别心脏室壁整体和节段性运动异常,并提供心肌的应变及相关衍生参数,评估各房室运动功能及运动同步性。但目前CMR-FT技术的后处理软件多种多样,因此测量的应变值研究间变异较大,缺乏统一的参考标准,需要开展进一步的研究以提供统一的参考标准。此外,CMR-FT技术的应用领域也需要通过研究进一步确定以发挥其优势。
无。



























