
产后抑郁症是产妇在分娩后出现的抑郁症状,其病理及生理发病机制不明,尤其是产后抑郁症的神经发病机制不明。而随着以磁共振成像为代表的神经影像技术快速发展,越来越多的研究利用磁共振技术来探讨精神障碍的神经发病机制。在这篇综述中综合了产后抑郁症的脑代谢、脑功能及结构的研究结果,为产后抑郁的早期诊断,干预其发生及发展及提高治疗效果提供思路和客观影像依据。

本刊刊出的所有论文不代表本刊编委会的观点,除非特别声明
产后抑郁症(postpartum depression,PPD)是产妇在分娩后出现的抑郁情绪,主要表现为悲伤、易怒、抑郁、烦躁、睡眠障碍及强迫行为等[1]。《精神疾病诊断与统计手册第五版》 (diagnostic and statistical manual of mental disorders,fifth edition,DSM-5)将围产期抑郁症定义为妊娠期间或分娩后四周内抑郁发作[2]。产后一年是女性精神极度脆弱及精神疾病高发的时期,在这一时期,85%的初产妇会出现产后情绪的波动,10%~20%的产妇被诊断为PPD[3]。PPD是一个重大的公共卫生问题,对母亲、她们的孩子和家庭产生重大影响,造成了严重的家庭和社会负担[4]。目前关于PPD的病理生理机制的研究主要集中在妊娠及分娩过程中产妇体内激素水平(雌激素、孕激素及催产素等)的急剧变化[5],其神经生物学机制尚不明,PPD的诊断与治疗评价主观化,缺乏可用于精神疾病预测、鉴别诊断、转归预判以及疗效监测的有效手段。导致PPD的早期诊断、治疗方案选择及随访评价困难。随着神经影像学技术的进步,人们对心理精神疾病的脑结构、功能及代谢改变有了新的认识,为疾病的诊断与疗效评估提供了科学的研究方法。笔者就PPD的神经影像学最新研究进展作此综述。
正电子发射型计算机断层显像(positron emission computed tomography ,PET)是常用的研究脑的神经影像方法。目前已有研究利用PET来探索PPD大脑代谢的改变,这些研究发现PPD患者存在单胺类递质系统的紊乱[5]。作为单胺能神经递质中重要的一员,5-羟色胺是围产期抑郁发生的重要介质,5-羟色胺1A突触后受体的减少会增加产后焦虑和抑郁情绪的出现几率,影响母亲与婴儿的互动。使用PET评估抑郁女性(产后与非产后)与健康对照组(产后与非产后)的多巴胺受体在大脑的变化,发现抑郁患者的前扣带回、内侧颞叶和外侧眶额的5-羟色胺1A突触后受体结合力均减低,并且降低幅度>20%,提示单胺类递质系统异常可能是PPD发病的重要因素[6]。另一项PET研究指出PPD患者单胺氧化酶a在全脑中的含量明显升高,其中前额叶和前扣带回的含量升高22%,产后易哭泣(未达PPD诊断标准)的母亲单胺氧化酶a的含量较对照组升高15%,提示在PPD中可能存在单胺代谢增强和促氧化状态,并且单胺氧化酶a水平相应升高,会增加产后悲伤情绪所致的产后哭泣等临床症状的发生率[7]。
PET检查具有辐射性,不适用于需要哺乳的产妇。磁共振波谱(magnetic resonance spectroscopy,MRS)的出现为无辐射研究脑内递质代谢提供了很好的条件。目前关于普通抑郁症患者的谷氨酸代谢研究很多,对PPD的研究数量很少。前额叶是抑郁症出现的关键脑区,在左侧背外侧前额叶中,PPD患者谷氨酸复合物(谷氨酸+谷氨酰胺)含量减低,提示相应脑区皮层活性减低[8];但是在内侧前额叶皮层PPD者谷氨酸含量增加[9]。抑郁患者发作期在背外侧前额叶皮层也存在谷氨酸代谢失调,与PPD患者具有相似的神经发病机制;但是在内侧前额叶皮层二者谷氨酸代谢情况相反,这种差异的存在可能与产后这一时期女性激素(即雌激素和黄体酮)和相关神经活性类固醇的波动有关。谷氨酸在前扣带回含量的降低与PPD患者的下丘脑-垂体-肾上腺轴(the hypothalamic-pituitary-adrenal axis,HPA)活动减低相关[10]。脑内N-乙酰天冬氨酸主要存在于神经元及轴索中,其脑内含量的降低可以反映神经元功能受损的程度。中重度PPD患者海马N-乙酰天冬氨酸含量显著降低,导致与海马相关的记忆和注意力受损[11]。一项研究聚焦PPD患者大脑γ-氨基丁酸代谢的情况,发现PPD患者枕叶γ-氨基丁酸含量较对照组下降[12],可能提示产后这一时期女性易受到情绪困扰,未能充分适应神经内分泌环境的变化是PPD患者发生产后抑郁的原因。
功能性磁共振成像(functional mangetic resonance,fMRI)是一种检测大脑血氧饱和依赖水平变化的成像技术,这种血氧饱和水平变化是大脑在激活或静止状态下对神经活动变化的反应。众多研究报道的PPD患者脑活动异常区域主要分布在杏仁核、海马、扣带回、眶额叶、背外侧前额叶、内侧前额叶、顶叶及内侧颞叶等(图1)。
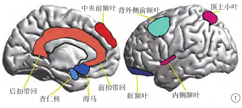

静息态fMRI是病人在静息状态下完成的fMRI扫描,现有研究主要基于脑功能连接分析(functional connectivity,FC),通过局部一致性(regional homogeneity,ReHo)、功能网络连接分析(functional network connectivity,FNC)及镜像同伦功能连接(voxel-mirrored homotopic connectivity, VMHC )等方法对PPD患者的大脑功能改变进行分析[13,14,15,16,17]。Wang等[14]发现PPD产妇的扣带回、后扣带回、额叶、顶叶及额叶内侧回等ReHo增加,颞叶ReHo降低。与正常产妇后扣带回ReHo降低不同[18],PPD患者后扣带回的ReHo增加可能会导致其对负性情景的记忆增强,进一步增加负性事件对心理的影响。颞叶是记忆、情感及其他心理活动的中枢,该区域ReHo减低与PPD患者的抑郁、焦虑及消极认知出现有关。在关于PPD患者功能网络连接分析上,研究发现PPD患者前扣带回、海马、杏仁核和背外侧前额叶以及皮质和皮质边缘区域之间的功能连接减弱,从而无法有效抑制边缘系统,导致抑郁发作,同时与负性情绪加工有关的杏仁核与顶上回及颞叶的功能连接增强,可能进一步增加了患者的负面情绪[15,16]。大脑半球间的连接反映了左右半球之间的信息交换和整合,为进一步了解大脑半球间的功能连接,Zhang等[17]通过VMHV方法对两组产妇进行分析,发现与正常产妇相比,PPD患者双侧背内侧前额叶、背侧前扣带回及眶额叶VMHC值明显下降,并与爱丁堡产后抑郁量表(Edinburgh postnatal depression scale,EPDS)评分呈负相关。这可能导致患病产妇意识减弱,以及对情绪刺激的反应减弱。
在母性行为中,健康母亲在面对自己孩子的面孔时,大脑双侧杏仁核和背侧前额叶的活动增强[19]。但有多项fMRI研究发现PPD患者杏仁核在应对消极词汇刺激[20,21]、面孔刺激[19]及婴儿微笑刺激时[22],活动不同程度减低。在接受抗抑郁药物或催产素治疗后PPD患者杏仁核对性刺激的反应增强[23]。产后,正常母亲杏仁核活动增加,提示她们对威胁内容的敏感性增加,这对保护婴儿有利。PPD患者杏仁核对威胁刺激的活动减低会导致在面对问题时做出不正确的判断,对婴儿微笑面孔刺激的反应下降不利于母婴积极情绪的传递,影响母婴关系建立。同时,正常母亲在面对刺激时大脑存在左背内侧前额叶-左杏仁核连接和双侧杏仁核-右侧岛叶功能连接,而这些功能连接在PPD患者大脑中是受损的,前者影响大脑杏仁核活动对负面情绪进行社会性移情的调节,后者与母亲出现抑郁和焦虑症状相关[19,22]。因此,PPD的发病机制可能与大脑杏仁核活动减弱,并且与杏仁核-背内外侧前额叶与杏仁核-岛叶功能连接受损相关。但在抑郁症患者的神经影像研究中,发现抑郁症患者杏仁核应对威胁刺激的活动性增加,从而对负面刺激的处理优先化[24],这与PPD患者杏仁核的反应是不一致的,这一发现为深入了解PPD的特异脑神经机制提供了可能。
在母婴关系中,母亲的照料对婴儿的成长至关重要,照料的动机与积极性与纹状体的活动密切相关[25]。PPD患者纹状体对积极性刺激(金钱奖励实验、成人微笑面孔刺激)和消极刺激(婴儿哭声)的反应均下降[26,27,28]。腹侧纹状体在应对积极刺激活跃高峰没有得到有效的维持,迅速下降,可能导致PPD患者照料动机和目标导向性行为的改变。而背侧纹状体对刺激的反应减低会干扰母亲对后代照顾的动机。相反,腹侧纹状体和背侧纹状体反应越强,母亲照料的积极性就越强。Morgan等[27]发现抑郁症状相对较轻的PPD患者的照料行为与楔前叶和枕叶的活动性相关。有研究发现PPD患者大脑眶额叶对婴儿信号的反应迟钝[21],该区域与情绪抑制调节相关[29],这一结果可能有助于进一步解释PPD患者的症状。
大量fMRI研究提示PPD的发病涉及多个脑网络异常[3],包括:(1)执行控制网络(executive control network,ECN),又称为认知控制网络,功能上由背外侧前额叶、前扣带回以及枕叶外侧皮质组成,在复杂认知功能中起到重要作用,特别是执行控制及任务完成。并且该网络参与行为和情绪的认知调控[30] ;(2)默认网络(default mode network ,DMN),功能上包括内侧前额叶,前/后扣带回,内侧颞叶,顶下小叶和海马。通常默认网络在大脑执行复杂认知功能受抑制,在独自进行思维活动时被激活[31];(3)显著网络(salience network,SN),功能上主要包括背侧前扣带回和岛叶,在识别与生物和认知最相关的事件以很好的适应环境,引导注意和行为方面起着至关重要的作用,是构成认知、稳态、动机和情感系统的关键节点;(4)情绪网络(affective network,AN),这个网络参与情绪调节和动机性刺激的显著性的监控,与自主神经系统、内脏运动系统和内分泌系统相互连接,杏仁核和膝下前扣带回是其关键脑区[16]。
后扣带回功能通常被认为与视觉空间定位、情感及非情感信息的记忆处理相关,在自我反省和社会认知方面的有重要作用,PPD患者后扣带回低频神经活动下降,可能会影响母亲在社会生活中对她和婴儿关系的认知,使得她在母亲这一身份上不能胜任[32]。在关于静息态功能连接的研究中,PPD患者后扣带回-右侧杏仁核功能连接,背内侧前额叶皮层和楔前叶、后扣带回和前扣带回功能连接较对照组明显减低,提示DMN和AN的受损,这些神经回路连接改变可能在临床上表现为患者的自我评价和情绪感知的障碍[16,33,34]。
岛叶是整合与情绪相关线索的脑区,并通过广泛的边缘连接激活情绪反应。岛叶与前扣带回的激活通常被认为与内在情绪处理有关。而前扣带回-岛叶神经环路的活动与PPD的一些症状有关,如躯体症状,以及对人际关系反馈的错误评估[35]。岛叶与前扣带回参与内在感知状态处理与多个神经网络的自适应切换,在进行复杂认知任务处理时SN抑制DMN而激活ECN网络,在静息无外来刺激时,SN激活DMN而抑制ECN活动。而SN协调DMN与ECN关系的失败,与抑郁症的发生相关[36]。PPD患者岛叶在消极词汇与婴儿信号的刺激下出现不同激活模式,在消极词汇刺激下岛叶活动性增加,这种反应放大了患者的抑郁情绪[21];面对婴儿微笑时岛叶活动性减弱,可能影响母亲对婴儿的快乐的移情反应[37]。Laurent等[37]发现PPD患者背侧前扣带回对婴儿的痛苦表情表现出迟钝的反应,可以通过与旁边缘结构的联系影响情绪反应。因此,正常母亲在面对婴儿痛苦信号时背侧前扣带回高活动性可能会帮助母亲更好地评估和控制情况,选择适当的策略来安抚婴儿。相反,背侧前扣带回活动性减低可能会导致PPD患者在面对婴儿的痛苦时感到无助,表现为退缩或过分干涉。
结构磁共振是利用磁共振对大脑的灰质白质分布的形态进行测量,此外还可以使用弥散张量成像(diffusion tensor imaging ,DTI)确定大脑白质内神经纤维束的位置、走行方向和部分各向异性指数(fractional anisotropy,FA),可以对大脑白质微结构早期完整性进行检测[38]。Silver等[39]的研究指出PPD患者左前肢内囊FA值明显降低,提示额叶皮层下神经回路紊乱和大脑半球结构连接中断。正常妊娠会导致母亲大脑的灰质白质体积发生改变。Kim等[40]利用基于体素的形态学测量发现,产妇大脑上、中、下前额叶、中央前回、中央后回、上顶叶、顶叶、岛叶及丘脑等中灰质体积均有增加。这些体积变化区域局限于与母亲行为和母婴互动有关的区域。但是到目前为止,还没有任何影像学研究对产后情绪健康的妇女与PPD患者之间的大脑灰质形态测量、体素形态测量、表面积和皮层厚度进行差异评估。
近年来以MRI为代表的神经影像技术快速发展,对精神疾病神经机制研究起到巨大的推动作用。随着新的技术不断出现,MRI已能够提供从宏观组织形态到微观亚细胞结构、从血流和能量代谢到高级脑功能网络等不同层次的生理病理信息,体现了信息多维度与多模态的特点。
PPD发病率很高,但是与之相关的神经影像学研究很少,这可能是由于受试者招募困难,产妇还有较多顾虑所致。利用PET和MRS评估产后大脑生化系统变化的PPD影像研究尚处于起步阶段。PPD患者大脑单胺氧化酶A、氨基丁酸、谷氨酸及多巴胺等的代谢变化已有报道。虽然还没有完全了解这些大脑生化变化对产后抑郁症的影响,但这些影像学研究为今后的研究奠定了基础,对PPD的治疗和预防具有重要意义。尽管PPD的静息态fMRI的研究数量有限,但是任务态fMRI关于其大脑活动及功能连接改变的报道越来越多,在任务态fMRI的研究中,大多数的研究集中在探索PPD患者婴儿脑结构及功能的改变以及PPD患者对自己婴儿面孔的反应,但对PPD患者自身认知功能、情绪调控等功能的异常研究很少。由于许多PPD患者是由产前抑郁发展而来,迄今为止还未有人对这类围产期抑郁患者进行过fMRI的追踪研究,因此无法得知单纯的PPD及围产期抑郁他们之间的共同点及差异。PPD作为产后发生的抑郁症状,也有其特殊性,到底它是一种抑郁症的亚型?该如何和普通抑郁鉴别?还需要进一步研究。
综上所述,未来的研究不仅要加强结构磁共振对PPD的研究,需要有更大的样本量、更同质的临床表型及更精细的实验设计,同时加强与其他领域研究(如:基因、孕期激素水平等)合作来共同探索产后抑郁症的神经生物学发病机制,为疾病的早期诊断和早期治疗提供依据。
无。



























