
本研究利用静息态功能磁共振成像(resting-state functional magnetic resonance image,rs-fMRI)中体素-镜像同伦功能连接(voxel-mirrored homotopic connectivity,VMHC)的分析方法,旨在探讨原发性痛经(primary dysmenorrhea,PDM)患者大脑半球间VMHC的变化模式。
以PDM患者32例及健康女性志愿者38例作为研究对象,收集两组的临床资料,包括基本人口统计学信息、疼痛及焦虑视觉模拟评分、痛经的伴随症状评分,并行rs-fMRI检查,分析两组间VMHC值的差异及组间显著差异脑区的VMHC值与临床数据的相关性。
与健康对照组相比,PDM患者VMHC值显著增加的脑区位于双侧膝下皮层/眶额区(高斯随机场理论校正,体素水平P<0.001,组水平P<0.05,双侧),未发现此脑区与临床资料存在相关性。
PDM患者双侧膝下皮层/眶额区同伦功能连接增强,有可能为原发性痛经产生及调节的中枢机制提供一种新的视角及客观的影像学依据。

本刊刊出的所有论文不代表本刊编委会的观点,除非特别声明
原发性痛经(primary dysmenorrhea,PDM)是指与月经相关的下腹部周期性痉挛性疼痛,需要排除盆腔病变所致的继发性痛经[1]。主要好发于青春期及育龄期女性。中国在校女生PDM的流行病学调查显示其发病率从41.7%~80.0%不等,其中一半以上女生遭受了中重度疼痛,严重干扰了生活和学习[2,3]。长期反复的疼痛还影响了中枢神经系统,造成了大脑结构和功能的改变[4,5,6,7],而这些变化又使PDM加重,形成恶性循环。因此,研究PDM的中枢机制十分必要,有望在以后的临床治疗中发挥指导作用。
静息态功能磁共振成像(resting-state functional magnetic resonance imaging,rs-fMRI)是脑功能临床研究中应用最广的方法,其无电离辐射,时间及空间分辨力较高,研究重复性好。rs-fMRI可反映静息状态下大脑神经元的活动情况。体素-镜像同伦功能连接(voxel-mirrored homotopic connectivity,VMHC)是2010年提出的一种评价双侧大脑半球间功能连接强度的rs-fMRI方法,起初用来研究神经退行性疾病及精神类疾病的功能同伦的病理机制[8]。VMHC主要是通过对左右大脑半球对称区域自发性活动高度同步性的描述(即功能同伦),反映大脑半球间信息沟通和协调功能。关于PDM的既往研究为特定脑区与全脑之间的功能连接,未考虑大脑半球内对称脑区的协调作用,本文推测PDM患者的VMHC存在异常。目前已有一些关于疼痛相关rs-fMRI的研究报道表明偏头痛[9]、带状疱疹后神经痛[10]、急性眼痛[11]等疾病中存在同伦连接的异常改变,而PDM患者中VMHC的改变未见阐释。本研究首次运用VMHC的方法探讨PDM患者双侧大脑半球间同伦功能连接的变化,进而研究患者半球间的功能信息交流及整合模式。
选取2016年12月至2018年1月于北京各大高校内招募的PDM患者32例,同期招募的健康女性志愿者38例为研究对象。所有受试者均为在校大学生或研究生,试验前被告知研究内容,并自愿签署知情同意。本研究已经通过北京中医药大学医学与实验动物伦理委员会的审查批准,伦理批号为2015BZHYLL0112,研究中涉及人类的医学研究符合《赫尔辛基宣言》。
PDM患者的入组标准:①符合No.345原发性痛经共识指南中的PDM诊断标准[1];②年龄16~30岁,未育女性,右利手;③月经周期规律,一般为(28±7) d;④痛经的病程至少持续6个月;⑤近1个月未服用任何治疗痛经的药物或使用其他方法;⑥最近3个月经周期的视觉模拟疼痛评分(visual analogue scale for pain,VAS-P)≥40 mm。排除标准:①经妇科B型超声检查确诊的子宫内膜异位症、盆腔炎症及子宫腺肌症等疾病所致的继发性痛经;②严重危及生命的疾病、哮喘及精神障碍等;③近6个月内使用口服避孕药、镇痛药及抗抑郁药的受试者;④具有MRI检查绝对及相对禁忌证者的受试者;⑤基线MRI检查中受试者头部解剖结构明显不对称或发现器质性病变;符合以上任意一条排除标准,均不能纳入研究。健康对照组除了没有痛经症状外,余纳入排除标准与PDM患者相同。
所有PDM患者均有下腹部疼痛,其他症状包括恶心、呕吐、头痛、背痛、腿痛、头晕及乏力等。所有PDM患者的痛经均发生在经期中,疼痛及痛经相关症状评估时间为月经期第1~3天。本研究采用国际常用的VAS-P对所有PDM患者近3个月经周期的疼痛程度进行评分。将疼痛程度用0~100 mm表示,0 mm代表感受不到疼痛,100 mm则指难以忍受的最大程度的疼痛,受试者需要根据自身感受选择一个最能代表疼痛感受的刻度[12]。另外应用焦虑视觉模拟评分法(VAS for anxiety,VAS-A)对患者产生的焦虑情绪予以评估。痛经的伴随症状运用回顾性症状量表评价,该量表分为持续时间量表(COX1)和严重程度量表(COX2)。
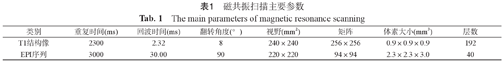
所有受试者在首都医科大学附属北京中医医院放射科完成头部MRI检查,使用机器为德国西门子skyra 3.0 T超导磁共振扫描仪(德国,埃尔朗根,西门子医疗系统)。fMRI数据的采集在受试者月经期的第1~3天完成。扫描过程中给受试者使用弹形耳塞减少噪音,双侧塞以海绵垫固定头部,线圈为头/颈20通道线圈。检查过程中要求受试者放松,闭眼,但保持清醒,不主动思考问题。首先采集T2加权成像以排除颅脑器质性病变,然后是高分辨三维T1结构像,接下来进行匀场,最后应用平面回波成像(echo-planar imaging,EPI)序列完成rs-fMRI的数据收集,具体参数见表1。
磁共振扫描主要参数
The main parameters of magnetic resonance scanning
磁共振扫描主要参数
The main parameters of magnetic resonance scanning
| 类别 | 重复时间(ms) | 回波时间(ms) | 翻转角度(°) | 视野(mm2) | 矩阵 | 体素大小(mm3) | 层数 |
|---|---|---|---|---|---|---|---|
| T1结构像 | 2300 | 2.32 | 8 | 240×240 | 256×256 | 0.9×0.9×0.9 | 192 |
| EPI序列 | 3000 | 30.00 | 90 | 220×220 | 94×94 | 2.3×2.3×3.0 | 40 |
在Matlab R2013b平台基础上,采用rs-fMRI处理辅助软件DPABI 3.0和SPM 8对所有受试者的图像数据进行预处理及计算。rs-fMRI序列的预处理包括:①将图像的原始数据转换成可供识别的NIFTI格式;②去掉第1~10时间点的数据;③完成时间层校正;④进行头动校正,删除各方向平动大于2 mm,和(或)旋转超过2°的被试者;⑤做完头动校正的功能像使用DARTEL (diffeomorphic anatomical registration using exponentiated lie algebra,DARTEL)方法[13]配准到三维T1结构像上,把配准后的结构像分割成脑灰质、脑白质及脑脊液三部分,为了结果的稳定,继续对分割后的脑脊液及脑白质信号、Friston 24头动参数进行线性回归分析去除协变量。通过DARTEL估计的参数将功能像配准到蒙特利尔神经科研研究所(montreal neurological institute,MNI)标准空间,并以3 mm各向同性体素进行重新采样;⑥采用4 mm半高宽的高斯核函数进行平滑,以降低空间噪声、减少过程中所产生的误差;⑦最后步骤为去线性漂移并应用0.01~0.1 Hz带通滤波去噪,以降低低频数据引起的漂移和高频的生理性噪声造成的影响。
预处理结束后,本研究剔除了图像质量差、头动较大的受试者共17例,包括11例PDM患者和6例健康对照组。应用DPABI 3.0软件计算VMHC值。对所有受试者脑内标准化的每个体素的时间序列进行提取,计算双侧对称位置体素之间的Pearson相关系数,即VMHC值[8]。最后将此相关系数运用Fisherz变化的方式转换为z值,所得结果被进一步进行组间分析。
使用SPSS 22.0软件分析人口统计学数据和临床资料,包括年龄、月经周期、行经天数、首次痛经发病年龄、病程、VAS-A、VAS-P、COX1和COX2。行经天数用最大值和最小值来描述,余均以均值±标准差表示(符合正态分布);两组受试者的年龄、月经周期及行经天数采用两独立样本t检验,P<0.05表示差异具有统计学意义。
应用DPABI 3.0工具包及SPSS 22.0统计软件分析PDM组和健康对照组之间VMHC值的差异,检验方法为两独立样本t检验,其中年龄作为协变量,多重比较校正采用高斯随机场理论(Gaussian random field,GRF)(体素水平P<0.001,组水平P<0.05,双侧)。提取两组t检验具有显著差异脑区的VMHC值,然后与PDM患者的临床资料进行Pearson相关性分析(P<0.05)。
最终入组受试者70例,包括PDM患者32例和健康对照组38例。两组患者的年龄、月经周期及行经天数差异无统计学意义(P>0.05),见表2。

受试者的人口统计学及临床特征
The demographic and clinical characteristics of subjects
受试者的人口统计学及临床特征
The demographic and clinical characteristics of subjects
| 组别 | 年龄(岁) | 月经周期(d) | 行经天数(d) | 首次痛经发病年龄(岁) | 病程(年) | 焦虑视觉模拟评分法 | 疼痛视觉模拟评分法 | 痛经的伴随症状持续时间量表 | 痛经的伴随症状严重程度量表 |
|---|---|---|---|---|---|---|---|---|---|
| 原发性痛经患者(n=32) | 24.5±2.3 | 30.6±4.1 | 4~9 | 16.2±2.6 | 8.3±3.1 | 58.6±18.8 | 66.1±15.8 | 19.5±9.5 | 18.3±9.2 |
| 健康对照组(n=38) | 24.4±2.0 | 30.4±4.6 | 3~8 | — | — | — | — | — | — |
| P值 | 0.799 | 0.827 | 0.551 | — | — | — | — | — | — |
注:数据以均数±标准差表示;行经天数用最大值和最小值来描述。
PDM患者较健康对照组VMHC值显著增加的脑区位于双侧膝下皮层和眶额区(峰值=5.5541,体素大小=42),见图1,而未发现VMHC值显著降低的脑区。
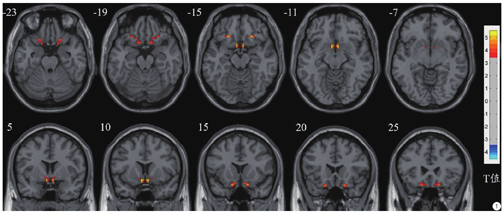

PDM患者与健康对照组显著差异脑区的VMHC值与PDM患者临床参数未见明显相关性,临床资料包括痛经发病年龄、病程、VAS-P、VAS-A、COX1及COX2。
本研究基于rs-fMRI技术,首次应用VMHC的分析方法,证实了PDM患者的双侧大脑半球间同伦功能连接出现异常。与健康对照组相比,PDM患者在双侧膝下皮层/眶额区的VMHC值显著增加。
膝下皮层位于颅底、眼球正后方,属于Brodmann大脑皮层分区的25脑区,被认为是腹内侧前额叶(ventromedial prefrontal cortex,vmPFC)的一部分。vmPFC主要与奖赏价值决策、负面情绪管理及社会认知等多方面相关[14]。针对vmPFC损伤患者的研究,国外学者Damasio提出了"躯体标记假说",认为情绪、情感的变化可以产生躯体状态的改变,进而通过躯体感觉皮层激活模式产生中枢表象,指导决策的实施,vmPFC损伤的患者不能被引导向着有利于个体的方向发展[15]。先前的脑功能和结构研究表明了膝下前扣带回与内侧前额叶皮层参与了多种慢性疼痛的疾病[16,17]。有学者分析了48例PDM患者和38例健康对照组的前扣带回亚区功能连接变化,结果表明PDM患者膝下前扣带回与内侧前额叶皮层的功能连接增强,提示PDM可能通过情感过程抑制疼痛调节[18]。本研究与上述研究相似,发现了PDM患者双侧膝下皮层同伦功能连接的增强,提示PDM患者可能需要同步增强双侧膝下皮层间的协调性以抑制痛经的调节,这个疼痛处理调节过程可能有情绪、情感的参与介入。
眶额皮层又称Brodmann 11脑区,位于前额叶皮层腹侧表面,是感觉整合、自我控制、情感表达的重要脑区[19],同时也是参与奖赏、惩罚的关键脑区[20]。动物实验研究证实眶额皮层与前额叶其他区域、边缘系统、感觉区域及运动前区存在广泛连接。与眶额皮层存在连接的感觉皮层包括嗅觉、味觉、躯体感觉、听觉及视觉处理的皮层[21]。多项关于疼痛的研究均表明眶额皮层与疼痛的加工处理有关。一项针对青少年肠易激综合征的实验证实了眶额皮层参与了疼痛的调节,其区域的皮质明显增厚,并且与腹部疼痛的严重程度具有显著相关性[22]。纤维肌痛患者的脑磁图研究也发现了眶额皮层增强的高频振荡活动与疼痛评分相关[23]。眶额皮层在适应性地应对PDM月经周期的生理变化、调节情感状态和疼痛至关重要。首先是结构改变,PDM患者的眶额皮层皮质增厚,且与痛经持续时间呈显著正相关[7]。其次是功能的异常,有学者观察患者与健康人月经期及卵泡期局部一致性(regional homogeneity,ReHo)的变化情况,结果表明在月经期,PDM患者左侧背外侧前额叶和右侧mPFC的ReHo减低,而非月经期PDM患者眶额皮层的ReHo减低,而第一、二躯体感觉皮层ReHo活动增强[5]。上述区域神经元的自发活动变化可能与痛觉过敏、异常疼痛,甚至疼痛缺失有关。本研究发现了双侧眶额区的同伦功能连接同步性增强,推测双侧眶额区相同来源的神经元过度激活可能与疼痛反复或过度的刺激有关,更加证实了眶额区参与疼痛的调节过程。
双侧膝下皮层/眶额区均属于vmPFC的一部分。额叶是大脑发育的高级中枢,与认知、执行决策功能、情绪自我加工等有关。多项疼痛相关VMHC值的研究证实了双侧额叶同伦连接功能出现异常。带状疱疹后神经痛病人相比健康人在双侧背外侧前额叶VMHC值降低,说明此区域两大脑半球间的连通性出现了损害,影响了对疼痛的评估及反应决策[10]。在对月经性偏头痛VMHC的研究中,作者发现患者双侧额中回协调性增强,认为偏头痛患者通过激活额中回来抑制自身功能失调[9]。相比正常人,急性眼痛患者双侧内侧额叶VHMC值增高,说明可能导致认知功能受损[11]。本研究中PDM患者双侧vmPFC (双侧膝下皮层/眶额区)协调性增强,其去抑制化可能参与了痛经的产生。一项PDM患者月经期脑代谢的文章认为丘脑-眶额-前额叶网络的去抑制化可能通过维持脊髓和丘脑的敏化作用,同时增加负性效应,从而参与PDM患者疼痛和痛觉过敏的产生[24]。很遗憾的是未发现PDM患者双侧膝下皮层/眶额区的VMHC值与疼痛程度及痛经相关症状具有相关性,希望在以后的研究中进一步探讨。
虽然本研究首次应用了VMHC的计算方法研究PDM患者的功能连接变化,但仍然存在一些不足。首先是VMHC值异常区域仅出现在双侧膝下皮层/眶额区,其他脑区是否存在异常需要通过扩大样本量,重复研究进一步证实;其次,本研究收集的数据来自在校学生,若将研究范围扩大到社会各种人群、不同年龄段,结果可能会不同,笔者会在后面的研究中关注此方面;最后,本研究对受试者的疼痛及焦虑评估需要根据自身感受选择程度,受主观因素影响较大,希望在以后的研究能够有客观的评估标准。
综上所述,本研究发现了PDM患者与健康人比较,存在双侧膝下皮层/眶额区功能连接协调性的增强,上述区域的去抑制化可能参与了PDM患者疼痛的产生及调节,为其中枢机制的阐明提供了一定的理解及新的角度。
无。



























