
探讨不同性别中老年人各腰椎体脂肪含量(fat fraction,FF)、R2*与骨密度(bone mineral density,BMD)的相关性。
通过MRI脂肪定量技术测量40例中老年人(男女各20例)共200个腰椎体的FF、R2*值,通过定量CT (quantitative computed tomography,QCT)测量腰椎各椎体BMD,采用SNK检验比较不同性别腰椎各椎体BMD、FF和R2*值,两独立样本t检验比较不同性别间腰椎BMD、FF和R2*值。Spearman相关分析不同性别腰椎各椎体FF、R2*值与BMD的相关性。
不同性别中老年人L1-L5各椎体间BMD、R2*比较,差异均无明显统计学意义(P>0.05),各椎体间FF比较,差异均有统计学意义(P<0.05),其中男、女性中老年人L4FF、L5FF均大于L1FF,男性L4FF大于L2FF。男、女两组腰椎体BMD、FF比较,差异无明显统计学意义(P>0.05),R2*比较差异具有统计学意义(P<0.05),且男性腰椎体R2*大于女性。不同性别中老年人腰椎BMD与FF值均呈负相关(rs男=-0.76,rs女=-0.77,P均<0.05),与R2*值均呈正相关(rs男=0.56,rs女=0.45,P均<0.05)。
中老年人腰椎体BMD与FF、R2*值有一定相关性,且中老年女性R2*小于男性,同时中老年人下腰椎FF值较上腰椎高。

本刊刊出的所有论文不代表本刊编委会的观点,除非特别声明
近些年社会老龄化逐渐加重,而年龄的增大往往引起骨密度的减低和骨髓脂肪含量(fat fraction,FF)的增加,同时绝经后女性骨密度的下降与雌激素的缺乏密切相关[1]。因此,定量评估不同性别骨密度、骨髓脂肪含量变化及其相应关系,对预防治疗骨质疏松非常重要。以往双能X线吸收测量法(dual energy X-ray absorptiometry,DXA)被认为是测量骨密度的"金标准",但由于脊柱退行性疾病、主动脉钙化、骨赘等因素会对其测量产生较大影响,可重复性相对较差。而定量CT (quantitative computed tomography,QCT)可直接测量松质骨体积骨密度(volumetric bone mineral density,vBMD),与传统DXA相比,优势明显[2,3]。MR魔镜成像(mDIXON-Quant)是一种可以进行脂肪定量测量的新兴技术,可一次屏气采集6个回波,同时结合7峰值脂肪模型和T2*校正,能提供精确的脂肪定量结果[4,5]。研究报道其测量结果与模体检验、活检结果等一致性较好,同时具有较好的重复性[6]。
本研究采用QCT和磁共振mDXION-Quant两种定量影像技术测量腰椎骨密度和骨髓脂肪含量,旨在探索中老年人男女不同性别各腰椎骨密度与骨髓脂肪含量的差别及相关性。
选取2019年9月至2020年1月于阜阳市人民医院体检中心进行体检者。纳入标准:①男、女年龄均≥50岁,女性为绝经后;②自愿接受腰椎QCT及mDXION-Quant检查,并签署检查知情同意书。排除标准:①QCT及mDXION-Quant数据部分缺失;②有腰椎骨折或腰椎术后者;③既往患有骨代谢异常疾病(如甲亢、糖尿病、库欣综合征、肾性骨营养不良等)和服用影响骨代谢药物(如降钙素、皮质类固醇等)者。最终纳入40例,其中男女各20例,年龄50~71岁,平均(60.90±6.67)岁。本研究经我院伦理委员会批准(医伦理审查[2019]58号),所有研究对象均签署知情同意书。
所有研究对象均接受东软NeuViz128排螺旋CT进行L1-L5扫描(电压:100 kV,电流25 mAs,螺距0.992,旋转时间0.5 s,层厚0.625 mm),扫描范围L1椎体上缘至L5下缘。将CT扫描图像传输至QCT分析工作站,采用美国Mindways公司QCT骨密度分析软件测量L1-L5椎体松质骨BMD (单位:mg/cm3),半自动设置感兴趣区,测量时注意避开骨岛、硬化和血管壁钙化(见图1A、图1B)。
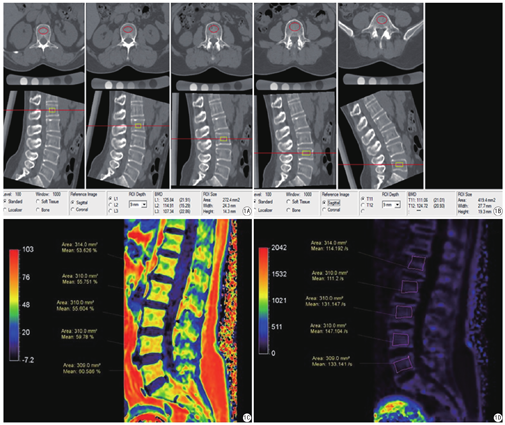

用飞利浦Ingenia CX 3.0 T MRI设备行腰椎mDIXON-Quant检查。采用8通道腹部线圈。扫描参数:TR 8.0 ms,TE 1.45 ms,FOV:156 mm×360 mm,反转角3°,三维图像分辨率:2 mm×2 mm×6 mm,敏感度编码(sensitivity encoding,SENSE)为2,信号平均次数(number of signalaveraged,NSA)为1次,扫描时间20 s。测量图像选择经过腰椎体(L1-L5)正中矢状位,手工绘制感兴趣区测量FF(单位:%)、R2* (单位:/s),感兴趣区尽量在椎体最大层面的中心部分,避开无关部分,并根据不同椎体的大小调整感兴趣区面积大小,见图1C、图1D。
采用SPSS 20.0统计软件对数据进行整理和分析,计量资料以 ±s表示。采用SNK检验比较不同性别腰椎各椎体BMD、FF和R2*值,两独立样本t检验比较不同性别间腰椎BMD、FF和R2*值。Spearman相关分析不同性别腰椎各椎体BMD与FF、R2*值的相关性。以P<0.05作为差异具有统计学意义。
±s表示。采用SNK检验比较不同性别腰椎各椎体BMD、FF和R2*值,两独立样本t检验比较不同性别间腰椎BMD、FF和R2*值。Spearman相关分析不同性别腰椎各椎体BMD与FF、R2*值的相关性。以P<0.05作为差异具有统计学意义。
男、女性中老年人L1-L5各椎体间BMD、R2*比较,差异均无明显统计学意义(P>0.05)。男、女性中老年人L1-L5各椎体间FF比较,差异均有统计学意义(P<0.05),其中男女性L4FF、L5FF均大于L1FF,男性L4FF大于L2FF,见表1、表2。
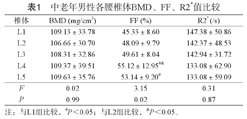
中老年男性各腰椎体BMD、FF、R2*值比较
中老年男性各腰椎体BMD、FF、R2*值比较
| 椎体 | BMD (mg/cm3) | FF (%) | R2* (/s) |
|---|---|---|---|
| L1 | 109.13±33.78 | 45.33±8.60 | 147.38±50.86 |
| L2 | 106.66±30.70 | 48.09±9.79 | 142.37±48.53 |
| L3 | 108.31±32.86 | 49.61±8.04 | 142.94±31.72 |
| L4 | 109.37±39.51 | 55.12±12.95#& | 133.08±62.90 |
| L5 | 109.63±35.76 | 53.14±9.20# | 133.08±59.09 |
| F | 0.02 | 3.15 | 0.31 |
| P | 0.99 | 0.02 | 0.87 |
注:与L1组比较,#P<0.05;与L2组比较,&P<0.05。
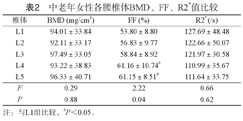
中老年女性各腰椎体BMD、FF、R2*值比较
中老年女性各腰椎体BMD、FF、R2*值比较
| 椎体 | BMD (mg/cm3) | FF (%) | R2* (/s) |
|---|---|---|---|
| L1 | 94.01±33.84 | 53.80±8.80 | 127.69±48.48 |
| L2 | 92.11±33.17 | 56.83±9.77 | 122.66±50.07 |
| L3 | 97.49±33.05 | 58.84±8.92 | 121.97±30.58 |
| L4 | 93.22±38.83 | 61.16±10.74# | 110.99±35.67 |
| L5 | 96.33±40.71 | 61.15±8.51# | 111.64±33.75 |
| F | 0.29 | 2.22 | 0.66 |
| P | 0.88 | 0.04 | 0.62 |
注:与L1组比较,#P<0.05。
男、女两组腰椎体BMD、FF比较,差异无明显统计学意义(P>0.05);R2*比较差异具有统计学意义(P<0.05),且男性腰椎体R2*大于女性。见表3。
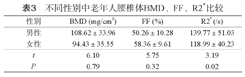
不同性别中老年人腰椎体BMD、FF、R2*比较
不同性别中老年人腰椎体BMD、FF、R2*比较
| 性别 | BMD (mg/cm3) | FF (%) | R2*(/s) |
|---|---|---|---|
| 男性 | 108.62±33.96 | 50.26±10.28 | 139.77±51.03 |
| 女性 | 94.43±35.55 | 58.36±9.61 | 118.99±40.23 |
| t | 6.10 | 5.75 | 3.19 |
| P | 0.79 | 0.32 | 0.02 |
中老年男性腰椎BMD与FF值呈负相关(rs=-0.76,P<0.001),与R2*值呈正相关(rs=0.56,P<0.001)。中老年女性腰椎BMD与FF值呈负相关(rs=-0.77,P<0.001),与R2*值呈正相关(rs=0.45,P<0.001)。
在人体骨髓中有红骨髓和黄骨髓,其中红骨髓含有大量造血组织,因此具有丰富的铁蛋白,而黄骨髓中80%的成分为脂肪组织[7]。研究报道[8]随着年龄的增长,红骨髓逐渐向黄骨髓转换,而与此同时髓内脂肪细胞可以自分泌或者旁分泌的方式释放细胞因子来进行调节骨的代谢,脂肪细胞增加伴随着成骨细胞的减少,同时会导致造血干细胞进一步转化为破骨细胞,以至于成骨细胞和破骨细胞失衡,最终导致骨质疏松的发生。因此可通过测量椎体脂肪含量及骨密度情况来评价骨质疏松情况。QCT是作为一种三维体积BMD测量技术,可以将感兴趣区放在椎体中央,避开大动脉钙化、骨质增生硬化部分,因此具有较高的敏感度和准确率,目前已逐渐成为测量BMD的主要检查手段。本研究中结果显示中老年不同性别L1-L5椎体BMD差异无明显统计学意义,与文献报道一致[9]。mDIXON Quant是目前一种新的直接测量脂肪含量的MRI技术,相对于磁共振波谱(MR spectroscopy,MRS)可以实现同时多椎体的扫描[10]。该技术是3D梯度回波DIXON序列,采集6个回波分析7个脂肪峰。正常情况下脂肪在MRS中有9个脂肪峰,而脂肪的第8峰已经很接近水峰了,因此mDIXON Quant技术中分析7个脂肪峰值保证了脂肪定量的准确性[11]。扫描结束后可以直接得到脂肪分数图和R2*图,而R2*与铁含量显著相关,可用于评估铁含量[12]。
代岳等[13]对不同年龄段人群行腰椎MR脂肪定量扫描,结果显示L1-L4椎体FF值呈现逐渐增加的趋势。Ojanen等[14]运用MRS及水脂分离技术测量家庭组员中L1-L5椎体FF值逐渐增加。张振等[15]报道成年女性L1椎体的平均脂肪含量最低,L4、L5椎体脂肪含量的平均值最高。本研究显示不同性别中老年L1-L5椎体FF值差异均具有统计学意义,进一步两两比较,L4FF、L5FF均大于L1FF,而男性组L4FF大于L2FF,呈现出下腰椎FF值大于上腰椎FF值现象,与文献报道结果类似。究其原因,可能是下腰椎承重较上腰椎大,容易加速红黄骨髓转换。也有报道指出[16],腰椎间盘突出的发生与其上下椎体脂肪的浸润存在轻度相关性,这与临床上腰椎间盘突出多发生在L4/5也有一定关系。
关于椎体脂肪含量与骨密度的关系,邓小丽等[17]报道通过常规MR信号差值可以间接判断椎体骨矿物质和骨基质含量的差别。张勇等[9]通过前瞻性研究校正年龄后腰椎骨密度与骨髓脂肪含量呈负相关。冯红梅等[18]研究表现L1-L4椎体平均BMD与FF呈负相关,与R2*呈正相关。本研究通过mDXION-Quant技术评估不同性别中老年人L1-L5各椎体骨髓脂肪的含量,同时通过QCT测量相应BMD,结果显示不同性别L1-L5各椎体BMD与FF均呈负相关,与R2*值均呈正相关,与文献报道结果一致[18,19]。但也有学者[20,21]通过研究骨折患者血清铁蛋白、血清蛋白与骨密度的相关性发现,血清铁蛋白、血清蛋白与骨密度无明显相关性。可能是因为其进行骨铁分析与BMD的ROI不完全匹配所致,同时其测量骨密度采用DXA也可能对研究结果产生一定影响。Griffith等[22]的研究显示61岁以上的女性椎体骨髓脂肪含量高于男性。而本研究中老年男女腰椎体FF值差异无统计学意义,可能是本组研究样本量较小或抽样误差所致,需进一步探索。但在R2*比较中本组结果显示女性低于男性,说明中老年女性腰椎体铁沉积低于男性,可能是绝经后女性由于雌激素水平的迅速下降导致骨密度的下降,骨小梁间隙增加,更多的脂肪细胞填充,红骨髓含量明显减少,因而铁沉积下降。
本研究由于样本量较小,未能对中老年人进一步进行年龄段划分进行研究,笔者后期将加大样本量进行深入探索。同时,本研究仅对50岁以上年龄段进行笼统归纳,未做具体年龄段分析,后期将进一步分年龄段进行评估。
综上所述,在中老年人中下腰椎FF大于上腰椎,L1-L5各椎体间BMD及R2*无明显统计学差异。但老年女性R2*值小于老年男性,可能是因为雌激素水平下降导致红骨髓含量明显减低、铁沉积下降。不同性别中老年人腰椎BMD与FF值均呈负相关,与R2*值均呈正相关。因此,综合分析腰椎FF、R2*及BMD有助于全面评估腰椎体骨强度及预防骨质疏松。
无。



























