
探讨集成磁共振(synthetic magnetic resonance imaging,SyMRI)技术在正常成年人海马定量测量中的应用价值。
连续收集20~72岁健康成年人139名,男性61名,女性78名。按照年龄分为三组:20~35岁36名,36~55岁72名,56~72岁31名。所有受试者均采用GE SIGNA Pioneer 3.0 T MRI进行头颅检查。扫描序列包括3D T1WI毁损梯度回波序列(3D T1WI spoiled gradient recalled echo,3D T1WI-SPGR)和SyMRI序列,应用SyMRI后处理软件对全脑进行自动配准及数值提取。不同侧别间的海马T1、T2及质子密度(proton density,PD)值采用配对t检验,不同性别分组间的海马T1、T2及PD值采用两独立样本Mann-Whitney U检验,不同年龄组间采用方差分析,不同年龄分组内两两比较采用LSD法。
139名健康成年人的T1、T2、PD均值分别分别是(1258.43±110.59) ms、(105.88±16.05) ms、(74.71±1.52) pu,T1值、T2值、PD值的范围依次是(1070.16~1725.59) ms、(86.43~190.71) ms、(70.72~80.21) pu。不同侧别海马T1和PD值差异均有统计学意义(P值均<0.05),且T1和PD值左侧均大于右侧。而不同侧别海马T2值以及不同性别间的T1、T2和PD值之间没有统计学差异(P>0.05)。T1、T2及PD值不同年龄组之间差别有统计学意义(P<0.05),20~35岁组和36~55岁组与56~72岁组之间差异有统计学意义(P<0.05),20~35岁组与36~55岁组之间差异无统计学意义(P>0.05)。
集成磁共振技术能够提供不同年龄及性别正常成年人海马定量参考值,为海马相关疾病的早期诊断提供重要依据。

本刊刊出的所有论文不代表本刊编委会的观点,除非特别声明
海马在人类学习、记忆和情感等方面起着重要作用,是当今生命科学和认知神经科学领域研究的热点之一。大量研究表明,海马的结构变化不仅与年龄、性别及基因相关[1, 2],还与颞叶癫痫、精神分裂症、抑郁症、阿尔茨海默病、缺氧后健忘症等有显著相关[3, 4]。众多神经退行性疾病的早期即可出现海马体积改变,但海马体积的测量相对复杂且缺乏绝对的参考标准。绝对量化组织参数如T1、T2和PD值能反映组织的病理变化,有助于微小、局灶性病变的发现及疾病发生、发展情况的监测。既往文献显示,T2 Mapping对阿尔茨海默病、癫痫及海马硬化的早期诊断和治疗反应的监测有重要作用[5, 6]。但其扫描时间较长,且可引起组织温度升高[7],故未在临床诊断中广泛应用。集成磁共振(synthetic magnetic resonance imaging,SyMRI)技术不仅能生成常规形态学诊断所需要的图像,同时也可获得T1、T2和质子密度(proton density,PD)值等定量信息[8, 9, 10, 11]。既往的SyMRI主要应用于全脑或局部脑体积的测量[12],目前关于SyMRI在海马区的定量研究鲜有报道。笔者通过对正常人海马区域进行定量测量,为正常老化及海马疾病的定量诊断提供重要参考依据。
本研究经过本单位医学伦理委员会批准[伦理号:中大五院(2020)伦字第(K219-1)号],免除受试者知情同意。回顾性收集2019年11月1日到2020年4月1日在我院行健康体检颅脑MRI检查的成年人。图像纳入标准:(1)既往无精神疾病如颞叶癫痫、精神分裂症、抑郁症、阿尔茨海默病、缺氧后健忘症;(2)既往无脑部相关病变(如脑出血、脑梗死、脑肿瘤等病史)及脑部手术病史;(3)无长期药物治疗的慢性疾病史。排除标准:图像伪影重,无法进行定量测量。按以上标准,共收集健康成年人139名,男性61名,女性78名。年龄从20~72岁,平均(44.5±11.9)岁,按照年龄分为三组,20~35岁36名,36~55岁72名,56~72岁31名[13]。
采用GE SIGNA Pioneer 3.0 T MRI扫描仪,使用29通道头颈联合线圈,扫描野包括整个大脑。对139例受试者行矢状位3D T1WI毁损梯度回波序列(3D T1WI spoiled gradient recalled echo,3D T1WI-SPGR)及轴位SyMRI序列扫描。3D T1WI-SPGR扫描参数:FOV 256 mm×256 mm,层厚1 mm,TR 7.5 ms,TE 2.2 ms,TI 450 ms,翻转角12°,接收带宽31.25 Hz/像素,矩阵256×256,体素大小1 mm×1 mm×1 mm,总扫描时间约5 min 2 s。SyMRI扫描参数:FOV 256 mm×256 mm,层数84,层厚2 mm,TR 10 000 ms,TE 10.9 ms,TE 265.2 ms,翻转角12°,接收带宽35.71 Hz/像素,平面内矩阵128×128,体素大小2 mm×2 mm×2 mm,总扫描时间约8 min 40 s。
将SyMRI的扫描数据导入SyMRI后处理软件(v11.2.2,SyntheticMR公司),自动计算得到T1、T2和PD图谱(图1)。使用dcm2nii软件将T1、T2、PD和3D T1WI-SPGR扫描数据转换成NIFTI格式。随后采用FSL软件(https://fsl.fmrib.ox.ac.uk/fsl/fslwiki/FSL)将T1、T2和PD图谱配准到标准脑空间(MNI)。最后使用AAL模版提取海马体的定量参数值。
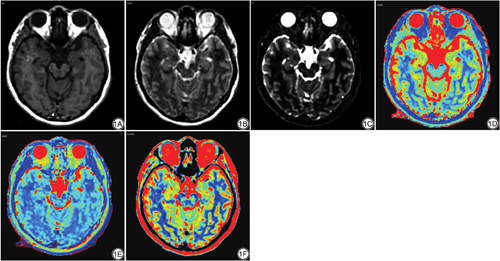

所有数据均使用SPSS 20.0软件进行分析。不同侧别的海马T1、T2及PD值采用配对t检验,不同性别的海马T1、T2及PD值采用两独立样本Mann-Whitney U检验,不同年龄组间海马结构的定量值作方差分析,不同年龄分组两两比较采用LSD法。P<0.05为差异有统计学意义。
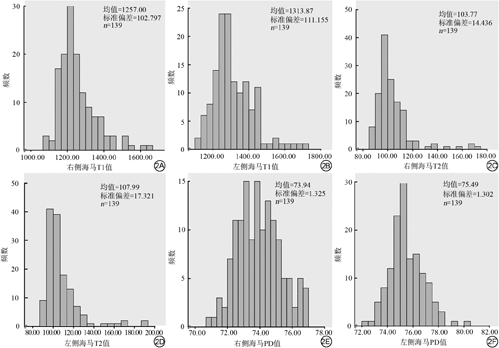
正常成年人的T1、T2、PD值的均值分别是(1258.43±110.59) ms,(105.88±16.05) ms,(74.71±1.52) pu,T1、T2及PD值的范围依次是(1070.16~1725.59) ms,(86.43~190.71) ms,(70.72~80.21) pu (图2)。

不同侧别的海马T1和PD值差异有统计学意义,且T1和PD值左侧均大于右侧,不同侧别T2值以及不同性别间的T1、T2和PD值之间无统计学差异(表1)。
不同性别、侧别海马T1、T2和PD值比较
Comparison of T1, T2 and PD values of hippocampus of different genders and sides
不同性别、侧别海马T1、T2和PD值比较
Comparison of T1, T2 and PD values of hippocampus of different genders and sides
| 性别 | 人数 | T1值(ms,±s) | T2值(ms,±s) | PD值(pu,±s) | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 右侧 | 左侧 | P值 | 右侧 | 左侧 | P值 | 右侧 | 左侧 | P值 | ||
| 男 | 61 | 1262.93±108.18 | 1323.58±118.49 | 0.003 | 103.40±14.43 | 108.49±19.32 | 0.101 | 74.03±1.36 | 75.68±1.39 | <0.001 |
| 女 | 78 | 1252.22±98.87 | 1303.80±104.32 | 0.001 | 103.88±14.50 | 107.27±15.68 | 0.162 | 73.86±1.30 | 75.34±1.22 | <0.001 |
| P值 | 0.544 | 0.298 | 0.846 | 0.681 | 0.466 | 0.127 | ||||
不同年龄组别的海马T1、T2及PD测量值差异有统计学意义(P<0.01;表2,3)。55岁之前的年龄组之间无统计学差异,而55岁之后的年龄组与前两组之间具有统计学差异。
不同年龄组别海马T1、T2及PD值(±s)
T1, T2 and PD values of hippocampus in different age groups (±s)
不同年龄组别海马T1、T2及PD值(±s)
T1, T2 and PD values of hippocampus in different age groups (±s)
| 组别 | T1值(ms) | T2值(ms) | PD值(pu) | |||
|---|---|---|---|---|---|---|
| 右侧海马 | 左侧海马 | 右侧海马 | 左侧海马 | 右侧海马 | 左侧海马 | |
| 组1 | 1240.43±64.72 | 1287.36±70.05 | 101.93±8.02 | 104.64±8.66 | 73.93±1.19 | 75.24±1.17 |
| 组2 | 1226.84±88.10 | 1283.31±93.04 | 100.68±10.90 | 104.50±11.64 | 73.55±1.21 | 75.17±1.07 |
| 组3 | 1346.29±120.85 | 1415.61±129.78 | 113.10±22.04 | 119.96±27.95 | 74.86±1.31 | 76.54±1.42 |
注:组1为20~35岁年龄组;组2为36~55岁年龄组;组3为56~72岁年龄组

不同年龄组别间海马T1、T2、PD值的比较
Comparison of T1, T2 and PD values of hippocampus among different age groups
不同年龄组别间海马T1、T2、PD值的比较
Comparison of T1, T2 and PD values of hippocampus among different age groups
| 组别 | T1值 | T2值 | PD值 | |||
|---|---|---|---|---|---|---|
| 右侧 | 左侧 | 右侧 | 左侧 | 右侧 | 左侧 | |
| PB | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 |
| P1-2 | 0.414 | 0.819 | 0.542 | 0.950 | 0.121 | 0.750 |
| P1-3 | <0.001 | <0.001 | 0.006 | 0.002 | 0.003 | <0.001 |
| P2-3 | <0.001 | <0.001 | 0.006 | <0.001 | <0.001 | <0.001 |
注:PB值即组间的P值;P1-2值即20~35岁年龄组与36~55岁年龄组之间的P值;P1-3值即20~35岁年龄组与56~72岁年龄组之间的P值;P2-3值即36~55岁年龄组与56~72岁年龄组之间的P值
海马形态的改变不仅与很多退行性疾病相关,还会随着年龄增长而变化,因此仅仅依靠海马形态学的改变对疾病进行诊断会存在一定的偏差,尤其是对于海马的微小及局灶性病变。既往的体积测量及MRS成像技术,因临床后处理操作复杂、耗时长,临床应用也因此受限。定量测量可避免肉眼及边界勾画所带来的误差,为临床海马疾病的早期、准确诊断提供了新的契机。
本研究发现SyMRI可定量测量海马区域的T1、T2及PD值。既往主要采用T2弛豫测量法进行海马的定量测量,T1值及PD值在正常海马的定量研究中运用较少。T1、T2值可以反映脑内水分、髓鞘及铁含量的变化[14, 15, 16],而PD值能测量游离水的含量,这些对疾病的病理状态的监测极其重要[17]。Jackson等[18]使用16回波的SE序列通过单指数衰减曲线计算出T2值,对海马进行定量分析。近几年来有人用双回波SE或FSE序列对T2值进行测量,认为双回波SE或FSE序列对T2值也能可靠、准确地发现海马异常。相比于既往的研究,SyMRI在获得常规序列满足形态学诊断的同时,也能提供除T2值以外的T1值及PD值等,节约了扫描时间,为海马病变的诊断提供了一体化的工具。
海马相关疾病会导致海马体积及相关定量值改变,例如海马硬化症会导致海马体积萎缩,T2信号增加[19, 20],而年龄增加也会导致海马体积缩小及相应定量值的改变[21]。本研究结果显示海马不同侧别的T2值以及不同性别间的T1、T2和PD值之间无明显统计学差异,这与部分研究发现相同[22, 23]。而不同侧别的T1及PD值之间差异具有统计学意义,且左侧定量值均高于右侧。既往研究也证实海马的左右侧体积及结构存在不对称性[1,24],且右侧体积大于左侧,故推测其定量值之间存在差异是合理的,需要大样本进一步验证。
本研究结果显示随年龄的增加海马T1、T2及PD值先有所降低后逐渐增加,不同组别的海马结构的定量值在20~72岁之间年龄段差异均有统计学意义。55岁之前的年龄组之间无统计学差异,而55岁之后的年龄组与前两组之间具有统计学差异,55岁之后的年龄组的T1值、T2值及PD值明显增高。这与Jackson等[18]报道的不同区域脑组织的变化规律相同,60岁左右是一个相对的分界线,60岁之前,T1、T2和PD值稳定或略有下降,而60岁之后升高,可能是由于T1和T2值的变化是由于水分、髓鞘和铁含量的变化引起的。髓鞘形成的过程中,髓鞘增多和水分减少是T1和T2值降低的原因之一,而在50岁后逐渐出现了脱髓鞘改变[24]。而孙鹏等[22]研究表明T2值随年龄增加逐渐减小,可能是由于使用的扫描序列、扫描的层厚、方位以及测量过程中感兴趣区选择的差异。同时健康志愿者筛选标准的不同也可能会造成测量值的差异。本研究通过提供不同年龄、性别及侧别海马T1、T2和PD值参考值,为海马相关疾病的早期、准确诊断提供重要依据。
第一,本次研究的样本量相对较小,需要增大样本量以提高试验结果的可信度;第二,未对不同年龄组进行进一步细化;第三,因参与本研究的均为健康志愿者,均无法取得病理作为参照;第四,长期动态观察对本研究的结果更具有说服力。
SyMRI技术通过一次扫描即可获得多种对比加权成像,具有成像时间短、可获得定量数据等优点。本研究通过初步探索正常成年人T1、T2及PD值与性别、年龄等的关系,为海马相关疾病的早期诊断及疗效评估提供有力的依据,以提高相关疾病的诊出率,为疾病的早期诊治提供更可靠的影像学信息。
全体作者均声明无利益冲突。



























