
探讨多参数肾脏磁共振成像(magnetic resonance imaging,MRI)评价肾细胞癌(renal cell carcinoma,RCC) T分期的准确性。
收集2012年6月至2018年6月在北京大学第一医院泌尿外科经手术病理证实为RCC的187例患者术前肾脏MR影像资料,以病理结果为金标准,依据肾细胞癌TNM分期的T分期标准,评价:(1)不同序列图像(T2WI、DWI及增强扫描门脉期T1WI)测量肿瘤最大径的准确性;(2)肿瘤侵犯肾周/肾窦脂肪的准确性;(3)伴有肾静脉瘤栓的准确性。采用Kappa检验评价多参数MRI与手术病理评价肾细胞癌T分期的一致性。
T2WI、DWI、增强T1WI序列图像上测量肿块最大径分别为(5.22±3.28) cm、(5.03±3.08) cm、(5.31±3.37) cm,病理测量肿块最大径为(5.24±3.59) cm,经Wilcoxon秩和检验四者间无显著差异。以瘤周脂肪间隙出现条片或结节灶作为增强MR判定瘤周脂肪浸润的标准,其敏感度、特异度、阳性预测值、阴性预测值分别为88.7%、88.1%、74.6%和95.2%。MRI评价肾静脉瘤栓的敏感度、特异度、阳性预测值及阴性预测值分别为90.9%、99.2%、98.0%、96.4%。MRI判定肾癌T分期与病理肿瘤T分期的一致性检验加权Kappa值为0.81。
RCC患者术前多参数MRI检查,能够较准确地判定肿瘤T分期,为临床治疗方法的选择提供有效信息。

肾脏恶性肿瘤约占人体全部恶性肿瘤的3%,肾细胞癌(renal cell carcinoma,RCC)源于肾小管上皮,是泌尿系统最常见的恶性肿瘤之一,仅次于膀胱癌[1, 2]。近年来,肾细胞癌的患病率呈逐年上升趋势,据全国肿瘤登记中心(National Central Cancer Registry,NCCR) 2015年度报告,2011年全国肾脏肿瘤总体发病率是3.35/100 000[3]。2015年我国新增肾细胞癌约为7万例,肾癌死亡人数约2.4万例[4]。目前肾癌的治疗仍以手术切除为主,辅以化疗及靶向治疗。治疗方法的选择及预后与肿瘤分期密切相关。术前准确评价肿瘤分期,将有助于治疗方案的制订。CT增强扫描是肾细胞癌术前临床TNM分期的重要方法[5],但因其对比分辨率低,使其假阳性率增高,从而导致患者的过度治疗。磁共振成像(magnetic resonance imaging,MRI)因其多参数、多序列、多平面成像及较高的软组织分辨率,能够更好地显示肿瘤边缘,血管腔内情况等,因此MRI检查在肾细胞癌术前TNM分期上被临床越来越多寄予期待。本研究通过分析不同T分期RCC患者MR图像的特征,并与病理结果进行对照,探讨术前多参数MRI扫描评价肿瘤T分期的准确性。
回顾性分析2012年6月至2018年6月在北京大学第一医院经手术病理证实为肾透明细胞癌,且在术前1周内行规范肾脏MR检查,具有完整MRI及病理资料的患者共187例,其中男性120例,女性67例,年龄21~82岁,平均年龄54.6岁。
本研究经过北京大学第一医院医学伦理委员会批准(批准文号:2019科研170号),免除受试者知情同意。
所有患者术前1周内行MRI(3.0 T;GE或PHILIPS)扫描,患者取仰卧位,腹部线圈,矩阵512×512,扫描野280 mm×280 mm~350 mm×350 mm之间,应用不同MR扫描设备进行扫描时,成像参数一致。平扫:横断面呼吸触发T2 FSE序列(RTr Ax T2 fs FRFSE)、横断面呼吸门控弥散加权成像(RTr Ax DWI)、屏气冠状面单次激发T2 (BH Cor T2 SSFES ARC)、屏气横断面同反相位双回波T1 (BH Ax T1 Dual Echo)、屏气横断面LAVA蒙片及动态增强扫描。增强扫描除蒙片外一般行3期扫描(皮质期、实质期、延迟期,分别在对比剂注射后的30 s、60 s、90 s)使用钆喷替酸葡甲胺(Gd-DTPA) 0.1~0.2 mmol/kg,随后追加生理盐水20 mL,注射速度2.5 mL/s。
所有图像由分别具有4年和7年泌尿生殖系统诊断经验的2名放射科主治医师按照肾癌TNM分期(American Joint Committe on Cancer,AJCC,第8版) T分期的标准对187例肾细胞癌患者的MR图像共同阅片,若存在意见分歧,则协商讨论取得一致意见,具体评分标准包括:(1)测量肿块大小,分别在T2WI、DWI、增强扫描实质期T1WI上测量肿块最大径,并与病理结果进行比较。(2)评价肿瘤周围脂肪浸润情况;根据肿块T2WI及增强扫描图像,将肿块边缘分为下列三种情况:①肿块边缘光滑锐利:即肿块边界清晰锐利,或于T1WI或T2WI平扫图像上肿块边缘可见环形或半环形低信号假包膜;②瘤周脂肪间隙模糊:即肿块与周围脂肪边界欠清;③肿块周围肾窦或肾周脂肪间隙渗出:瘤周脂肪间隙内可见结节、肿块或条片灶。(3)肾静脉瘤栓的MRI征象:肾静脉管腔增宽,腔内见条状或结节状软组织信号伴强化。(4)根据AJCC肾细胞癌的TNM分期,对肿瘤进行T分期:T1期即肿瘤局限于肾实质内且肿块最大径≤7 cm;T2期即肿瘤局限于肾实质内且肿瘤最大径>7 cm;T3a期即肾静脉或其分支瘤栓,或肿瘤侵及肾盂肾盏结构,或肿瘤侵及肾周或肾窦脂肪但未超出肾筋膜;T3b期即膈下下腔静脉出现瘤栓;T3c期即静脉瘤栓延伸至膈上下腔静脉或肿瘤直接侵犯下腔静脉管壁;T4期即肿瘤突破肾筋膜(包括同侧肾上腺受累)。
所有统计均采用SPSS 19.0软件进行分析,对计量资料采用均值±标准差表示,所有数据均采用Shaporo-Wilkins检验来验证是否服从正态分布,计量资料的比较采用t检验或Wilcoxon秩和检验。以病理结果作为金标准,计算MR扫描评价肿块周围脂肪浸润及肾静脉瘤栓的敏感度、特异度和准确度。影像T分期与病理T分期的一致性采用加权Kappa检验。以P<0.05为有统计学意义。
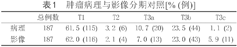
本研究共纳入187例肾细胞癌,右肾105例,左肾82例。病理肿瘤T分期:T1期115例,T2期6例,T3a期20例,T3b期44例,T3c期2例。影像肿瘤T分期:T1期116例,T2期4例,T3a期13例,T3b期43例,T3c期11例(表1)。
肿瘤病理与影像分期对照[% (例)]
肿瘤病理与影像分期对照[% (例)]
| 总例数 | T1 | T2 | T3a | T3b | T3c | |
|---|---|---|---|---|---|---|
| 病理 | 187 | 61.5 (115) | 3.2 (6) | 10.7 (20) | 23.5 (44) | 1.1 (2) |
| 影像 | 187 | 62.0 (116) | 2.1 (4) | 7.0 (13) | 23.0 (43) | 5.9 (11) |
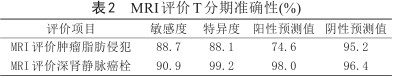
(1) MRI测量肿瘤径线的准确性:在T2WI、DWI、增强扫描实质期T1WI图像上测量的肿块最大径及病理测量的肿块最大径分别为:(5.22±3.28) cm、(5.03±3.08) cm、(5.31±3.37) cm、(5.24±3.59) cm。经Wilcoxon秩和检验四者间差异无统计学意义。T2WI上测量的径线与病理最为接近。(2) MRI评价肿瘤边缘:边界清楚117例(63例肿块可见T2WI环形或半环形低信号假包膜);边缘模糊7例;瘤周脂肪间隙条片或结节灶63例。病理提示肿块未见周围脂肪浸润134例,周围脂肪浸润53例。其中边缘模糊的7例肿块中5例病理均未见脂肪浸润。以肿块边界清楚或边缘模糊作为肿块局限于肾实质内,瘤周脂肪间隙出现条片或结节灶作为肿瘤周围脂肪浸润的诊断标准,MRI评价肿瘤侵犯周围脂肪的敏感度、特异度、阳性预测值、阴性预测值分别为88.7%、88.1%、74.6%和95.2%。(3)增强MRI评价肾静脉瘤栓:以肾静脉管腔增宽,增强扫描实质期腔内可见充盈缺损作为肾静脉瘤栓的诊断标准,其敏感度、特异度、阳性预测值及阴性预测值分别为90.9%、99.2%、98.0%、96.4% (表2;图1,2)。(4)肾细胞癌多参数MRI检查与病理肿瘤T分期一致性检验(Kappa检验):加权Kappa值为0.81,一致性较好。(5) 2名医师间一致性为0.88 (0.84,0.91),具有较好的可重复性。
MRI评价T分期准确性(%)
MRI评价T分期准确性(%)
| 评价项目 | 敏感度 | 特异度 | 阳性预测值 | 阴性预测值 |
|---|---|---|---|---|
| MRI评价肿瘤脂肪侵犯 | 88.7 | 88.1 | 74.6 | 95.2 |
| MRI评价深肾静脉癌栓 | 90.9 | 99.2 | 98.0 | 96.4 |

肾细胞癌是最常见的肾脏恶性肿瘤,好发于50岁以上。肾癌大部分为散发,仅2%~3%的肾癌发生与遗传相关。男女发病比例约为3︰2。绝大部分肾癌无临床症状,都是偶然发现。肿瘤晚期(侵及肾窦、肾周)可出现血尿、腰痛、腹部包块等症状,约3%~5%可出现血管瘤栓。肾细胞癌大部分为透明细胞癌,其次为乳头状癌和嫌色细胞癌,后两者预后较前者更好。手术是早期肾癌的首选治疗方案[6],晚期肿瘤需选择化疗或靶向治疗。术前准确评估肿瘤分期,将有助于临床制订治疗方案,并能够准确预测疾病预后。肾癌的分期取决于原发肿瘤的大小,周围组织结构浸润情况,血管瘤栓,淋巴结及远处转移情况。肾癌预后与肾周脂肪浸润,肿瘤径线,转移淋巴结的最大短径以及结外浸润密切相关[7]。当然不同亚型的肾细胞癌预后也不相同[8, 9]。
无症状的肾细胞癌多在体检行超声检查时偶然发现,表现为低回声或混杂回声边界较清楚的圆形或卵圆形肿块。多数肾细胞癌在MR上表现较典型,多可明确诊断:平扫信号不均匀,T1WI呈中低信号,T2WI呈混杂信号或高信号,皮质期明显不均匀强化,实质期强化程度低于正常肾实质。肿块易出血、坏死、囊变[10]。
随着个体化精准治疗理念在临床上的应用,肿瘤术前准确分期越来越受到临床医生的重视。高分辨增强CT扫描提高了肿瘤T分期的准确性,但因其对比分辨率低,肿瘤边界模糊不清时,易误诊为瘤周脂肪浸润,使其假阳性率增高[11, 12],从而导致患者的过度治疗。
MRI因其多参数、多系列、多平面成像及较高的对比分辨率,肿块边缘显示更加清晰。在MR图像上局限于肾实质内肿块边缘常可见环状T2WI低信号带,被称为假包膜。病理上假包膜主要由受压的肾实质和纤维成分构成[13, 14]。外缘的假包膜由受挤压密集的肾实质和纤维层构成;内缘假包膜则由受挤压的髓质构成,而纤维成分较少。假包膜的厚度可能与肿瘤的恶性程度和生长部位相关,因此假包膜的MR表现也不尽相同:可表现为薄厚均匀的薄层低信号环,或薄厚不均断续的低信号环;在T1WI、T2WI上呈环绕肿块低信号,尤以T2WI显示明显,增强后呈环形或花边样强化[15]。本研究中63例病灶在T2WI上可见假包膜,均为T1期肿瘤,病理结果亦为T1期肿瘤,诊断准确度为100%。假包膜的完整性对于手术医生非常重要。假包膜完整的患者,外科医生仅需进行简单的病灶摘除手术,能够尽可能多的保留未受侵的肾实质,从而保证肾功能。正是因为本组病例中大约53.8%的肿块可在T2WI上见假包膜,因此T2WI序列与DWI序列及增强序列比较,其测量的最大径线更接近病理结果,虽然三者在统计上并无显著差异,这与Yamashita等[16]报道一致。
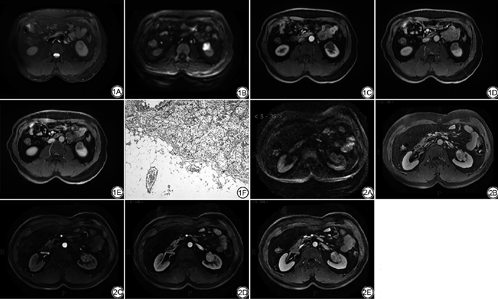
欧洲指南推荐T1期肾癌首选保留肾脏的肿块切除手术,而T2期肿瘤如果技术允许也可选择保留肾脏手术。但是对于T3及T4期肿瘤推荐全肾切除手术。因此影像提示肿瘤局部浸润(即T3a肿瘤),会影响临床治疗方案的制订,同时提示肿瘤预后较差[17]。T3a的影像诊断征象包括:肾窦脂肪浸润、肾周脂肪及肾静脉瘤栓。Davidiuk等[18]报道CT评价T3a肾细胞癌的敏感度和特异度分别为59%~88%和71%~93%,其中肾窦脂肪浸润的敏感度最高,肾血管瘤栓的特异度最高。MRI因其成像特点,能够更清晰地显示肿块的边缘,假包膜征象的出现更容易将T1、T2期肿瘤与T3a期肿瘤区分开。本研究中肾窦及肾周脂肪浸润的阴性预测值较高,达到95.2%。本组病例中有2例病理T3a期的肿瘤因边缘略模糊被MR评价为1期(图1),同时有11例T1期和1例T2期的肿瘤因可疑病灶周围脂肪浸润而被MR高估为T3a期肿瘤(图2)。这可能是由于肿瘤压迫肾周脂肪,导致肾被膜模糊,使MR难以除外肾被膜受侵。同样的研究也发现横轴位扫描在评价肾被膜是否受累时存在困难。Catalano等[19]采用1 mm的多排CT评价肾被膜受累敏感度、特异度及准确度分别为96%、93%和95%。Roy等[20]报道MRI诊断T3a期肿瘤的敏感度、特异度及准确度分别为84%、95%和91%。因此当出现肾被膜模糊的征象时对T3a的诊断要慎重对待,应根据患者的综合情况进行个体化的治疗。
MRI薄层增强扫描对于血管有很好的显示,以肾静脉管腔增宽,腔内软组织信号充盈缺损伴强化作为静脉瘤栓的诊断标准[21],本组病例中2例因肿块较大并突向肾窦生长使肾静脉分支显示不清,导致MRI漏掉肾静脉分支血栓,造成了肿瘤的低估。另外本组研究中9例肿瘤被MRI高估为T3c。其中3例腔静脉受压明显狭窄,MRI误诊为肿瘤直接侵犯腔静脉,另6例因腔静脉管壁异常信号并强化被MRI误诊为腔静脉管壁受侵。文献报道术前MR成像能够可靠地确定肾细胞癌患者的腔静脉壁的浸润[22]。
本研究尚有不足之处:(1)收集的病例中T1、T2期肿瘤较多,导致统计上的偏倚。(2)因本文是回顾性研究,收集的图像延迟扫描时间短,无法清晰显示包膜,故未在其期相上对肿瘤大小及包膜进行评价。(3)没有对不同病理亚型的肾细胞癌进行分层统计。
多参数MR检查能够较准确地对肾细胞癌进行术前T分期,但在T3分期时容易出现高估的可能。MRI T分期与病理T分期一致性较高,能够在术前为临床选择治疗方案和预测预后提供有价值的信息。
全体作者均声明无利益冲突。



























