
探索氢质子磁共振波谱(1H-magnetic resonance spectroscopy,1H-MRS)在轻度认知障碍(mild cognitive impairment,MCI)患者中双侧额叶白质代谢物变化及其应用价值。
前瞻性收集社区招募并经过筛选的 174名志愿者,经过神经心理学量表评估后分为MCI组及正常对照组(normal control,NC)。同时对其双侧额叶白质进行单体素1H-MRS扫描,利用LCModel软件自动计算双侧额叶白质主要代谢物的相对浓度。结合协方差分析、独立样本t检验及非参数曼-惠特尼U检验以比较两组间代谢物相对浓度差异,使用Pearson及Spearman相关分析法探索代谢物相对浓度与量表评分的相关性。
老年受试者(≥60岁) MCI组左侧额叶白质谷氨酸及谷氨酰胺相对浓度较NC组增加(1.77±0.08、1.48±0.08;Z=2.640,P<0.05)。针对MCI组受试者量表得分进行分析,发现听觉词汇学习测验长延时记忆及再认得分与右侧额叶白质N-乙酰天门冬氨酸+N-乙酰天门冬氨酸谷氨酸(N-acetylaspartate and N-acetylaspartylglutamate,NAA+NAAG)呈负相关(r=-0.241、-0.342,P均<0.05);形状连线测试(shape trails test,STT)-A完成时间与左侧额叶白质NAA+NAAG呈负相关(r=-0.235,P=0.044);STT-A及STT-B完成时间均与右侧额叶白质肌醇呈正相关(r=0.379、0.398,P均<0.05)。
1H-MRS代谢物改变有望作为临床上早期诊断MCI的参考依据。

轻度认知障碍(mild cognitive impairment,MCI)作为阿尔茨海默病(Alzheimer's disease,AD)的前期阶段,其3年内进展为AD的概率可高达50%[1]。对MCI阶段的患者及时给予干预措施,可有一定概率逆转其进展为AD的过程并恢复其认知功能。然而目前临床上仍缺乏活体检测MCI的客观生物标志物,这也是早期诊断MCI患者的难点。额叶占据了人脑中1/3的体积,是人类大脑中最重要的脑区之一。额叶与多个脑区之间拥有丰富的神经网络连接,并与记忆形成及抽象能力等密切相关。当患者额叶发生病理改变时,其认知状态及功能会发生改变。氢质子磁共振波谱(1H-magnetic resonance spectroscopy,1H-MRS)是目前仅有的可从活体层面观察大脑中神经元生化及递质改变的影像技术。目前额叶用于诊断MCI患者的特异性仍尚未明确,既往研究所选定的感兴趣区域亦多为脑叶灰质区。然而,有研究表明与白质病变相关的轴突损伤及少突胶质细胞增生等病理改变亦与AD病理机制有一定的相关性[2]。本文旨在利用1H-MRS检测MCI患者早期双侧额叶白质区域内潜在的代谢物水平变化,以及对其与认知状态相关性进行探索。
本研究属于前瞻性研究,已经广州市第一人民医院伦理委员会论证批准(批件号:K-2019-166-01)。所有受试者均已被充分告知检查内容并自愿签署知情同意书。
2019年1月至2020年12月社区招募志愿者360名,并经过筛选共纳入174名志愿者。入组标准:18~79岁、受教育年限≥7年、汉族、无明显视力及听力损害。排除标准:明显的左利手及双利手、既往存在颅内占位或颅脑手术史、可能引起认知受损的各类系统疾病、存在认知能力下降的主诉及磁共振扫描禁忌证。经过神经心理量表测试评估后分为正常对照组(normal control,NC)及MCI组。
MCI组共74名,男34名,女40名,年龄22~79 (55.7610.95)岁,受教育年限(10.942.84)年。NC组共100名,男61名,女39名,年龄18~72 (40.0412.65)岁,受教育年限(14.983.36)年。根据WHO对于年龄的划分标准[3],将MCI组及NC组受试者各自划分为青年组(≤44岁)、中年组(45~59岁)及老年组(≥60岁) 3个亚组。各亚组之间一般资料比较见表1。
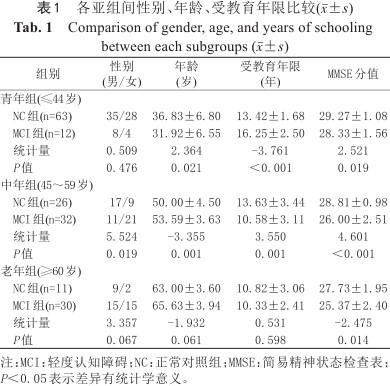
各亚组间性别、年龄、受教育年限比较(±s)
Comparison of gender, age, and years of schooling between each subgroups (x¯±s)
各亚组间性别、年龄、受教育年限比较(±s)
Comparison of gender, age, and years of schooling between each subgroups (x¯±s)
| 组别 | 性别 (男/女) | 年龄 (岁) | 受教育年限 (年) | MMSE分值 |
|---|---|---|---|---|
| 青年组(≤44岁) | ||||
NC组(n=63) | 35/28 | 36.83±6.80 | 13.42±1.68 | 29.27±1.08 |
MCI组(n=12) | 8/4 | 31.92±6.55 | 16.25±2.50 | 28.33±1.56 |
统计量 | 0.509 | 2.364 | -3.761 | 2.521 |
P值 | 0.476 | 0.021 | <0.001 | 0.019 |
| 中年组(45~59岁) | ||||
NC组(n=26) | 17/9 | 50.00±4.50 | 13.63±3.44 | 28.81±0.98 |
MCI组(n=32) | 11/21 | 53.59±3.63 | 10.58±3.11 | 26.00±2.51 |
统计量 | 5.524 | -3.355 | 3.550 | 4.601 |
P值 | 0.019 | 0.001 | 0.001 | <0.001 |
| 老年组(≥60岁) | ||||
NC组(n=11) | 9/2 | 63.00±3.60 | 10.82±3.06 | 27.73±1.95 |
MCI组(n=30) | 15/15 | 65.63±3.94 | 10.33±2.41 | 25.37±2.40 |
统计量 | 3.357 | -1.932 | 0.531 | -2.475 |
P值 | 0.067 | 0.061 | 0.598 | 0.014 |
注:MCI:轻度认知障碍;NC:正常对照组;MMSE:简易精神状态检查表;P<0.05表示差异有统计学意义。
由两名经过培训的研究者对受试者认知状态进行整体评估,使用的量表包括中文版本Folstein简易精神状态检查表(mini-mental state examination,MMSE)、郭起浩等编制的华山版听觉词汇记忆测验(Auditory Verbal Learning Test,AVLT)、Partington等研制的连线测试(Shape Trails Test,STT)、Wilma等研制的动物词语流畅性测试(Animal Fluency Test,AFT)、Harold等研制的Boston命名试验(Boston Naming Test,BNT)及Robert等编制功能活动问卷(Functional Activities Questionnaire,FAQ)。
MCI诊断标准采取Jak/Bondi制定的诊断标准[4],当受试者在至少同一个认知域的两个指标受损(测试分数低于同龄标准数值一个标准差)、3个认知域均有一项测试得分受损(测试分数低于同龄标准数值一个标准差)或FAQ≥9分,则纳入MCI组。3个认知域评估包括记忆(AVLT长延时及再认)、执行(STT-A、STT-B)及语言功能(AFT、BNT)。NC组纳入标准为受试者没有认知能力下降的主诉及担忧,并且量表评估提示无客观认知功能障碍,MMSE评分>24分。
受试者完成神经心理量表测试后1 h内进行1H-MRS检查。所用仪器为德国Siemens Skyra 3.0 T MRI仪及32通道头部相控阵线圈。扫描序列包括横轴位T2WI及T2-FLAIR、矢状位3D-T1WI及单体素点解析波谱(point-resolved spectroscopy,PRESS)序列。1H-MRS序列参数:TR/TE=1500 m/35 ms,翻转角=90°,信号平均次数=256,感兴趣区体积=10 mm3,自动抑水及体素内匀场(若匀场失败,则行手动匀场),采集时间6 min 32 s。感兴趣区域为双侧额叶白质区域,采用3D-T1WI图像多平面重建(multi-planner reformation,MPR)冠状、矢状及横断位三方位图像以进行定位,定位时最大限度避开周围脑脊液及灰质的干扰。
应用LCModel软件进行波谱数据处理,并对以下代谢物进行分析:N-乙酰天门冬氨酸+N-乙酰天门冬氨酸谷氨酸(N-acetylaspartate+N-acetylaspartylglutamate,NAA+NAAG)、胆碱复合物(Glycerophosphocholine+Phosphocholine,GPC+Pch)、肌醇(Inositol,Ins)、谷氨酸+谷氨酰胺(Glutamate+Glutamine,Glu+Gln)。各代谢物相对浓度为各主要代谢物与肌酸+磷酸肌酸(total creatine,Cr+PCr)的比值,均由软件自动计算得出。当表征波谱质量的代谢物浓度的标准偏差<20%时,该相对浓度的数值纳入统计分析。
应用SPSS 25.0行统计学分析。计数资料使用χ2检验。计量数据采用(±s)表示。对各年龄对应亚组间代谢物相对浓度差异进行对比,根据资料是否符合正态分布选择相应统计学方法。其中青年组及中年组组间一般资料差异具有统计学意义,因此采用协方差分析以校正混杂因素的影响;老年组组间一般资料差异无统计学意义,采用独立样本t检验进行组间对比。如资料不符合正态分布则采用非参数曼-惠特尼U检验。采用Pearson及Spearman相关分析法对MCI组代谢物相对浓度与神经心理量表评分进行相关性分析。P<0.05为差异有统计学意义。
在老年组(≥60岁)中, MCI组左侧额叶白质Glu+Gln相对浓度较NC组增加,组间差异具有统计学意义(P=0.007)。其余各亚组间双侧额叶代谢物相对浓度差异均无统计学意义(P均>0.05),见表2。
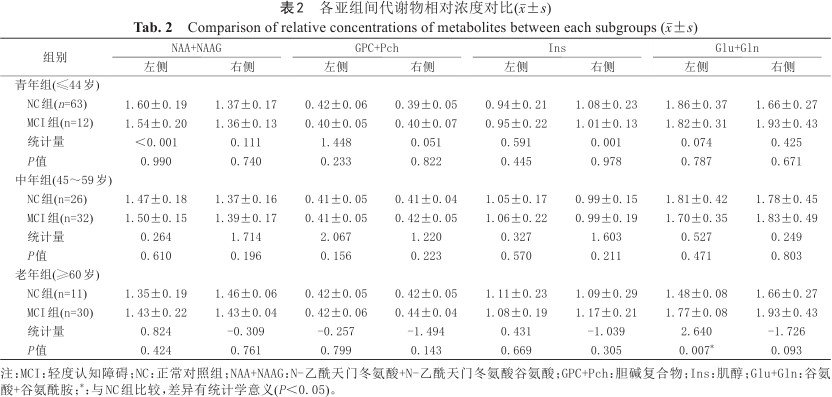
各亚组间代谢物相对浓度对比(±s)
Comparison of relative concentrations of metabolites between each subgroups (x¯±s)
各亚组间代谢物相对浓度对比(±s)
Comparison of relative concentrations of metabolites between each subgroups (x¯±s)
| 组别 | NAA+NAAG | GPC+Pch | Ins | Glu+Gln | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 左侧 | 右侧 | 左侧 | 右侧 | 左侧 | 右侧 | 左侧 | 右侧 | |||||
| 青年组(≤44岁) | ||||||||||||
NC组(n=63) | 1.60±0.19 | 1.37±0.17 | 0.42±0.06 | 0.39±0.05 | 0.94±0.21 | 1.08±0.23 | 1.86±0.37 | 1.66±0.27 | ||||
MCI组(n=12) | 1.54±0.20 | 1.36±0.13 | 0.40±0.05 | 0.40±0.07 | 0.95±0.22 | 1.01±0.13 | 1.82±0.31 | 1.93±0.43 | ||||
统计量 | <0.001 | 0.111 | 1.448 | 0.051 | 0.591 | 0.001 | 0.074 | 0.425 | ||||
P值 | 0.990 | 0.740 | 0.233 | 0.822 | 0.445 | 0.978 | 0.787 | 0.671 | ||||
| 中年组(45~59岁) | ||||||||||||
NC组(n=26) | 1.47±0.18 | 1.37±0.16 | 0.41±0.05 | 0.41±0.04 | 1.05±0.17 | 0.99±0.15 | 1.81±0.42 | 1.78±0.45 | ||||
MCI组(n=32) | 1.50±0.15 | 1.39±0.17 | 0.41±0.05 | 0.42±0.05 | 1.06±0.22 | 0.99±0.19 | 1.70±0.35 | 1.83±0.49 | ||||
统计量 | 0.264 | 1.714 | 2.067 | 1.220 | 0.327 | 1.603 | 0.527 | 0.249 | ||||
P值 | 0.610 | 0.196 | 0.156 | 0.223 | 0.570 | 0.211 | 0.471 | 0.803 | ||||
| 老年组(≥60岁) | ||||||||||||
NC组(n=11) | 1.35±0.19 | 1.46±0.06 | 0.42±0.05 | 0.42±0.05 | 1.11±0.23 | 1.09±0.29 | 1.48±0.08 | 1.66±0.27 | ||||
MCI组(n=30) | 1.43±0.22 | 1.43±0.04 | 0.42±0.06 | 0.44±0.04 | 1.08±0.19 | 1.17±0.21 | 1.77±0.08 | 1.93±0.43 | ||||
统计量 | 0.824 | -0.309 | -0.257 | -1.494 | 0.431 | -1.039 | 2.640 | -1.726 | ||||
P值 | 0.424 | 0.761 | 0.799 | 0.143 | 0.669 | 0.305 | 0.007* | 0.093 | ||||
注:MCI:轻度认知障碍;NC:正常对照组;NAA+NAAG:N-乙酰天门冬氨酸+N-乙酰天门冬氨酸谷氨酸;GPC+Pch:胆碱复合物;Ins:肌醇;Glu+Gln:谷氨酸+谷氨酰胺;*:与NC组比较,差异有统计学意义(P<0.05)。
利用LCModel进行分析后,针对MCI组全体受试者各项神经心理学量表评分与各代谢物相对浓度进行相关性分析,结果显示AVLT长延时记忆与右侧额叶白质NAA+NAAG (r=-0.241,P=0.039)呈负相关;AVLT再认测试与右侧额叶白质NAA+NAAG (r=-0.342,P=0.003)呈负相关;STT-A测试耗时与左侧额叶白质NAA+NAAG (r=-0.235,P=0.044)呈负相关,与右侧额叶白质Ins (r=0.379,P=0.001)呈正相关;STT-B测试耗时与右侧额叶白质Ins (r=0.398,P=0.001)呈正相关。
在1H-MRS波谱中,同一原子核可因其所处的化学环境及结构的不同而出现不同的共振频率,这一特性被称为化学位移[5]。1H-MRS技术的应用,可在活体层面无创性并定量地检测相应脑区代谢物的变化。目前MCI患者的诊断主要依靠神经心理量表测试,但是量表评估受到了包括评定者对量表的熟悉程度、被试者的受教育程度、情绪及配合程度等多种混杂因素的影响。1H-MRS可以直接反映脑内神经元的生化代谢改变,操作亦更加简便,具有一定临床应用价值。
近年来,与MCI相关的1H-MRS研究主要关注双侧海马、后扣带回及颞顶叶等区域[6]。有研究学者利用正电子发射断层成像发现大脑中β-淀粉样蛋白(amyloid β-protein,Aβ)沉积具有一定的顺序,并提出Aβ最早可沉积于额叶中[7]。此外,当额叶白质出现缺血性脑白质高信号时,会引起与执行控制有关的前额叶-皮质下环路的功能紊乱[8]。因此额叶白质的病理改变可在一定程度上影响患者记忆执行功能。对于此感兴趣区域的研究将有助于寻找具备更早期发现MCI患者能力的生物标志物。
对NC组及MCI组代谢物相对浓度进行对比,结果发现老年组中MCI亚组左侧额叶白质Glu+Gln相对浓度较NC亚组增高,差异具有统计学意义。过往研究指出,MCI患者中海马及后扣带回谷氨酸盐复合物浓度可出现下降[9, 10, 11]。本研究结果与这一结论并不一致。Glu参与神经元之间的信息传递、大脑发育及记忆形成等过程[12],以发挥其兴奋性神经递质的作用。但另一方面Glu在神经突触间隙的异常蓄积,可引起Ca2+的大量内流并造成神经毒性[13]。因此,Glu在MCI相关的神经元损伤中扮演着重要的角色。笔者推测本研究老年受试者MCI亚组Glu+Gln相对浓度增加的原因可能包括:(1)在MCI患者脑白质组织中可存在神经元突触的减少、髓鞘的脱失等病理改变[14]。在神经元传递功能受损的前提下,Glu水平的增加可能为机体代偿性改变,以维持中枢神经系统功能的发挥。(2)内源性Aβ的异常蓄积可增加神经突触的兴奋性及Glu的释放,从而使相应脑区Glu水平增加,并造成相应脑区神经元网络兴奋性异常增高[15, 16]。(3)在正常生理状态下,神经元及神经胶质细胞之间存在Glu-Gln循环以维持Glu水平的稳定。这一循环的破坏导致Glu在神经系统的清除受阻,Glu异常积累进一步过度刺激谷氨酸受体并发挥神经毒性作用,形成“恶性循环”。因此本研究中相关结果提示左侧额叶白质Glu-Gln相对浓度的增加可能是早期反映额叶神经元功能改变的指标,并且1H-MRS有望作为诊断MCI患者的技术补充。此外,这一病理变化发生于左侧额叶,推测可能由于大脑结构及功能的偏侧化所致。右利手人群主要由左侧大脑半球承担逻辑分析、数字处理等功能任务。另外,左侧大脑半球葡萄糖代谢及其血流量亦较对侧增加[17]。笔者推测左侧额叶可能优先于右侧而发生相应病理改变。
在本研究中,尽管MCI组受试者双侧额叶白质NAA+NAAG、Ins及GPC+PCh相对浓度尚未出现明显下降,但相关性分析结果提示右侧额叶白质NAA+NAAG相对浓度与AVLT长延时记忆及AVLT再认测试分数呈负相关,左侧额叶白质NAA+NAAG相对浓度与反映执行功能的STT-A测试所需时间呈负相关。此外,双侧额叶白质Ins相对浓度与连线测试完成时间呈正相关。
NAA存在于大多数的神经元中,其水平的变化可在一定程度上反映了相应脑区神经元数量、完整性及线粒体功能情况[18, 19]。NAAG由NAA和Glu作为原料并合成于神经元中,可抑制谷氨酸神经毒性效应从而发挥内源性神经保护作用。Ins仅在神经胶质细胞中合成,常被认为是神经胶质细胞的重要标志物。过往文献报道在MCI及AD患者多个脑区中可观察到NAA水平下降[20],并且Ins水平增加可与AD相关病理学改变相关[21]。NAA+NAAG及Ins相对浓度与量表评分相关性的形成,可能由于在认知下降的病理过程中,相应脑区出现神经元损伤及胶质细胞异常激活,神经元功能出现障碍,从而导致NAA+NAAG及Ins相对浓度发生改变并出现认知功能受损。笔者推测NAA+NAAG与Ins水平变化可在一定程度上反映额叶脑区神经元功能状态,并可能对MCI患者认知状态评估具有临床意义。
Cr是反映大脑能量储存的标志物,在大脑中Cr含量保持相对的稳定状态[22]。本研究中采用Cr+PCr作为内参,从而计算其余代谢物相对浓度变化。胆碱复合物(Cho)由GPC及PCh所组成,可作为反映神经元及胶质细胞细胞膜完整性的重要代谢物,其水平变化通常与细胞膜完整性破坏等病理情况相关。在本研究中,各年龄亚组间GPC+PCh相对浓度差异无统计学意义,并且未发现GPC+PCh相对浓度与神经心理学量表评分之间存在相关性,推测可能由于感兴趣区域的选择及双侧额叶在MCI早期尚未出现明显细胞膜破坏所致。
本研究也存在一定的局限性:(1)本研究中纳入统计的受试者数量较少,并且未能对受试者进行长时间随访。(2)本研究中使用单体素PRESS序列进行1H-MRS数据采集,因此未能对双侧额叶皮层数据进行采集;数据采集时所选取的ROI范围较小,因此信噪比亦受到一定影响。(3) ROI定位时可能存在一定的选择偏倚。
综上所述,左侧额叶白质Glu-Gln相对浓度的增加有望作为MCI患者额叶神经元改变的指标,且额叶白质NAA+NAAG及Ins水平的变化有可能对MCI患者认知状态评估具有临床意义。1H-MRS将有助于早期识别MCI患者大脑神经元代谢改变,并为临床诊断提供一定的参考依据。
This work was part of Guangzhou Science and Technology Plan Project (No. 201907010020).
全体作者均声明无利益冲突。



























