
评价基于多参数磁共振成像(multiparameter magnetic resonance imaging,MP-MRI)的放射组学特征对上皮性卵巢癌腹膜转移的预测价值。
回顾性收集86例上皮性卵巢癌患者纳入研究,所有患者均行轴位脂肪抑制T2加权成像(fat suppression-T2 weighted imaging,FS-T2WI)、扩散加权成像(diffusion-weighted imaging,DWI)和动态增强(dynamic contrast enhanced,DCE)-T1WI扫描,从每个患者术前FS-T2WI、DWI和DCE-T1WI图像中提取定量成像特征,建立放射组学模型、临床模型;结合放射组学特征及临床病理危险因素,构建放射组学诺模图,通过受试者工作特性曲线、AUC、校准曲线和临床实用性来评估该放射组学诺模图的预测性能。
来自MP-MRI组合序列的放射组学模型比单独来自FS-T2WI、DWI和DCE-T1WI的模型具有更高的AUC (0.865 vs. 0.749、0.765、0.736)。诺模图(0.953)显示出比临床模型(0.819)和组学模型(0.865)更好的诊断效果。
基于MP-MRI组合序列的放射组学诺模图对腹膜转移显示出良好的预测准确性,可用于术前识别上皮性卵巢癌患者的腹膜转移。

卵巢癌(ovarian cancer,OC)在妇科肿瘤中病死率居于首位,其中上皮性卵巢癌是最常见的类型,占所有卵巢癌的85%~90%。卵巢癌的特点是腹腔内多发转移,一旦发生腹膜转移(peritoneal carcinomatosis,PC),患者预后多较差,且病死率高,五年生存率仅为30%[1, 2, 3]。如果能够在早期发现腹膜转移,有利于避免不必要的切除和选择最佳的治疗方法。
放射组学是一个以定量成像技术为基础的新兴的有前途的研究领域,通过从医学图像中提取高通量定量放射学特征,能够低成本无创性地为肿瘤学提供决策支持[4]。该方法已成功地用于肿瘤的诊断、分级和治疗监测等方面[5, 6, 7]。近年来,该方法已成功应用于胃癌的术前腹膜转移预测[8, 9],本研究推测这种方法也同样适用于上皮性卵巢癌(epithelial ovarian cancer,EOC)。到目前为止,关于EOC的腹膜转移尚未开发出个性化的预测模型。因此,本研究旨在评估基于MP-MRI放射组学在预测EOC患者术前腹膜转移的价值。
本研究经过内蒙古医科大学生物医学科研医学伦理委员会批准(批准文号:YKD202001145),免除受试者知情同意。回顾性收集2015年6月至2020年5月在我院就诊的EOC患者86例。纳入标准:术后组织病理学证实为上皮性卵巢癌;手术前一周接受多参数MRI检查。排除标准:既往卵巢癌治疗史;盆腔MRI上有明确的腹膜转移征象;CA125等临床资料不完整。所有患者均行全子宫双附件切除术加大网膜切除手术,在肝门、盲肠、大网膜、道格拉斯袋、横隔、横结肠、肠系膜等处发现结节状转移灶,直径小于1 mm。腹膜转移的存在是由病理学专家和妇科医生根据美国癌症联合委员会指南一致确定的[10]。最终证实39例患者腹膜转移阳性,47例患者腹膜转移阴性。所有患者的临床病理特征均从病历中获得,包括年龄、术前CA125水平、腹部症状、绝经史、遗传史、分型。
所有MRI检查均在3.0 T系统(Discovery MR750,GE Healthcare,美国)上进行,使用8通道相控体部线圈。扫描前患者适度充盈膀胱,取仰卧位,扫描参数:轴位脂肪抑制T2加权成像(fat suppression-T2 weighted imaging,FS-T2WI)视野 320 mm×320 mm,TR 3429 ms,TE 68 ms,矩阵256×256,层厚5 mm,层间距2 mm;扩散加权成像(diffusion-weighted imaging,DWI) FOV 320 mm×320 mm,TR 2400 ms,TE 20 ms,矩阵128×256,层厚5 mm,层间距2 mm,b=0、1000 s/mm2;动态增强(dynamic contrast enhanced,DCE)-T1WI扫描 TR 2.8 ms,TE 1.3 ms,层厚5 mm,层间距2 mm,对比剂采用钆螯合物(Omniscan,GE Healthcare,Ireland),剂量0.1 mmol/kg,流率3.0 mL/s。
MRI数据:两位分别具有3年和10年女性盆腔MRI成像经验的放射医生,不知道病理结果,但知道EOC的诊断,一同回顾了MRI图像,并记录以下内容:(1)单侧和双侧卵巢肿瘤;(2)肿瘤大小(最大层面肿瘤体积);(3) T2信号,分为均匀和欠均匀(对比肌层信号);(4)增强程度;(5) ADC值。对于双侧病灶的患者,根据手术病理结果确定其为同一病理类型,最终选择最大的肿瘤进行分析。
在数据分割之前需要进行预处理。选取每个患者的FS-T2WI、DWI序列图像配准到DCE-T1WI(仅限动脉晚期)图像[11]。ROI由两位分别具有8年和11年腹部影像学经验的放射科医生在DWI (b=1000 s/mm2)肿瘤的最大层面沿病灶实性成分边缘对原发肿瘤进行勾画。仔细对比FS-T2WI和DCE-T1WI避开肿瘤的囊变、坏死或出血区。一个月后,分层随机抽样选取30例患者MRI资料,放射科医生对其进行第2次分割,以评估观察者内部和观察者之间的重复性。
使用AK智能软件(GE Healthcare)提取放射组学特征,包括灰度直方图特征、形态学特征、灰度共生矩阵特征、灰度游程长度矩阵功能和灰度尺寸区域矩阵特征。通过组内和组间相关系数(intraclass correlation coefficient,ICC)评价保留稳定性和重复性高的特征,设定ICC阈值为0.75;按照ICC>0.75标准,FS-T2WI、DWI和DCE-T1WI序列分别保留了508、557和508个放射组学特征。对筛选后的组学特征进行最大相关最小冗余(Max-Relevance and Min-Redundancy,mRMR)和最小绝对收缩与选择算子(least absolute shrinkage and selection operator,LASSO)回归分析,筛选用于评估腹膜转移状态的放射学特征(图1)。通过10次交叉验证进行惩罚参数调整,选择与腹膜转移状态相关的非零系数特征。
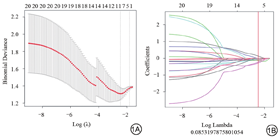

将上述方法筛选出的放射组学特征纳入多因素Logistic回归分析,建立放射组学模型。以上所有步骤都是在FS-T2WI、DWI和DCE-T1WI上执行。此外,为了进行比较,还建立了包含临床数据的模型。最后,将组学特征与临床数据相结合,构建了混合模型。为了提供预测腹膜转移概率的可视化和个性化工具,笔者绘制了诺模图。
所有统计分析均使用R语言(版本3.6.3,统计计算基础)进行。年龄、术前CA125水平、肿瘤大小、ADC值的差异采用Mann-Whitney U检验,腹部症状、绝经史、遗传史、分型、病变部位、T2信号、增强程度的差异采用卡方检验。绘制模型的ROC曲线,计算AUC和95%可信区间(confidence interval,CI),以量化模型的判别能力。应用校准曲线来评估诺模图的校准情况,并进行Hosmer-Lemesshow检验。决策曲线分析用于计算不同模型在不同阈值概率下的净收益。P<0.05表示差异具有统计学意义。
有腹膜转移的卵巢癌与无腹膜转移的卵巢癌在年龄和术前CA125水平方面有显著差异(P<0.001)。有腹膜转移的卵巢癌在腹部症状、绝经史、遗传史、分型、病变部位、肿瘤大小、T2信号、ADC等方面与无腹膜转移相比差异无统计学意义。见表1。
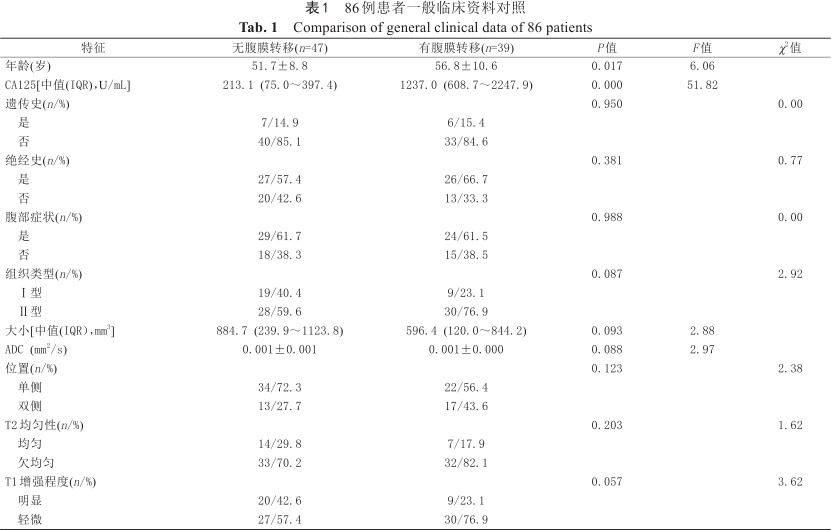
86例患者一般临床资料对照
Comparison of general clinical data of 86 patients
86例患者一般临床资料对照
Comparison of general clinical data of 86 patients
| 特征 | 无腹膜转移(n=47) | 有腹膜转移(n=39) | P值 | F值 | χ2值 |
|---|---|---|---|---|---|
| 年龄(岁) | 51.7±8.8 | 56.8±10.6 | 0.017 | 6.06 | |
| CA125[中值(IQR),U/mL] | 213.1 (75.0~397.4) | 1237.0 (608.7~2247.9) | 0.000 | 51.82 | |
| 遗传史(n/%) | 0.950 | 0.00 | |||
是 | 7/14.9 | 6/15.4 | |||
否 | 40/85.1 | 33/84.6 | |||
| 绝经史(n/%) | 0.381 | 0.77 | |||
是 | 27/57.4 | 26/66.7 | |||
否 | 20/42.6 | 13/33.3 | |||
| 腹部症状(n/%) | 0.988 | 0.00 | |||
是 | 29/61.7 | 24/61.5 | |||
否 | 18/38.3 | 15/38.5 | |||
| 组织类型(n/%) | 0.087 | 2.92 | |||
Ⅰ型 | 19/40.4 | 9/23.1 | |||
Ⅱ型 | 28/59.6 | 30/76.9 | |||
| 大小[中值(IQR),mm3] | 884.7 (239.9~1123.8) | 596.4 (120.0~844.2) | 0.093 | 2.88 | |
| ADC (mm2/s) | 0.001±0.001 | 0.001±0.000 | 0.088 | 2.97 | |
| 位置(n/%) | 0.123 | 2.38 | |||
单侧 | 34/72.3 | 22/56.4 | |||
双侧 | 13/27.7 | 17/43.6 | |||
| T2均匀性(n/%) | 0.203 | 1.62 | |||
均匀 | 14/29.8 | 7/17.9 | |||
欠均匀 | 33/70.2 | 32/82.1 | |||
| T1增强程度(n/%) | 0.057 | 3.62 | |||
明显 | 20/42.6 | 9/23.1 | |||
轻微 | 27/57.4 | 30/76.9 |
最终选取了2个FS-T2WI特征、3个DWI特征和3个DCE-T1WI特征建立模型。此外,通过多变量Logistic回归进一步去除特征,最终保留了5个特征,建立了组合的多序列模型。正如预期的那样,来自多序列组合模型比来自单一序列的模型显示出更好的区分能力,4种模型的ROC曲线见图2。
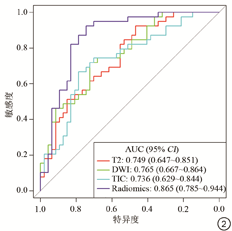

根据临床资料和放射组学特征的多变量分析,建立了包含一个临床特征和3个影像组学特征的放射学诺模图(图3)。放射学诺模图的AUC高于临床模型和组学模型(0.953,95% CI:0.914~0.993),表明放射学诺模图可以有效区分有无腹膜转移。临床模型的预测性能低于组学模型(AUC=0.819 vs. AUC=0.865)。图4总结了这3种模型的诊断性能和ROC分析结果。


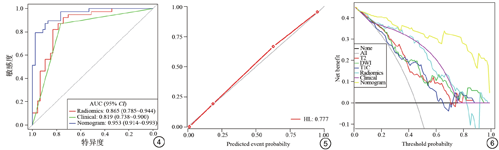

诺模图的校准曲线在预测值和观测值之间显示出较好的一致性,Hosmer-Lemesshow检验无显著性意义(P>0.05),表明具有良好的拟合度(图5)。诺模图、放射组学模型和临床模型的决策曲线分析见图6,研究发现诺模图比临床模型和组学模型具有更好的净收益。
本研究基于临床数据和反映原发肿瘤特征信息的放射组学特征,提出了一种术前预测腹膜转移的无创性诺模图。本研究表明,多序列组合模型优于单一序列模型。所构建的诺模图为腹膜转移诊断提供了一种易于使用、无创和个体化的工具,为临床医生提供了决策支持。
美国国立综合癌症网络指南推荐观察所有腹膜表面,并应选择性切除任何疑似存在转移的腹膜表面,这就需要尽可能准确、全面地识别腹膜转移灶。因此,迫切需要一种准确的非侵入性技术来评估腹膜转移的状况。在此之前,已经有一些研究探讨了MRI在评估上皮性卵巢癌腹膜转移方面的价值。目前,所有已发表的研究都是小样本量的情况下进行的,且主要集中在常规影像学上[12, 13, 14]。很多EOC发生腹膜转移时不伴腹水,由于腹膜皱褶多,在无腹水或腹水较少时极易导致较小的腹膜转移结节被遗漏,影响患者的治疗和预后。CT是检测腹膜转移的常用工具,但其漏诊率高。18F-FDG PET/CT虽然在评估腹膜转移状态中取得了不错的效果,但因其费用昂贵,并没有得到广泛使用。腹膜种植的确诊主要依靠开腹探查手术及腹腔镜检查,但这种有创且昂贵的手术并不是常规的,而且存在一定的风险,如术中肿瘤包膜破裂、切口转移等[15, 16]。MRI对软组织具有高分辨率,并且可以清楚地显示解剖关系。迄今为止,MRI往往是卵巢癌的精确成像技术。
本研究选取了MRI上没有明确转移征象的病例,这是因为本研究旨在探索一种能够发现隐匿性腹膜转移的工具。本研究从MP-MRI图像提取了1000多个特征,评估了上皮性卵巢癌患者在FS-T2WI、DWI、DCE-T1WI及它们三者结合时,MR成像特征对有无腹膜转移的鉴别能力。当FS-T2WI、DWI与DCE-T1WI结合时,对癌症有无腹膜转移的诊断效能最好,这与之前的文献报道相一致[17, 18]。本研究是结合解剖、扩散和灌注MRI,并使用基于原发肿瘤的放射组学分析来预测上皮性卵巢癌腹膜转移的研究。
在本研究中,术前CA125水平被认为是腹膜转移的独立预测因子,年龄对于腹膜转移的预测有一定潜力,但不如CA125有效,因此建立了基于CA125的临床模型。本研究数据表明,高水平的CA125发生腹膜转移的风险明显增高,这与之前的文献报道结果一致[19, 20]。与此同时,为了便于临床使用,本研究开发了一种包含术前CA125水平和放射组学特征的诺模图,其AUC值为0.953,在预测腹膜转移方面具有更高的诊断性能,DCA曲线也表明其具有令人满意的临床实用性。诺模图综合临床数据与放射组学特征,包含了多维的定量和详细的信息,因此其得出的结果更客观和准确。
腹膜转移常见于胃、胆囊、胰腺、肺、肠、子宫和卵巢[21, 22, 23]。最近,有研究表明放射组学可以用来预测癌症患者的腹膜转移[8, 9]。Dong等[8]开发了一种个体化的诺模图来鉴别晚期胃癌的隐匿性腹膜转移,并取得了较好的结果。本研究的主题与他们相同,但是在细节上却有许多不同之处。首先,本研究采用了MP-MRI提取特征,能够更全面、更详细地反映肿瘤信息。其次,本研究不仅建立了单一序列模型,还建立了它们的组合模型,通过比较发现,组合模型在预测腹膜转移方面具有更好的性能。此外,本研究建立的诺模图也显示出了较好的临床实用性,能为临床术前预测卵巢癌的腹膜转移状态提供诊断依据。
首先,这是一项样本量较小的回顾性研究,因此结果可能是有偏见的,未来需要进行多中心、大样本、前瞻性的随机对照研究。其次,本研究选取了最大层面的实性成分作为研究对象,也许整个肿瘤能提供更全面丰富的信息。此外,本研究仅对动脉晚期MRI图像进行放射组学分析,也许静脉期MRI图像可能会提供更多有用的放射组学信息,这需要继续探讨。最后,本研究只选取了原发肿瘤,腹膜的放射组学特征没有常规使用,未来腹膜的放射组学分析值得进一步研究,探索其价值。
总之,本研究建立了基于术前CA125和来源于原发肿瘤放射组学特征的诺模图,用于上皮性卵巢癌患者术前预测腹膜转移。这一有效且易于操作的新方法为上皮性卵巢癌患者制定个性化治疗计划提供了一种非侵入性的可靠工具。
This work was part of Natural Science Foundation of Inner Mongolia Autonomous Region (No. 2020MS08128).
全体作者均声明无利益冲突。



























