
分析常规MRI检查及扩散加权成像(diffusion weighted imaging,DWI)在直肠癌术前评估中的应用价值。
回顾性分析本院42例直肠癌患者资料,所有患者均于术前行盆腔MRI平扫+DWI+增强检查,通过MRI影像表现评估直肠癌的T、N分期,环周切缘(circumferential resection margin,CRM)情况,与术后病理结果进行对照分析,评价常规MRI+DWI检查诊断直肠癌术前分期的准确性;并通过测定肿瘤的ADC值,探究DWI在直肠癌诊断及术前评估中的应用价值。
常规MRI+DWI评估术前T、N分期及CRM情况与术后病理结果的一致性较好(Kappa值分别为0.745、0.691、0.642);比较不同T分期直肠癌的ADC值得出T分期级别越高,ADC值越低,组间ADC值差异有统计学意义(T1~2组与T3组比较,P=0.015,T3组与T4组比较,P=0.01);CRM阳性的肿瘤ADC值低于CRM阴性者,差异有统计学意义(P=0.015)。
常规MRI及DWI成像对直肠癌术前分期和CRM的评估有较高的应用价值,ADC值对直肠癌的诊断和术前评估有一定的参考价值。

近年来,直肠癌的发病率逐年升高并趋于年轻化,随着检查技术和治疗方式的改进,患者的生存率有所提高[1, 2],常规MRI检查(平扫+增强)是目前直肠癌常用的检查技术,可提供肿瘤形态学、血流灌注等信息,但对直肠癌的整体评估仍有一定的局限性,扩散加权成像(diffusion weighted imaging,DWI)可间接反映肿瘤组织微观结构情况,可进一步提高MRI检查对直肠癌评估的准确性,而ADC值为DWI的量化指标,目前对直肠癌分期、环周切缘(circumferential resection margin,CRM)情况的评估价值目前尚无定论[3],故本研究拟收集本院42例直肠癌患者的术前MRI平扫+DWI+增强扫描影像数据,根据其影像表现评估肿瘤的T、N分期和CRM受侵情况,并与术后病理结果进行对照研究,分析常规MRI+DWI检查在直肠癌术前评估中的应用价值;分析比较不同T分期、CRM阳性和CRM阴性直肠癌的ADC值差异,探讨ADC值在直肠癌术前评估中的临床应用价值,为临床医师制定正确的治疗方案提供更多帮助,改善患者预后。
回顾性分析2014年2月至2020年9月本院42例行盆腔MRI+DWI+增强扫描检查后手术治疗,病理证实为直肠癌的患者资料,其中男28例,女14例,年龄40~85 (63.5±10.2)岁。纳入标准:(1)患者MRI检查前未做任何治疗,MRI检查后2周内手术治疗并获得病理结果;(2)年龄18~85岁;(3)患者或家属签署盆腔MRI检查知情同意书。排除标准:(1)直肠占位为其他部位的恶性肿瘤转移灶或直接侵犯。(2)图像质量不符合阅片要求。本研究经过本单位医学伦理委员会批准(批准文号:2020-LHKY-033-01),免除受试者知情同意。
采用德国西门子3.0 T磁共振扫描仪(MAGNETOM Skyra),患者检查前禁食12 h,及时排便,检查前10 min肌内注山莨菪碱减少肠蠕动。应用18通道相控阵腹部线圈置于下腹部,采取仰卧位,头先进,扫描范围自骶岬水平至耻骨下方。主要扫描序列有:(1)高分辨T2WI轴位:TR 4500 ms,TE 101 ms,FOV 200 mm×200 mm,矩阵320×320,层厚3 mm,层间距10%,层数30;(2) T1WI压脂轴位:TR 800 ms,TE 13 mm,FOV 300 mm×300 mm,矩阵256×204,层厚5 mm,层间距30%,层数30;(3) DWI序列:TR 4600 ms,TE 58 mm,FOV 400 mm×400 mm,矩阵148×111,层厚5 mm,层间距30%,层数30;(4)增强扫描为T1 VIBE序列,TR 3.22 ms,TE 1.18 mm,FOV 360 mm×360 mm,矩阵320×288,层厚4.5 mm,层间距10%,层数48。注射的对比剂为钆特酸葡胺注射液(多它灵),采用高压注射器经肘前静脉注射,注射剂量0.02 mmol/kg,流速为2 mL/s。
由2名经验丰富的副主任医师以上职称的放射科医师分别进行阅片,判断出T、N分期,以及CRM是否受侵,若诊断结果不一致,则经协商讨论取得一致结果作为最终结果。直肠癌分期根据美国癌症联合委员会直肠癌TNM分期标准(第8版)[4]。常规MRI上T1、T2期病变表现为黏膜线中断,肠壁增厚,但未突破肠壁外缘,肠壁外脂肪间隙清晰;T3期表现为肠壁外缘不光整,凹凸不平,可有结节状突出,病变肠壁周围脂肪间隙内有索条状异常信号;T4期肿瘤与周围脏器或结构界限不清或脂肪间隙消失。T1和T2期直肠癌在常规MR图像上分辨较为困难,且临床治疗原则相同,故本研究将两者合并为T1~T2期进行分析[5]。影像学淋巴结转移的形态学标准有:(1)短径≥9 mm伴或不伴有边缘不规则或信号不均匀或呈圆形;(2)短径5~9 mm之间,并伴有边缘不规则、信号不均匀、呈圆形三个征象的其中两个征象;(3)短径≤5 mm,并呈圆形,且边缘不规则、信号不均匀[6]。CRM是指肿瘤到直肠系膜筋膜的距离,直肠系膜筋膜在常规MRI上表现为包绕直肠系膜脂肪的线状低信号,当肿瘤的最外缘、直肠系膜内转移淋巴结、癌结节或受侵的血管与筋膜的最短距离<1 mm时,则视为CRM受侵(CRM阳性)[7]。
同时,由1名副主任医师和1名住院医师在西门子工作站上测量每个患者病灶的ADC值。结合T2WI压脂、增强扫描及DWI (b值=800 s/mm2)图像,在ADC图像上选取肿瘤显示最好的3个层面分别勾画1个ROI,测量ADC值,勾画ROI面积约15 mm2,勾画时应避开出血、坏死及囊变区,将3个ROI所测得的ADC值之和除以3后所得的平均值作为该患者病灶的ADC值。
在SPSS 16.0统计学软件上分别采用方差分析、卡方检验比较不同T分期患者、CRM阳性组和阴性组患者年龄、性别是否存在组间差异(年龄数据符合正态分布和方差齐性)。采用Kappa检验对常规MRI+DWI与病理的T、N分期及CRM诊断结果的一致性进行检验,检验水准α=0.05,Kappa值≤0.4时说明一致性较差,0.4<Kappa值≤0.6说明中度一致,0.6<Kappa值≤0.8时表示一致性较好,Kappa值>0.8时表示一致性极好;分别计算常规MRI+DWI对T、N分期及CRM诊断效能。
检验不同T分期、CRM阳性和阴性组间ADC值是否符合正态分布和方差齐性,再采用单因素方差分析比较T1~2期、T3期、T4期三组的ADC值差异有无统计学意义,再用相邻两组差异有统计学意义的ADC值绘制ROC曲线,计算AUC和区别两组间的阈值(敏感度+特异度的最大值)。采用独立样本t检验比较CRM阳性与阴性组ADC值的差异,若两组间ADC值差异有统计学意义,再应用ADC值绘制ROC曲线,并计算AUC及区分两组的阈值。
42例直肠癌患者中,腺癌38例,高级别管状腺瘤伴癌变3例,黏液腺癌1例;高分化6例,中分化28例,低分化8例;隆起型18例,溃疡型24例,病理分期:T1~T2期15例,T3期17例,T4期10例;N0期20例,N1期15例,N2期7例。不同T分期患者的性别、年龄组间比较差异无统计学意义(P>0.05),CRM阳性和阴性患者的性别、年龄组间比较差异无统计学意义(P>0.05) (表1)。
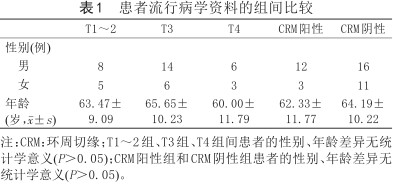
患者流行病学资料的组间比较
患者流行病学资料的组间比较
| T1~2 | T3 | T4 | CRM阳性 | CRM阴性 | |
|---|---|---|---|---|---|
| 性别(例) | |||||
男 | 8 | 14 | 6 | 12 | 16 |
女 | 5 | 6 | 3 | 3 | 11 |
年龄 (岁,±s) | 63.47±9.09 | 65.65±10.23 | 60.00±11.79 | 62.33±11.77 | 64.19±10.22 |
注:CRM:环周切缘;T1~2组、T3组、T4组间患者的性别、年龄差异无统计学意义(P>0.05);CRM阳性组和CRM阴性组患者的性别、年龄差异无统计学意义(P>0.05)。
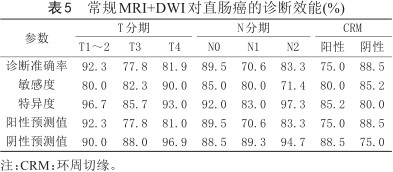
常规MRI+DWI评价T、N分期及CRM整体准确率分别为83.3%、81%、83.3%,与病理结果比较一致性均较好(Kappa值分别为0.745、0.691、0.642,P<0.01) (表2, 3, 4)。常规MRI+DWI对直肠癌T、N各期及CRM的诊断效能(准确率、敏感度、特异度、阳性预测值、阴性预测值)见表5。典型直肠癌影像见图1、2。
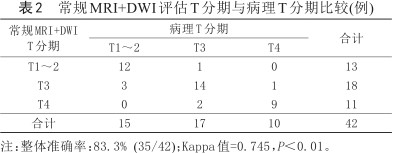
常规MRI+DWI评估T分期与病理T分期比较(例)
常规MRI+DWI评估T分期与病理T分期比较(例)
常规MRI+DWI T分期 | 病理T分期 | 合计 | ||
|---|---|---|---|---|
| T1~2 | T3 | T4 | ||
| T1~2 | 12 | 1 | 0 | 13 |
| T3 | 3 | 14 | 1 | 18 |
| T4 | 0 | 2 | 9 | 11 |
| 合计 | 15 | 17 | 10 | 42 |
注:整体准确率:83.3% (35/42);Kappa值=0.745,P<0.01。
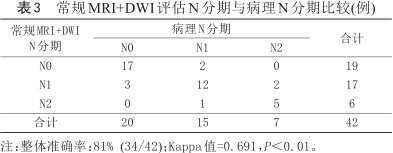
常规MRI+DWI评估N分期与病理N分期比较(例)
常规MRI+DWI评估N分期与病理N分期比较(例)
常规MRI+DWI N分期 | 病理N分期 | 合计 | ||
|---|---|---|---|---|
| N0 | N1 | N2 | ||
| N0 | 17 | 2 | 0 | 19 |
| N1 | 3 | 12 | 2 | 17 |
| N2 | 0 | 1 | 5 | 6 |
| 合计 | 20 | 15 | 7 | 42 |
注:整体准确率:81% (34/42);Kappa值=0.691,P<0.01。
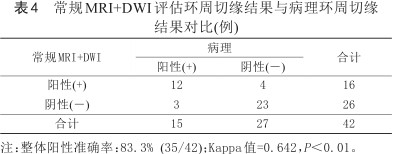
常规MRI+DWI评估环周切缘结果与病理环周切缘结果对比(例)
常规MRI+DWI评估环周切缘结果与病理环周切缘结果对比(例)
| 常规MRI+DWI | 病理 | 合计 | |
|---|---|---|---|
| 阳性(+) | 阴性(-) | ||
| 阳性(+) | 12 | 4 | 16 |
| 阴性(-) | 3 | 23 | 26 |
| 合计 | 15 | 27 | 42 |
注:整体阳性准确率:83.3% (35/42);Kappa值=0.642,P<0.01。
常规MRI+DWI对直肠癌的诊断效能(%)
常规MRI+DWI对直肠癌的诊断效能(%)
| 参数 | T分期 | N分期 | CRM | |||||
|---|---|---|---|---|---|---|---|---|
| T1~2 | T3 | T4 | N0 | N1 | N2 | 阳性 | 阴性 | |
| 诊断准确率 | 92.3 | 77.8 | 81.9 | 89.5 | 70.6 | 83.3 | 75.0 | 88.5 |
| 敏感度 | 80.0 | 82.3 | 90.0 | 85.0 | 80.0 | 71.4 | 80.0 | 85.2 |
| 特异度 | 96.7 | 85.7 | 93.0 | 92.0 | 83.0 | 97.3 | 85.2 | 80.0 |
| 阳性预测值 | 92.3 | 77.8 | 81.0 | 89.5 | 70.6 | 83.3 | 75.0 | 88.5 |
| 阴性预测值 | 90.0 | 88.0 | 96.9 | 88.5 | 89.3 | 94.7 | 88.5 | 75.0 |
注:CRM:环周切缘。

T1~2期组ADC值范围是(0.764~1.287)×10-3 mm2/s,平均值0.968×10-3 mm2/s,T3期组ADC值范围是(0.514~1.035)×10-3 mm2/s,平均值0.845×10-3 mm2/s,T4期组ADC值范围是(0.411~0.812)×10-3 mm2/s,平均值0.697×10-3 mm2/s;三组ADC值均符合正态分布和方差齐性,方差分析结果显示T1~2与T3组,T3组与T4组间ADC值差异均有统计学意义(P=0.01)。
采用T1~2期与T3期组的ADC值绘制ROC (图3)曲线得出AUC为0.722,阈值为0.9396×10-3 mm2/s (敏感度=0.882,特异度=0.533);采用T3期与T4期的ADC值绘制ROC曲线(图4)得出AUC为0.829,阈值为0.8258×10-3 mm2/s (敏感度=1.000,特异度=0.647)。
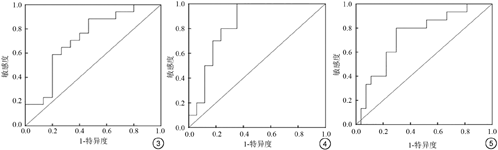

CRM阳性组ADC值范围为(0.5136~0.9944)×10-3 mm2/s,平均ADC值为0.77×10-3 mm2/s,阴性组ADC值范围为(0.4114~1.287)×10-3 mm2/s,平均值为0.899×10-3 mm2/s,两组间的ADC值符合正态分布和方差齐性,两组间的ADC值比较显示差异有统计学意义(P=0.015)。绘制ROC曲线(图5)所得AUC为0.736,阈值为0.8424×10-3 mm2/s (敏感度=0.800,特异度=0.704)。
T分期是直肠癌预后的独立影响因素之一,决定临床治疗方案的选择[8, 9]。肿瘤周围的炎症反应、局部纤维化在MRI上可表现为与肿瘤浸润突破肠壁类似的征象[10],T2期可能会被误判为T3期,两者主要的鉴别点在于T2WI上固有肌层的低信号是否中断,肠壁外缘是否光整。部分肿瘤与邻近脏器位置紧密但无侵犯,可能会导致T3期过高诊断为T4期;T3或T4期的过低分期主要与部分容积效应和肿瘤的“显微镜浸润”有关,故而常规MRI+DWI诊断时则需要利用各个序列的优势,对图像进行多方位联合、细致的分析,本研究结果显示常规MRI+DWI对直肠癌各T分期的诊断有较高的准确度、敏感度及特异度,整体准确率达到83.3%,与先前的研究结果基本一致[11, 12],研究显示,直肠内注水增强对比方法可使病变显示更加清楚[13],在保证安全的前提下,可推广此种方法,提高病变的诊断准确率。
区域淋巴结转移是直肠癌的主要扩散方式,是新辅助化疗的指征之一[14],术前淋巴结转移的识别较为困难,正常淋巴结,反应性淋巴结和转移淋巴结在大小上有很大的重叠[15],本研究将淋巴结的大小、形态、边缘和信号改变特点综合分析来判断其良恶性,与病理结果一致性较好,总体诊断准确率为81%,与文献报道的研究结果基本符合[16, 17]。有时转移淋巴结的大小在正常范围内而在常规MRI+DWI上其边缘、信号变化并不明显,可能会导致评估错误,所以评估转移性淋巴结时还需要参考肿瘤发生的部位,肿瘤的大小以及肿瘤浸润的深度等情况进行综合判断[18, 19]。
欧洲医学学会肿瘤学临床实践指南中指出,CRM阳性时,肿瘤局部复发和外转移风险增加,远期生存率较差[20],MRI技术是判断CRM情况较为可靠的检查方法,有研究提示,如果术前常规MRI+DWI显示CRM<1 mm时,其死亡风险比CRM>1 mm的患者高了99%[4],把CRM<1 mm作为其受累的标准时有较高的特异度和阴性预测值[21, 22],故本研究以CRM<1 mm为阳性标准,42例患者中有16例常规MRI+DWI诊断CRM阳性,与病理结果的一致性较好,阳性预测值为75%,16例中有4例判断错误,主要原因是部分距离CRM小于1 mm的增生淋巴结误判为转移淋巴结,以及原发肿瘤周围的炎性反应导致直肠周围脂肪间隙浑浊、纤维增生延伸至直肠系膜筋膜在常规MR图像上误认为是肿瘤已经侵犯直肠系膜筋膜;还有3例CRM阳性病例误判为CRM阴性,回顾发现有1例为与CRM距离小于1 mm的癌结节,由于其直径<5 mm且形态规则,边缘光滑而误判为非转移性淋巴结;另外2例是原发肿瘤在MRI图像上显示与CRM距离大于1 mm,而病理显示肿瘤已侵犯直肠系膜筋膜。
DWI序列可以反映组织细胞水分子的微观运动,肿瘤细胞由于细胞核增大,细胞核与核浆比例增加,与正常细胞相比,细胞内外空间减少,限制了水分子扩散,从而在DWI序列上表现为高信号。ADC值是量化水分子扩散程度的指标,水分子扩散越受限,ADC值越低,所以ADC值在一定程度上反映了组织细胞的生物学特性,研究发现肿瘤的分化程度越低,对应的ADC值越低[23]。以往研究显示T3~4期比T1~2期的ADC值有下降的趋势[24],但直肠癌T分期与ADC值是否有关目前尚存在争议[24, 25],而CRM情况与ADC值的关系尚无研究报道,本研究同样发现T分期越高的直肠癌测得ADC值越低,并将CRM阳性和阴性肿瘤的ADC值进行比较分析,发现CRM阳性组ADC值明显低于CRM阴性组,且上述ADC值的差异均有统计学意义,利用ADC值绘制ROC曲线的AUC>0.5,并得到了ADC区分相邻T分期以及CRM阳性和阴性的阈值,说明随着肿瘤浸润深度的增加,更多的正常细胞被肿瘤细胞代替,同时肿瘤细胞不断发育,水分子扩散受限程度可能进一步加重,表现出ADC值的进一步降低。T分期和CRM都是直肠癌预后的独立危险因素,提高其术前的评估准确率对于改善预后有重要意义,除了常规MRI,本研究发现肿瘤的ADC值也可作为一项参考指标用于直肠癌的术前评估,提高诊断效能,具有推广价值。由于淋巴结体积相对较小,选取ROI测量ADC值的误差较大,本研究未将ADC值用于转移性淋巴结的判断,相信随着MRI技术的不断进步,可以实现小视野DWI等多种方法进行直肠的扫描,将进一步提高直肠癌T、N分期等方面评估的准确性[3]。
本研究还存在一定不足,本研究样本量相对不足,可能使统计结果产生偏差,因此需要在后续的工作中扩大样本量,并对术后或化疗的患者做更多的纵向研究,在指导临床治疗选择方面更有意义。其次,本研究ADC值的测量是通过对三个ROI的ADC值取平均值后获得的,这可能不能完全代表整个肿瘤整体情况。本研究仅对常规MRI和DWI序列进行了分析研究,下一步工作中希望引入更多MRI新技术对直肠癌的诊治及预后评估进行探讨和分析。
本研究结果表明常规MRI+DWI对直肠癌术前局部T、N分期、CRM的评估准确率较高,DWI序列是直肠癌评估不可或缺的MRI序列,ADC值可作为一种无创的影像生物标志物,为直肠癌的整体评估提供更多有价值的信息,相信随着MRI技术的不断发展,未来会在直肠癌的诊断方面发挥着越来越重要的作用。
全体作者均声明无利益冲突。



























