
探讨T1 mapping参数及细胞外容积分数(extracellular volume fraction,ECV)在诊断急性胰腺炎(acute pancreatitis,AP)及复发性急性胰腺炎(recurrent acute pancreatitis,RAP)中的应用价值。
回顾性分析2018年12月至2020年6月行常规胰腺MRI平扫及增强、T1 mapping检查的患者,纳入AP患者40例及正常对照组22例。其中AP患者根据胰腺炎发作次数分为初次AP发作(single acute pancreatitis,SAP)组及RAP组。分别测量所有患者增强扫描前后的胰腺实质的T1 mapping参数(T1pre pancreas及T1post pancreas)及同层面腹主动脉T1值(T1pre blood及T1post blood),通过公式计算获得胰腺实质强化率(pancreatic enhancement ratio,PER)及ECV值。采用独立样本t检验和Mann-Whitney U检验进行SAP组及RAP组、AP组及正常组两两组间T1 mapping参数及ECV的比较。
AP组的T1pre pancreas、T1post pancreas、PER及ECV参数值[分别为(1145.20±25.90) ms、(473.50±13.20) ms、0.65±0.00、0.39±0.00]均高于正常对照组的相应值[分别为(802.20±12.20) ms、(434.60±8.40) ms、0.38±0.00、0.28±0.00],其差异具有统计学意义(P<0.05)。在SAP组与RAP组间,仅有ECV值(0.35±0.20及0.41±0.10)的差异具有统计学意义(P=0.01),其ROC曲线下面积为0.72。
T1 mapping参数和细胞外容积分数可有效鉴别AP及RAP。

急性胰腺炎(acute pancreatitis,AP)是临床常见的急腹症之一,是由于各种原因引起胰酶的异常激活,炎症因子释放及级联效应导致胰腺炎症的发生[1, 2]。其中约2/3的患者为轻型AP,多为短病程,易于治愈[3]。研究表明,约22%的患者在初次急性胰腺炎(single acute pancreatitis,SAP)发病治愈后会再次发作,称为复发性急性胰腺炎(recurrent acute pancreatitis,RAP),而小部分患者最终会发展成为慢性胰腺炎(chronic pancreatitis,CP)[4, 5]。相对比CP的典型影像学表现(胰腺实质钙化,胰管扩张扭曲伴或不伴胰管结石等)[6],RAP的影像改变不明显,较难做出明确诊断。
T1 mapping作为一种新兴的磁共振定量技术,通过测量增强扫描前后的T1纵向弛豫时间及细胞外容积分数(extracellular volume fraction,ECV)可对组织特性做出定量评估及定性诊断[7]。目前常见应用于心肌、肝脏及慢性胰腺炎等的纤维化评估中[8, 9, 10],对于诊断AP的研究较少。因此,本研究旨在探讨T1 mapping技术在AP及RAP的诊断价值。
本研究为回顾性研究,经过南京医科大学第一附属医院医学伦理委员会批准,免除受试者知情同意。回顾性分析2018年12月至2020年6月于我院行常规胰腺MRI平扫及增强、T1 mapping检查的急性胰腺炎患者资料,纳入符合AP标准的病例40例。所有影像学检查均在胰腺炎发作一周内获得[检查时间中位数为发病后5 d (四分位距为4~6 d)]。AP组患者的随访时间为1.0~48.0 (11.3±9.7)个月。通过病史询问、门诊随访等方式根据胰腺炎发作次数,将其分为SAP组(20例)和RAP组(20例)。另外根据有无胰腺炎发作将SAP组和RAP组合并为AP组(40例),纳入同时期检查的正常组(22例)作为对照。
AP的诊断标准按照2012年亚特兰大修订版,符合以下三个条件中的两个或两个以上:(1)急性的持续性上腹痛,可放射到后背;(2)血清淀粉酶或脂肪酶浓度高于正常上限值3倍以上;(3)典型的胰腺炎影像学改变。SAP的入组条件需同时满足以下两点:(1)达到AP诊断标准;(2)为首次AP发作。RAP的诊断标准参考国内外文献[11],需同时满足以下四点:(1)至少2次AP发作;(2)两次AP发作时间间隔大于3个月;(3)初次发作AP后已经完全缓解或治愈(即临床体征缓解、实验室相关指标恢复至正常水平);(4)排除慢性胰腺炎。正常组纳入标准:(1)胰腺形态、大小正常;(2)无胰腺病变的临床症状及病史。同时三组病例均采用以下排除标准:(1)图像存在呼吸运动伪影;(2)胰腺肿瘤性病变;(3)腹部手术病史。并且收集患者的年龄、性别、胰腺炎病因、MRI检查前的红细胞比容(haematocrit,HCT)参数等资料。
所有患者均在同一台机器上(德国Siemens Skyra 3.0 T MR)进行扫描,采用18通道体部线圈。检查前禁食4~6 h,训练患者呼吸及合理屏气,取仰卧位。扫描范围自膈肌顶部至髂骨翼上缘水平。
患者均行常规扫描序列:(1)梯度回波T1WI正反相位序列;(2)快速自旋回波T2WI序列;(3)脂肪抑制T1WI平扫;(4)增强多期扫描。使用高压注射器静脉注射,对比剂采用马根维显(Gd-DTPA,拜耳保健医药公司),剂量为0.2 mmol/kg,速率3.0 mL/s。T1 mapping扫描采用Look-Locker序列,分别于增强前和增强后6 min进行采集,相关参数为TR 3.0 ms,TE 1.32 ms,翻转角8°,层厚5 mm,信号采集次数1,FOV 38 cm×30 cm,矩阵174×288。
T1 mapping图像扫描后传输至西门子Syngo Via后处理工作站,生成伪彩图。利用椭圆测量工具绘制感兴趣区(region of interest,ROI)。通过参考常规T1W1及T2WI轴位图像,避开主胰管、胰腺周围的血管、脂肪、坏死成分等结构,将相同大小的ROI (大小控制在50 mm2左右)放置在信号均匀的胰腺实质内。在增强前及增强后的T1 mapping图像中,ROI分别放置于胰头、胰体、胰尾部(图1)及同层面的主动脉内测量T1弛豫时间值,获取增强前后胰腺头体尾部三处的平均测量值作为胰腺实质的测量值,记为T1pre pancreas、T1post pancreas;获取增强前后主动脉内的平均测量值记为T1pre blood及T1post blood。增强前及增强后ROI放置的位置保持一致。所有的测量工作由2名具有3年以上诊断经验的放射学医师在未知临床资料的条件下独立测量,当2名医师测量结果的一致性较高时[组内相关系数(intraclass correlation coefficient,ICC)值>0.75],取二者测量结果的平均值作为最终结果;若二者测量结果一致性较差(ICC值<0.75),则由另一名高年资医师(具有23年诊断经验)进行测量作为最终结果。

胰腺ECV的数值通过以下公式进行计算:
ECV=
同时计算胰腺实质强化率(pancreatic enhancement ratio,PER)。
PER=
使用SPSS 25.0软件及R语言软件(版本4.0.2)进行统计学分析。连续性数据表示为均数±标准差(±s),分类型数据表示为百分比。由于样本量较小,采用Shapiro-Wilk方法检验数据是否符合正态分布。应用独立样本t检验和Mann-Whitney U检验进行SAP组及RAP组、AP组及正常组组间T1弛豫时间及ECV的比较。分别绘制差异具有统计学意义的T1 mapping参数的ROC曲线,计算出最佳阈值。采用箱式图展示不同分组间T1 mapping参数的分布情况。两位医师测量结果的一致性采用组内相关系数来评价。当P<0.05时,其差异具有统计学意义。
SAP组20例患者中男10例,女10例,年龄24~77 (51.7±16.2)岁;RAP组20例患者中男9例,女11例,年龄25~74 (53.4±13.2)岁;正常组22例中男10例,女12例,年龄29~77 (53.4±14.8)岁。SAP组中病因构成为:胆源性7例,酒精性2例,高脂血症4例,无明显诱因7例;RAP组中病因构成:胆源性10例,高脂血症3例,无明显诱因7例。具体见表1。
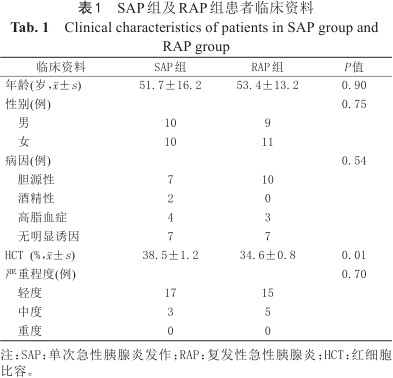
SAP组及RAP组患者临床资料
Clinical characteristics of patients in SAP group and RAP group
SAP组及RAP组患者临床资料
Clinical characteristics of patients in SAP group and RAP group
| 临床资料 | SAP组 | RAP组 | P值 |
|---|---|---|---|
| 年龄(岁,±s) | 51.7±16.2 | 53.4±13.2 | 0.90 |
| 性别(例) | 0.75 | ||
男 | 10 | 9 | |
女 | 10 | 11 | |
| 病因(例) | 0.54 | ||
胆源性 | 7 | 10 | |
酒精性 | 2 | 0 | |
高脂血症 | 4 | 3 | |
无明显诱因 | 7 | 7 | |
| HCT (%,±s) | 38.5±1.2 | 34.6±0.8 | 0.01 |
| 严重程度(例) | 0.70 | ||
轻度 | 17 | 15 | |
中度 | 3 | 5 | |
重度 | 0 | 0 |
注:SAP:单次急性胰腺炎发作;RAP:复发性急性胰腺炎;HCT:红细胞比容。
2名放射科医师评价之间的一致性较高,ICC值为0.92。如表2所示,SAP组与RAP组间的平均T1pre pancreas、T1post pancreas及PER参数的差异均不具有统计学意义。RAP组的ECV值(0.41±0.10)高于SAP组(0.35±0.20) (图2),且其差异具有统计学意义。当ECV值大于0.38时,诊断RAP的准确度为0.72 (图3)。与正常组相比,AP组的T1pre pancreas、T1post pancreas、PER及ECV值均明显升高(P<0.05) (图4)。当利用T1pre pancreas>915.8 ms、PER>0.518及ECV>0.327指标分别独立诊断AP时,其受试者工作特征(receiver operating characteristic,ROC)曲线下面积分别为0.96、0.94及0.89 (表3)。
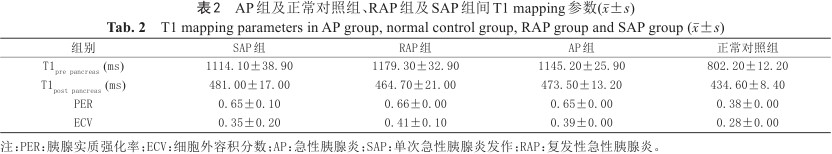
AP组及正常对照组、RAP组及SAP组间T1 mapping参数(±s)
T1 mapping parameters in AP group, normal control group, RAP group and SAP group (±s)
AP组及正常对照组、RAP组及SAP组间T1 mapping参数(±s)
T1 mapping parameters in AP group, normal control group, RAP group and SAP group (±s)
| 组别 | SAP组 | RAP组 | AP组 | 正常对照组 |
|---|---|---|---|---|
| T1pre pancreas (ms) | 1114.10±38.90 | 1179.30±32.90 | 1145.20±25.90 | 802.20±12.20 |
| T1post pancreas (ms) | 481.00±17.00 | 464.70±21.00 | 473.50±13.20 | 434.60±8.40 |
| PER | 0.65±0.10 | 0.66±0.00 | 0.65±0.00 | 0.38±0.00 |
| ECV | 0.35±0.20 | 0.41±0.10 | 0.39±0.00 | 0.28±0.00 |
注:PER:胰腺实质强化率;ECV:细胞外容积分数;AP:急性胰腺炎;SAP:单次急性胰腺炎发作;RAP:复发性急性胰腺炎。
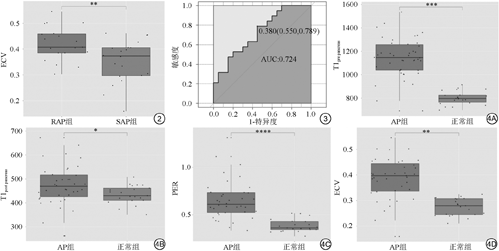


T1 mapping参数鉴别AP及RAP的效能
The diagnostic performance of T1 mapping parameters for identifying AP and RAP
T1 mapping参数鉴别AP及RAP的效能
The diagnostic performance of T1 mapping parameters for identifying AP and RAP
| T1mapping参数 | 最佳阈值 | AUC | P值 |
|---|---|---|---|
| SAP组与RAP组 | |||
T1pre pancreas (ms) | - | - | 0.21 |
T1post pancreas (ms) | - | - | 0.27 |
PER | - | - | 0.81 |
ECV | 0.382 | 0.72 | 0.01 |
| AP组与正常组 | |||
T1pre pancreas (ms) | 915.8 | 0.958 | <0.05 |
T1post pancreas (ms) | 478.2 | 0.675 | <0.05 |
PER | 0.518 | 0.937 | <0.05 |
ECV | 0.327 | 0.885 | <0.05 |
注:PER:胰腺实质强化率;ECV:细胞外容积分数;AP:急性胰腺炎;SAP:单次急性胰腺炎发作;RAP:复发性急性胰腺炎。
“复发性胰腺炎”的术语最初是在1948年的一篇文献中进行报道[12],迄今已经使用了70余年。近年来通过对胰腺炎症的机制进一步研究,有学者提出“初次AP发作-复发性胰腺炎-慢性胰腺炎”之间存在着连续性过程[13, 14]。当胰腺发生不可逆转地纤维化、腺泡细胞丢失等细胞水平的改变时,CP逐步确立。通过随访发现,CP患者胰腺癌的患病风险明显升高[15]。同时,RAP及CP患者由于反复发作性腹痛及腹痛相关症状导致生活质量明显减低,而胰腺炎症及胰腺内外分泌功能不全等也会导致各种并发症的出现,如消化吸收障碍、血糖水平异常、胰管结石等,增加了患者的住院率及精神经济负担[11,16]。因此,作为CP形成的前期环节,临床应给予RAP患者高度关注,在疾病早期诊断RAP并采取积极措施干预是十分有意义的。
MRI定量技术可以通过T1、T2弛豫时间的测量反映组织内部改变的信息,目前在胰腺的纤维化方面有较多研究。本研究通过分析SAP组及RAP组、AP组及RAP组间的T1 mapping参数,初步总结T1 mapping参数可用来鉴别AP及RAP。相对于正常胰腺实质,AP组的T1pre pancreas、T1post pancreas、PER及ECV值均为显著性升高。这一结果证实胰腺炎症或水肿能够增加胰腺组织的T1弛豫时间,与Zhu等[17]在自身免疫性胰腺炎中的发现一致。正常的胰腺实质相对其他腹部器官(如脾脏)在T1WI序列中表现为较高信号,是由于腺泡细胞中存在着大量的腺泡蛋白和粗面内质网,能够缩短T1弛豫时间[18]。当急性炎症发生时,大量的炎症细胞(淋巴细胞、浆细胞等)浸润实质,延长T1弛豫时间,信号减低[19]。当以T1pre pancreas>915.8 ms作为阈值诊断AP时,其准确度高达0.96。另外笔者认为,T1pre pancreas这一参数,对于鉴别小部分血清淀粉酶、脂肪酶指标升高未达到正常值三倍以上且影像学表现不典型的AP患者具有潜在应用价值[20, 21],有待于进一步的研究验证。
ECV作为另一重要的定量参数,通过注射细胞外对比剂前后的T1值计算获得。在以往研究中证实与心肌、肝脏及胰腺的纤维化具有良好的相关性[22, 23]。在本研究中,增强扫描前T1pre pancreas值在SAP组与RAP组间的差异不具有统计学意义,组间的增强扫描后T1post pancreas及PER值差异也不具有统计学意义;仅ECV参数可用来区分SAP与RAP (P<0.05)。
这种结果可能与RAP的病理学改变相关。“纤维化-坏死”假说认为在RAP反复发作过程中炎症和坏死促进了纤维化的形成,导致最终不可避免地发展为CP[14]。当纤维化组织取代了正常的腺泡组织,细胞外间隙中沉积的纤维组织增多,对比剂进入细胞外间隙的速度减慢,浓度减低,因此其缩短T1弛豫时间的效应减小[24, 25]。通过Tirkes等[25]的研究,ECV值可以反映胰腺纤维化及腺泡细胞丢失的发生及严重程度,这进一步支持本研究的结果。由于RAP建立在多次发作AP的基础上,其胰腺的形态大小并未发生明显变化,但内部间质成分随着炎症的累及、吸收等发生变化,体现在细胞水平。因此ECV值在SAP与RAP组间的差异具有统计学意义。
本研究尚存在几点局限性。第一,本研究是小样本量研究,SAP组及RAP组纳入病例数均较少,因此可能受纳入病例的年龄、发病时间及发病因素影响存在选择偏倚;第二,ECV参数对于鉴别SAP及RAP的效能为0.72,这可能与病例的选择、扫描时间的选择等有关,在下一步研究中我们将扩大病例数,进行验证。
综上所述,AP患者胰腺的T1 mapping参数较正常对照显著升高,其诊断效能较高;ECV参数可有效鉴别RAP与SAP。因此,利用T1 mapping成像可以提高RAP的早期诊断,进行早期干预,减低发病率。
全体作者均声明无利益冲突。



























