
评估肿瘤磁共振全域直方图分析鉴别子宫富于细胞平滑肌瘤(uterine cellular leiomyoma,UCL)和子宫肌瘤变性(degeneration of uterine leiomyoma,UL-D)的价值。
回顾性研究2016年3月至2021年4月经病理证实的48例子宫富于细胞平滑肌瘤和44例UL-D患者的影像和临床资料,术前均行1.5 T磁共振常规扫描和扩散加权成像(diffusion weighted imaging,DWI)扫描,2名医师利用MaZda软件在T2WI (T2 weighted imaging)及ADC图上独立勾画肿瘤感兴趣区(volume of interest,VOI),进行灰度图直方图分析,提取T2WI及ADC图灰度直方图参数,包括均值(mean)、方差(variance)、偏度(skewness)、峰度(kurtosis)、第1、10、50、90、99百分位数(Perc 1%、Perc 10%、Perc 50%、Perc 90%、Perc 99%)。采用组内相关系数(intra-class correlation coefficients,ICC)评价不同观察者判断的一致性,利用二元Logistic回归方法筛选参数以构建预测模型,利用ROC曲线分析评估单一参数及Logistic回归模型诊断效能。
组内ICC为0.844,两组间ADC直方图参数mean、variance、skewness、Perc 1%、Perc 10%、Perc 50%、Perc 90%、Perc 99%及T2WI直方图参数variance、kurtosis、Perc 1%有统计学意义(P<0.05),绘制其受试者工作特征(ROC)曲线,曲线下面积(AUC)分别为0.833、0.677、0.674、0.736、0.777、0.824、0.848、0.822及0.705、0.660、0.640。二元Logistic回归分析及ROC分析,T2WI、ADC、T2WI+ADC模型AUC分别为0.790、0.848、0.881,相对应约登指数分别为0.4830、0.6250、0.6288。ROC曲线两两比较,T2WI与ADC、(T2WI+ADC)与T2WI、(T2WI+ADC)与ADC的P值分别为0.3425、0.0394、0.2348。
肿瘤全域(T2WI、ADC)直方图定量参数值有助于子宫富于细胞平滑肌瘤与UL-D的鉴别诊断,联合T2WI+ADC模型具有最高的曲线下面积,但诊断效能不优于ADC参数。

富于细胞平滑肌瘤(uterine cellular leiomyoma,UCL)是良性子宫肌瘤(uterine leiomyoma,UL)中最常见的一种特殊亚型,其临床表现与普通型子宫平滑肌瘤无明显差异,但是部分病例有某些恶性潜能的临床表现,如生长迅速、容易复发等[1, 2],目前被界定为交界性肿瘤。分子遗传学研究表明UCL和平滑肌肉瘤可能具有共同的致病机制,甚至可能是同一疾病的不同阶段。因此,UL和UCL的临床治疗方案应有差别,术前对两者的鉴别诊断是必要的,尤其对于没有生育要求的较大年龄女性,可避免二次手术。术中快速冰冻病理对手术方式的选择有重要的指导意义,但因为冰冻切片操作时间短,且受取材范围、制片技术、细胞形态及诊断因素的限制,其准确性与常规石蜡切片检查结果有一定的差距。术前MRI检查是评估子宫肿瘤的主要方式,普通型肌瘤诊断容易,UCL在磁共振上也具有一定的特征[3],但子宫肌瘤变性(degeneration of uterine leiomyoma,UL-D)与UCL在影像征象上有较大重叠[4],由于人眼对图像的识别的局限性,UCL与UL-D伴变性的鉴别仍有困难,因此,本研究基于直方图分析,探索肿瘤MR全域直方图量化参数对UCL和UL-D的鉴别诊断价值。
本研究为回顾性研究,经福建省妇幼保健院伦理委员会审批通过(2019伦理审批第054号),免除受试者知情同意。最终纳入福建省妇幼保健院2016年3月至2021年4月经病理确诊的子宫UCL48例以及44例肌瘤伴变性者作为对照组,所有病例术前都有完整的临床、影像资料。UCL组按照以下纳入标准筛选入组:(1)术前因盆腔肿块在本院行常规MRI检查,包括T1WI (T1 weighted imaging)、T2WI (T2 weighted imaging)、扩散加权成像(diffusion weighted imaging,DWI),图像资料清晰、完整,MRI图像清晰,无伪影等影响图像进一步分析的质量缺陷;(2)手术在磁共振检查后2周内完成,术后病理诊断为UCL。对照组UL-D纳入标准:(1)选取同期因术前怀疑子宫肌瘤在本院行常规MRI检查,图像资料清晰、完整、无伪影,T2WI显示病变呈高信号的患者;(2)手术在磁共振检查后2周内完成,术后病理诊断为UL-D。
MR扫描采用GE Signa 1.5 T超导型MR扫描仪,体部8通道线控阵线圈。扫描序列包括:快速恢复快速自旋回波脂肪抑制T2WI序列:重复时间TR (repetition time) 6666 ms,回波时间TE (echo time) 88 ms;快速自旋回波(fast spin echo,FSE) T1WI序列:TR 220 ms,TE 8 ms;矩阵320×224,视野(field of view,FOV) 40 cm×40 cm;DWI采用平面回波成像(echo planar imaging,EPI)序列:TR 5600 ms,TE 80 ms,b值=0、800 s/mm2,矩阵128×128,FOV 32 cm×32 cm。各扫描序列层厚均为6 mm,层间距1 mm。
将符合条件的DWI原始图像传到MRI后处理工作站,用其Function软件(版本ADW 4.6)对DWI图像行后处理,得到病灶的ADC灰度图,将ADC图以及T2WI、DWI图像以BMP格式刻录光盘,同时调整窗宽、窗位,保证窗宽、窗位一致,然后导入工作电脑,进行直方图分析。
采用MaZda软件(开源性软件,版本4.6.2.0,http://www.eletel.p.lodz.pl/mazda/)[5, 6],为了最小化图像对比度和亮度对特征的影响,首先对导入图像一定范围内进行校正(µ-3δ,µ+3δ:µ,平均灰度值;δ,标准偏差),2名医师(妇科肿瘤影像诊断工作时间大于10年,并且不知晓最终病理结果)分别独立在T2WI、ADC的2D图像界面上人工勾画ROI,在MaZda 3D界面上自动叠加生成病灶VOI,由软件进行直方图分析,得出肿瘤T2WI、ADC全域直方图参数:均值(mean)、变异度(variance)、峰度(skewness)、偏度(kurtosis)、第1、10、50、90、99百分位数(Perc 1%、Perc 10%、Perc 50%、Perc 90%、Perc 99%)。
统计分析采用SPSS 24.0 (IBM公司)和MedCalc (版本19.1.7)。使用组内相关系数(intra-class correlation coefficients,ICC)来评价不同测量者间的数据可信度,判断如下:良好(ICC>0.80),较好(ICC=0.61~0.80),中等(ICC=0.41~0.60),较差(ICC<0.40)。计量资料先检验数据是否服从正态分布,采用Shapiro-Wilk正态性检验。服从正态分布的数据采用均数±标准差(±s)表示,采用两独立样本t检验,不服从正态分布的数据用M (95% CI)表示,采用Mann-Whitney U检验,筛选出两组间有差异性的参数。将如上有差异的参数纳入二元Logistic回归,采用Forward LR进入方式,最终筛选出3个变量进入方程。利用二元Logistic回归分析时生成的预测概率生成ROC曲线评估ADC、T2WI以及ADC+T2WI的Logistic回归模型诊断效能。分析单变量及多变量MR参数的诊断效能,采用曲线下面积(AUC)评估最佳的预测模型,AUC的显著性检验评价采用Delong检验(MedCalc)。P<0.05为差异有统计学意义。
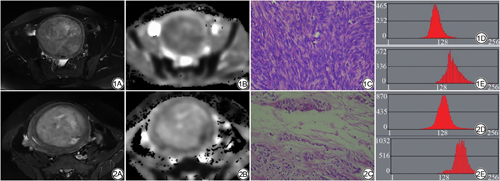
子宫UCL和UL-DT2WI均为高信号,境界清楚,ADC图呈低信号或高信号(图1,2)。2名医师独立勾画VOI,测得组内ICC为0.844。ADC直方图参数分析:UCL组mean、Perc 1%、Perc 10%、Perc 50%、Perc 90%、Perc 99%值低于UL组,variance、skewness值高于UL-D组(P<0.05)。T2WI直方图参数分析:UCL组variance、kurtosis低于UL-D组,Perc 1%值高于UL-D组(P<0.05)。

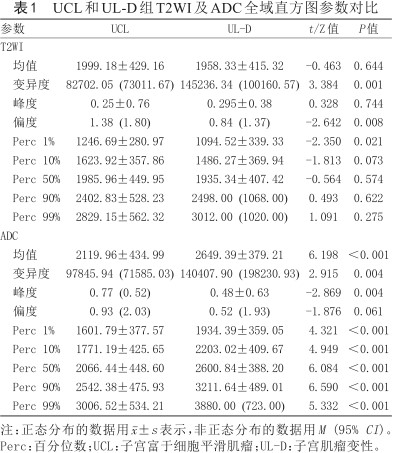
UCL和UL-D组T2WI及ADC全域直方图参数对比
UCL和UL-D组T2WI及ADC全域直方图参数对比
| 参数 | UCL | UL-D | t/Z值 | P值 |
|---|---|---|---|---|
| T2WI | ||||
均值 | 1999.18±429.16 | 1958.33±415.32 | -0.463 | 0.644 |
变异度 | 82702.05 (73011.67) | 145236.34 (100160.57) | 3.384 | 0.001 |
峰度 | 0.25±0.76 | 0.295±0.38 | 0.328 | 0.744 |
偏度 | 1.38 (1.80) | 0.84 (1.37) | -2.642 | 0.008 |
Perc 1% | 1246.69±280.97 | 1094.52±339.33 | -2.350 | 0.021 |
Perc 10% | 1623.92±357.86 | 1486.27±369.94 | -1.813 | 0.073 |
Perc 50% | 1985.96±449.95 | 1935.34±407.42 | -0.564 | 0.574 |
Perc 90% | 2402.83±528.23 | 2498.00 (1068.00) | 0.493 | 0.622 |
Perc 99% | 2829.15±562.32 | 3012.00 (1020.00) | 1.091 | 0.275 |
| ADC | ||||
均值 | 2119.96±434.99 | 2649.39±379.21 | 6.198 | <0.001 |
变异度 | 97845.94 (71585.03) | 140407.90 (198230.93) | 2.915 | 0.004 |
峰度 | 0.77 (0.52) | 0.48±0.63 | -2.869 | 0.004 |
偏度 | 0.93 (2.03) | 0.52 (1.93) | -1.876 | 0.061 |
Perc 1% | 1601.79±377.57 | 1934.39±359.05 | 4.321 | <0.001 |
Perc 10% | 1771.19±425.65 | 2203.02±409.67 | 4.949 | <0.001 |
Perc 50% | 2066.44±448.60 | 2600.84±388.20 | 6.084 | <0.001 |
Perc 90% | 2542.38±475.93 | 3211.64±489.01 | 6.590 | <0.001 |
Perc 99% | 3006.52±534.21 | 3880.00 (723.00) | 5.332 | <0.001 |
注:正态分布的数据用±s表示,非正态分布的数据用M (95% CI)。Perc:百分位数;UCL:子宫富于细胞平滑肌瘤;UL-D:子宫肌瘤变性。
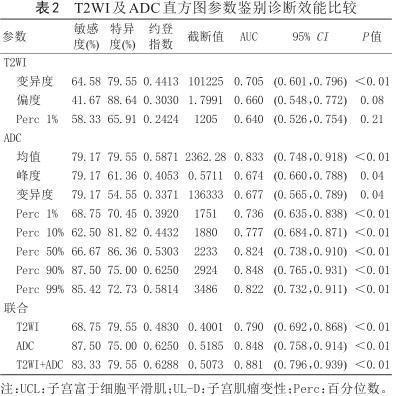
T2WI及ADC直方图参数鉴别诊断效能比较
T2WI及ADC直方图参数鉴别诊断效能比较
| 参数 | 敏感度(%) | 特异度(%) | 约登指数 | 截断值 | AUC | 95% CI | P值 |
|---|---|---|---|---|---|---|---|
| T2WI | |||||||
变异度 | 64.58 | 79.55 | 0.4413 | 101225 | 0.705 | (0.601,0.796) | <0.01 |
偏度 | 41.67 | 88.64 | 0.3030 | 1.7991 | 0.660 | (0.548,0.772) | 0.08 |
Perc 1% | 58.33 | 65.91 | 0.2424 | 1205 | 0.640 | (0.526,0.754) | 0.21 |
| ADC | |||||||
均值 | 79.17 | 79.55 | 0.5871 | 2362.28 | 0.833 | (0.748,0.918) | <0.01 |
峰度 | 79.17 | 61.36 | 0.4053 | 0.5711 | 0.674 | (0.660,0.788) | 0.04 |
变异度 | 79.17 | 54.55 | 0.3371 | 136333 | 0.677 | (0.565,0.789) | 0.04 |
Perc 1% | 68.75 | 70.45 | 0.3920 | 1751 | 0.736 | (0.635,0.838) | <0.01 |
Perc 10% | 62.50 | 81.82 | 0.4432 | 1880 | 0.777 | (0.684,0.871) | <0.01 |
Perc 50% | 66.67 | 86.36 | 0.5303 | 2233 | 0.824 | (0.738,0.910) | <0.01 |
Perc 90% | 87.50 | 75.00 | 0.6250 | 2924 | 0.848 | (0.765,0.931) | <0.01 |
Perc 99% | 85.42 | 72.73 | 0.5814 | 3486 | 0.822 | (0.732,0.911) | <0.01 |
| 联合 | |||||||
T2WI | 68.75 | 79.55 | 0.4830 | 0.4001 | 0.790 | (0.692,0.868) | <0.01 |
ADC | 87.50 | 75.00 | 0.6250 | 0.5185 | 0.848 | (0.758,0.914) | <0.01 |
T2WI+ADC | 83.33 | 79.55 | 0.6288 | 0.5073 | 0.881 | (0.796,0.939) | <0.01 |
注:UCL:子宫富于细胞平滑肌;UL-D:子宫肌瘤变性;Perc:百分位数。
单个参数中,ADC直方图参数mean、Perc 50%、Perc 90%、Perc 99%具有较高的曲线下面积(>0.80)。多参数Logistic回归模型(ADC、T2WI+ADC) AUC高于单个参数(图3),AUC分别为0.848、0.881。
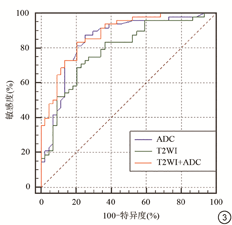

采用Delong检验,T2WI+ADC模型诊断效能优于T2WI模型(P<0.05),T2WI+ADC模型与ADC模型差异没有统计学意义(P>0.05)、ADC和T2WI模型差异没有统计学意义(P>0.05)。
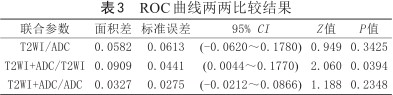
ROC曲线两两比较结果
ROC曲线两两比较结果
| 联合参数 | 面积差 | 标准误差 | 95% CI | Z值 | P值 |
|---|---|---|---|---|---|
| T2WI/ADC | 0.0582 | 0.0613 | (-0.0620~0.1780) | 0.949 | 0.3425 |
| T2WI+ADC/T2WI | 0.0909 | 0.0441 | (0.0044~0.1770) | 2.060 | 0.0394 |
| T2WI+ADC/ADC | 0.0327 | 0.0275 | (-0.0212~0.0866) | 1.188 | 0.2348 |
本研究采用直方图分析,研究结果表明磁共振T2WI及ADC图的直方图特征对子宫UCL和UL-D的鉴别诊断具有临床应用价值。在常规MR,典型的子宫肌瘤具有特征性表现,不典型肌瘤的MRI表现各异[7],UCL与UL-D在T2WI上均表现为不同程度的高信号,两者在MRI征象上具有较大的重叠[8],王霞等[3]报道UCL具有一定的特征性,但依靠人眼观察的征象具有较大的主观性,不同观察者间差异较大,有研究根据肿瘤边界、内部结构等征象鉴别UCL,但特异性较低[8],同样UCL和UL-D在增强图像上均表现为明显强化[9],因此根据人眼对图像的识别,术前很难鉴别。术中冰冻病理结果的准确性与常规石蜡切片检查结果仍有一定的差距[10]。高强度聚焦超声(high intensity focused ultrasound,HIFU)是利用超声波的可聚焦性和能量可透入性,从体外将低能量的超声波聚集于体内病灶,引起瞬态高温效应后,使受损组织出现凝固性坏死,是子宫肌瘤手术治疗之外的又一选择[11],而富于细胞肌瘤对HIFU治疗效果差[12],一般以手术治疗为主,同时UCL与子宫肉瘤有诸多相似征象[13],因此无论从诊断还是治疗上,有必要术前对UCL和UL-D进行鉴别[14]。本研究采用MaZda纹理分析软件分析影像灰度图片,提取了3D肿瘤全域直方图特征包括,包括表征图像平均灰度的平均值、表征图像平均灰度分布离散程度的方差、表征像素灰度主体集中位置的偏度以及衡量直方峰值的峰度等特征,以精确量化的方法,避免了人眼对图像识别的局限性。以往的研究中通常采取代表性的层面作为ROI进行分析[15],容易存在抽样误差,且不能完整地反映整个肿瘤的整体情况,本研究采用全域直方图分析,更具有客观性,能全面地反映肿瘤内部的异质性。
UCL病理特点为肿瘤中有丰富的平滑肌细胞,瘤细胞分布密集,细胞密度远大于正常肌层组织,同时细胞核较大,呈梭形或卵圆形,排列紧密,而胞质减少,同时肿瘤间质充分也较少[9, 10],而UL-D瘤细胞成分较少,而以间质成分为著,变性瘤体间质水肿明显,肌纤维出现退变,间质为透明样物质取代[7],两者的病理基础差异,为磁共振直方图量化分析鉴别两者提供了可能性。本研究病例组中,子宫UCL组和肌瘤变性组的病灶边界都清晰,无论是T2WI及ADC图像,都能清晰勾勒,本研究采用MaZda软件勾画VOI,操作简便,可重复性高,不同医师勾画的分析参数,其组内相关系数ICC达到了0.844,因此方法容易推广。在单个参数分析中,UCL组ADC参数值性mean、Perc 1%、Perc 10%、Perc 50%、Perc 90%、Perc 99%均低于UL-D组。ADC直方图参数中的低百分位数主要反映肿瘤细胞的密集程度间的差异,与肿瘤侵袭性有关[16],而高百分位数与肿瘤内坏死、纤维化及微血管性等因素相关[17],本组参数特征表明UCL较UL-D相比具有更大的细胞密集程度,细胞外间隙较小,水分子扩散受限,符合子宫UCL细胞丰富、间质少的病理特征[18]。同时,本研究中UCL组ADC高百分位参数低于UL-D组,表明UL-D组较UCL组更容易发生囊变、坏死,导致直方图参数中高百分位数值增高。同样在T2WI直方图参数中,UL-D方差值(variance)以及kurtosis高于UCL组,表明UL-D瘤体具有更大的异质性,亦与UL-D囊变、坏死导致信号局限性增高、图像信号更加混杂相关。如上表明肌瘤伴变性肿瘤内部具有较大的异质性,而富于细胞肿瘤内部具有较大的同质性。本研究结果与Valdes-Devesa等[15]的结果一致,与Gerges等[19]的研究结果略有差异,后者发现T2WI直方图参数对鉴别子宫肉瘤和UL-D有较大的效能,可能是由于该研究纳入的病例组是普通型的子宫肌瘤,在T2WI以低信号为主,与本研究纳入的T2WI为高信号的子宫肌瘤不同有关。
全域直方图分析参数中,ADC单个参数mean、Perc 50%、Perc 90%、Perc 99%具有较高的诊断效能(AUC>0.8),而采用Logistic回归分析,T2WI模型的AUC为0.790,诊断效能低于ADC参数,ADC模型的AUC为0.848,高于单个参数,ADC直方图的诊断价值在鳞癌[20]以及腹盆部肿瘤定性、分级、预后判断[21, 22]等方面同样具有价值,目前尚未见ADC用于鉴别UCL和UL-D的研究。本研究联合T2WI及ADC参数,筛选的三个参数进入方程,包括ADC图的Perc 90%、T2WI的variance以及kurtosis建立的模型,其AUC为0.881,与ADC模型相比,并没有模型上的优势(P=0.2348),而联合参数的增多,可能导致模型过拟合,影响模型临床应用的诊断效能及外推性,因此在本研究中,单个参数的诊断效能不输于多参数模型,尤其是高百分位参数ADC值,对两者具有鉴别诊断意义,而在临床中更容易推广。
首先,本研究为回顾性初步研究,未做前瞻性设计,部分参数图像未在研究范围内,如增强T1WI图像,肿瘤的灌注情况将在下一步开展的前瞻性研究中实现。其次,本研究仅分析了T2WI及ADC图的直方图参数,直方图参数为统计学的一阶统计量,不能完全反映VOI的空间特征及肿瘤内部空间的结构变化,具有一定局限性,更多图像特征的纹理特征值有待提取、筛选,将在下一步继续研究。再者,本研究未做外部验证,今后继续加大样本量建立测试组及验证组,以提高统计效能以及外推性。
肿瘤全域直方图分析有助于鉴别子宫UCL和肌瘤变性,ADC直方图参数具有较高的诊断效能,T2WI联合ADC具有更大的曲线下面积,但诊断效能并不优于单个参数。
感谢福州榕城海关综合技术服务中心的曾志昌对本文数据统计分析的设计和审查提供的帮助。
全体作者均声明无利益冲突。



























