
探讨高b值(1000 s/mm2)及超高b值(2000 s/mm2)的弥散加权成像(diffusion weighted imaging,DWI)及表观弥散系数(apparent diffusion coefficient,ADC)对外周带前列腺良恶性病变的诊断效能。
回顾性分析2015年1月至2016年5月在宁夏医科大学总医院放射科行前列腺常规磁共振检查及超高b值DWI成像的64例患者的临床及影像学资料;两名医师根据前列腺影像报告和数据系统第二版(Prostate Imaging Reporting and Data System Version 2.0,PI-RADS V2)并采用双盲法在T2WI和DWI上用五分制对图像进行评估;采用三维感兴趣区法逐层勾画病灶,并对ADC值行直方图分析。
(1)对前列腺癌灶的诊断方面,超高b值(2000 s/mm2)获得的DWI图像的敏感度明显高于高b值(1000 s/mm2) (P<0.001);(2)直方图参数ADC第10百分位数(ADC10)的诊断效能最高,受试者操作特征(receiver operating characteristic,ROC)曲线下面积超高b值与高b值分别为0.902 [95%CI (0.802~0.962)]和0.823 [95% CI (0.707~0.907)],但超高b值与高b值ADC值诊断效能的差异无统计学意义(P>0.05)。
超高b值与高b值所对应的ADC值直方图对外周带前列腺癌的诊断效能相似,而在b值为2000 s/mm2时,DWI图像的敏感度高于1000 s/mm2。因此,超高b值DWI有助于提高对外周带前列腺癌的诊断价值。

本刊刊出的所有论文不代表本刊编委会的观点,除非特别声明
前列腺癌在全球范围内男性常见癌症中发病率居第二[1],随着人口增长、老龄化进程的不断发展、生活习惯及饮食结构的改变,我国前列腺癌的发病率仍在不断地上升[2],成为危害老年男性生命健康的重要疾病。多参数磁共振成像(multiparametric magnetic resonance imaging,mpMRI)是目前公认的前列腺的最佳检查方法[3, 4],弥散加权成像(diffusion weighted imaging,DWI)是其关键组成部分,可反映组织中水分子弥散状态、细胞膜的完整性[5],通过测定癌灶表观弥散系数(apparent diffusion coefficient,ADC)值定性和定量评估前列腺癌(prostate cancer,PCa)侵袭程度[6],从而指导临床治疗方案、预测疾病进展,被广泛应用于临床。但最佳b值仍然存在较多争议,与身体其他部位的绝大多数恶性肿瘤不同的是,前列腺癌较其背景组织呈T2WI低信号,而正常前列腺组织的信号较高,在高b值DWI图像上常常不受抑制呈等信号或稍高信号,因此前列腺癌灶可能会被正常的前列腺组织或良性病灶所掩盖,这种现象被称为“反向T2穿透效应”[7]。而超高b值提供了更强的弥散加权和对良性前列腺组织的抑制,从而增加了肿瘤-背景组织的对比度,但这些增益可能会被降低的信噪比以及增加的易感性伪影和图像失真所抵消[8,9]。我们研究的目的是回顾性地比较b值为1000 s/mm2和2000 s/mm2时所获得的DWI图和ADC值的肿瘤检测效能。此外,必须认识到传统的单层面感兴趣区测量法有较多缺陷,如不同研究者放置感兴趣区(region of interest,ROI)的差异、不能精确评估整个肿瘤的生物学特性,而直方图分析可以反映整个肿瘤内部的弥散特性。因此,本研究通过定性和定量的方法,探讨超高b值DWI鉴别前列腺良恶性病变的诊断效能。
本研究经过宁夏医科大学总医院医学科研伦理审查委员会批准(批准文号:2018-339),免除受试者知情同意。回顾性分析2015年1月至2016年5月在宁夏医科大学总医院放射科行常规磁共振检查及超高b值DWI成像的178例患者的临床及影像学资料。纳入标准:(1) MRI图像上前列腺外周带有明显的病灶(病灶直径≥0.5 cm);(2)经病理学证实,并与MR图像匹配在同一区域;(3)超声引导下前列腺穿刺或根治手术于MRI检查后一个月内进行。排除标准:(1)图像质量不佳;(2)临床资料不完整。
所有患者均使用美国GE Signa HDxt 3.0 T MR磁共振扫描仪,以体线圈为射频发射线圈,32通道心脏相控阵线圈为接收线圈,扫描中心置于耻骨联合上5 cm处,扫描范围包括前列腺、精囊腺及双侧髂血管。扫描前嘱受试者适度充盈膀胱,取仰卧位,平静呼吸,扫描时戴上耳塞以减少不适。
常规扫描序列包括轴位T1WI、三方位T2WI、轴位T2WI-FS,扫描参数如下:T1WI (TE 7 ms, TR 520 ms,矩阵416×192,FOV 360×360,层厚/层间距4 mm/0.5 mm);T2WI (TE 72 ms,TR 2500 ms, 矩阵128×128,FOV 360×360,层厚/层间距4 mm/0.5 mm);T2WI-FS (TE 120 ms,TR 4500 ms,矩阵288×224,FOV 360×360,层厚/层间距4 mm/0.5 mm)。DWI扫描参数如下:TE 72 ms,TR 5000 ms,矩阵128×128,FOV 360×360,层厚/层间距4 mm/0.5 mm,b值分别为0、1000、2000 s/mm2,激励次数4,10。
扫描完成后, 笔者将所有入组患者的T2WI及DWI (b=1000 s/mm2,A组;b=2000 s/mm2,B组)图像传至工作站,由另外两名放射科医师(分别有3年和8年前列腺影像诊断经验)采用双盲法分别对两组图像进行2次独立阅片(仅在T2WI上识别的病灶被排除),两次间隔时间为2周。为了最大限度地减少回忆偏倚,对所有病例进行匿名编码并按不同顺序进行审阅。根据前列腺影像报告和数据系统第二版(Prostate Imaging Reporting and Data System Version 2.0,PI-RADS V2)[10]将评分>3分的区域视为癌灶阳性,评分≤3分的区域视为癌灶阴性。当有多个病灶时,选择评分最高的病灶,评分相同时选择病灶最大者。每例患者最多选取一个病灶。
笔者将入组患者的T2WI和DWI (b=1000、2000 s/mm2)原始图像转换为医学数字成像和通信(Digital Imaging and Communications in Medicine,DICOM)格式并传入计算机辅助诊断平台Firevoxel,根据三维感兴趣区法及详细的病理结果勾画病灶区。当有多个病灶时,选择Gleason评分最高的病灶,评分相同时选择病灶最大者。鉴于整体病灶ROI对于异质性分析的重要性,ROI的勾画应包含肿瘤内部的出血、坏死、囊变及钙化等,但同时应避开尿道、射精管及精囊腺等。Firevoxel生成整个肿瘤容积重建,获得ADC值直方图参数:平均值(ADCmean)、中位数(ADCmedian)、最小值(ADCmin)、第10百分位数(ADC10)、第90百分位数(ADC90)、峰度、偏度及异质性。
采用SPSS 22.0对计数资料行χ²检验,通过Kappa检验分析评价两名医师采用两组方法诊断前列腺癌的一致性。对计量参数进行方差齐性检验,如符合正态分布,行两独立样本t检验;如不符合正态分布,则行非参数检验,P<0.05表明差异有统计学意义。然后,采用Medcalc对有统计学差异的参数进行ROC曲线分析,采用Z检验比较各参数的ROC曲线下面积。P<0.05表明差异有统计学意义。
最终64名患者纳入本研究,年龄范围60~78岁,平均年龄67.3岁。其中前列腺癌患者34例,平均前列腺特异抗原(prostate specific antigen,PSA)水平为16.8 ng/mL,范围4.1~100.0 ng/mL;前列腺良性疾病(增生或炎症) 30例,平均PSA水平为3.7 ng/mL,范围0.4~37.6 ng/mL。
表1为两名医师采用A、B两组方案对前列腺癌的诊断效能的比较。两名医师采用方案B对前列腺癌的诊断敏感度、阴性预测值(negative predictive value,NPV)、诊断符合率及ROC曲线下面积(area under the ROC curve,AUC)的测量值均高于方案A,差异有统计学意义(P<0.05)。医师1与医师2对于两方案诊断前列腺癌的一致性较好,Kappa值分别为0.59、0.68。
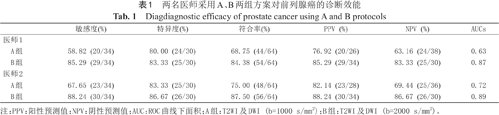
两名医师采用A、B两组方案对前列腺癌的诊断效能
Diagdiagnostic efficacy of prostate cancer using A and B protocols
两名医师采用A、B两组方案对前列腺癌的诊断效能
Diagdiagnostic efficacy of prostate cancer using A and B protocols
| 敏感度(%) | 特异度(%) | 符合率(%) | PPV (%) | NPV (%) | AUCs | |
|---|---|---|---|---|---|---|
| 医师1 | ||||||
A组 | 58.82 (20/34) | 80.00 (24/30) | 68.75 (44/64) | 76.92 (20/26) | 63.16 (24/38) | 0.63 |
B组 | 85.29 (29/34) | 83.33 (25/30) | 84.38 (54/64) | 85.29 (29/34) | 83.33 (25/30) | 0.87 |
| 医师2 | ||||||
A组 | 67.65 (23/34) | 83.33 (25/30) | 75.00 (48/64) | 82.14 (23/28) | 69.44 (25/36) | 0.72 |
B组 | 88.24 (30/34) | 86.67 (26/30) | 87.50 (56/64) | 88.24 (30/34) | 86.67 (26/30) | 0.89 |
注:PPV:阳性预测值;NPV:阴性预测值;AUC:ROC曲线下面积;A组:T2WI及DWI (b=1000 s/mm2);B组:T2WI及DWI (b=2000 s/mm2)。
病例组与对照组间DWI直方图各参数的差异见表2、图1、图2。高b值DWI各参数除ADCmin、峰度值及偏度值外病例组与对照组间差异均有统计学意义;超高b值DWI各参数除异质性及偏度值外两组间差异均有统计学意义。

病例组与对照组DWI定量直方图各参数结果
Results of each parameter of the DWI quantitative histogram for the case and control groups
病例组与对照组DWI定量直方图各参数结果
Results of each parameter of the DWI quantitative histogram for the case and control groups
| 直方图参数 | 对照组 | 病例组 | P值 |
|---|---|---|---|
| b值=1000 s/mm2 | |||
ADCmin (×10-3 mm2/s) | 0.596±0.141 | 0.538±0.134 | 0.060 |
ADCmax (×10-3 mm2/s) | 1.846±0.294 | 1.600±0.289 | 0.001 |
ADCmedian (×10-3 mm2/s) | 1.215 (1.031,1.300) | 0.892±0.192 | <0.001 |
ADCmean (×10-3 mm2/s) | 1.238 (1.025,1.309) | 0.877 (0.792,1.036) | <0.001 |
ADC10 (×10-3 mm2/s) | 0.899±0.175 | 0.682±0.148 | <0.001 |
ADC90 (×10-3 mm2/s) | 1.503 (1.359,1.581) | 1.148±0.281 | <0.001 |
inhomogeneity | 0.157±0.005 | 0.189±0.060 | 0.039 |
skewness | 0.411±0.059 | 0.610 (0.330,1.100) | 0.210 |
kurtosis | 0.210 (-0.081,0.788) | 0.293 (-0.032,1.855) | 0.802 |
| b值=2000 s/mm2 | |||
ADCmin (×10-3 mm2/s) | 0.545 (0.421,0.597) | 0.416±0.115 | 0.024 |
ADCmax (×10-3 mm2/s) | 1.484±0.233 | 1.267±0.279 | 0.001 |
ADCmedian (×10-3 mm2/s) | 1.005 (0.907,1.071) | 0.771±0.168 | <0.001 |
ADCmean (×10-3 mm2/s) | 1.151±0.114 | 0.740±0.181 | <0.001 |
ADC10 (×10-3 mm2/s) | 0.791±0.142 | 0.526±0.094 | <0.001 |
ADC90 (×10-3 mm2/s) | 1.168±0.197 | 0.954±0.187 | <0.001 |
inhomogeneity | 0.143 (0.132,0.173) | 0.142 (0.131,0.181) | 0.988 |
skewness | 0.391 (0.130,0.585) | 0.506 (0.336,0.874) | 0.452 |
kurtosis | 0.157 (-0.205,0.909) | 0.451 (-0.149,1.519) | 0.041 |
注:ADCmean:ADC平均值;ADCmedian:ADC中位数;ADCmin:ADC最小值;ADCmax:ADC最大值;ADC10:ADC第10百分位数;ADC90:ADC第90百分位数;kurtosis:峰度;skewness:偏度;inhomogeneity:异质性。

超高b值和高b值直方图参数鉴别前列腺良恶性病变的诊断效能见表3。高b值DWI各参数中ADC10诊断效能最高(0.823),ADCmean、ADCmedian及ADC90诊断效能也较高,分别为0.814、0.812及0.810;超高b值ADC各参数中同样是ADC10诊断效能最高(0.902),其次为ADCmedian (0.851)、ADCmean (0.850),均超过高b值DWI直方图各参数值,但超高b值与高b值ADC值诊断效能的差异无统计学意义(P>0.05)。
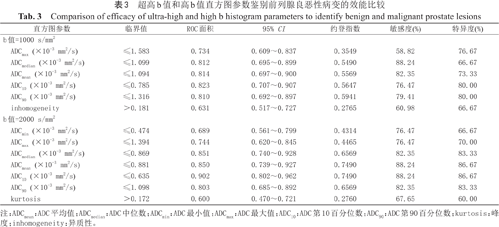
超高b值和高b值直方图参数鉴别前列腺良恶性病变的效能比较
Comparison of efficacy of ultra-high and high b histogram parameters to identify benign and malignant prostate lesions
超高b值和高b值直方图参数鉴别前列腺良恶性病变的效能比较
Comparison of efficacy of ultra-high and high b histogram parameters to identify benign and malignant prostate lesions
| 直方图参数 | 临界值 | ROC面积 | 95% CI | 约登指数 | 敏感度(%) | 特异度(%) |
|---|---|---|---|---|---|---|
| b值=1000 s/mm2 | ||||||
ADCmax (×10-3 mm2/s) | ≤1.583 | 0.734 | 0.609~0.837 | 0.3549 | 58.82 | 76.67 |
ADCmedian (×10-3 mm2/s) | ≤1.099 | 0.812 | 0.695~0.899 | 0.5490 | 88.24 | 66.67 |
ADCmean (×10-3 mm2/s) | ≤1.094 | 0.814 | 0.697~0.900 | 0.5569 | 82.35 | 73.33 |
ADC10 (×10-3 mm2/s) | ≤0.785 | 0.823 | 0.707~0.907 | 0.5647 | 76.47 | 80.00 |
ADC90 (×10-3 mm2/s) | ≤1.316 | 0.810 | 0.692~0.897 | 0.5941 | 79.41 | 80.00 |
inhomogeneity | >0.181 | 0.631 | 0.517~0.727 | 0.2765 | 60.98 | 66.67 |
| b值=2000 s/mm2 | ||||||
ADCmin (×10-3 mm2/s) | ≤0.474 | 0.689 | 0.561~0.799 | 0.4314 | 76.47 | 66.67 |
ADCmax (×10-3 mm2/s) | ≤1.394 | 0.744 | 0.620~0.845 | 0.4465 | 76.47 | 70.00 |
ADCmedian (×10-3 mm2/s) | ≤0.869 | 0.851 | 0.740~0.928 | 0.6569 | 82.35 | 83.33 |
ADCmean (×10-3 mm2/s) | ≤0.881 | 0.850 | 0.739~0.927 | 0.7490 | 88.24 | 86.67 |
ADC10 (×10-3 mm2/s) | ≤0.635 | 0.902 | 0.802~0.962 | 0.7490 | 88.24 | 86.67 |
ADC90 (×10-3 mm2/s) | ≤1.098 | 0.803 | 0.685~0.892 | 0.6569 | 82.35 | 83.33 |
kurtosis | >0.172 | 0.600 | 0.470~0.721 | 0.2760 | 67.65 | 60.00 |
注:ADCmean:ADC平均值;ADCmedian:ADC中位数;ADCmin:ADC最小值;ADCmax:ADC最大值;ADC10:ADC第10百分位数;ADC90:ADC第90百分位数;kurtosis:峰度;inhomogeneity:异质性。
本研究首先定性分析比较超高b值及高b值DWI图对外周带前列腺癌的诊断效能,再对其所对应的ADC值进行直方图定量分析。结果显示b值=2000 s/mm2的DWI图对肿瘤的敏感度明显比b值=1000 s/mm2的DWI图高(P<0.05),但两者所对应的ADC值诊断效能相似(P>0.05)。我们的研究结果可以部分解释之前研究得出的不同结论,b值的选择会以不同的方式影响获取的DWI及ADC,之前的大部分研究[8, 9, 10, 11, 12, 13, 14]主要是对其中的一个(DWI图、ADC图及ADC值)进行评价,所以会得出相互矛盾的结论。
本研究与Kim等[12]、Koo等[13]的研究有着较大差别,他们评估了两个b值(1000和2000 s/mm2)对应的ADC值及ADC图对前列腺癌的诊断性能的影响,我们则在此基础上另外评估了两个b值的DWI图像及其与常规MR图像组合的诊断效能。Kim等[12]对两个不同b值(1000和2000 s/mm2)导出的ADC值进行定量分析,结果显示在b值为1000和2000 s/mm2的肿瘤区域的平均ADC值均低于良性前列腺组织(P<0.001),两者诊断性能相似,与本研究结果一致,可能是因为ADC图是对数信号衰减曲线的陡度在至少两次单独采集的递增b值上的逐像素计算,与单一b值轨迹图像相比,更容易受到运动和其他伪影的影响。一项研究表明[14],当b值从1000 s/mm2增加到2000 s/mm2时,恶性组织内的平均信噪比下降了21.6%,DWI图像严重失真,恶性组织与正常组织之间有一定的ADC值重叠。因此,与高b值(1000 s/mm2)获得的ADC值相比,使用超高b值(2000 s/mm2)获得的ADC值对于鉴别前列腺良、恶性病变并没有额外的提高。
本研究结果与Rosenkrantz等[8]的研究结果有一定的一致性。他们的研究方案对b值=1000和2000 s/mm2的DWI和ADC图进行定性分析,并由两名放射科医生对数据集进行独立评估,使用从不同b值得到的ADC图检测主要肿瘤病变的敏感度没有发现差异,而使用b值=2000 s/mm2时DWI图像检测肿瘤的敏感度明显高于b值为1000 s/mm2。此外,基于肿瘤与背景组织对比度的定量分析,在b值为2000 s/mm2时,DWI图的对比度明显高于b值为1000 s/mm2时;而ADC图的肿瘤与周围区域对比显示两者之间没有明显差异。Metens等[11]定量分析了DWI图的病灶组织的可见性(对比度、噪声比),发现与b值为1000 s/mm2相比,使用b值为2000 s/mm2的DWI图增加了前列腺癌病灶和背景组织之间的对比度,从而提高了肿瘤检测的敏感度。以上结果表明,在前列腺癌中,当磁共振扫描仪具有足够的梯度性能和低噪声系数时,DWI应采用超高b值,以使DWI图像具有足够的对比度,从而提高肿瘤检测的敏感度。
分化良好的肿瘤维持其管状结构,而癌灶组织增殖过快、细胞密度过高会限制水分子的随机运动,并可通过ADC值量化弥散受限的程度[15,16]。同一前列腺癌灶内不同区域的细胞密度不同,其信号亦有很大的差异。直方图分析法可以提取不同的微环境,以免被平均ADC值掩盖[17],是鉴别良恶性肿瘤、分级和评估肿瘤疗效的有效工具[18]。通过ROC曲线,发现ADC10高于ADCmedian、ADCmean、峰度和偏度,表明这个指标对鉴别良恶性病变的诊断效果最好,与以前的一些研究基本一致[19,20]。这可以用组织学异质性来解释,肿瘤细胞增殖最旺盛的部分细胞核分裂最活跃、结构最致密,水分子弥散受限最明显,因而ADCmin最能反映肿瘤细胞的病理及分化程度[21],然而ADCmin易受肿瘤边缘伪影、噪声及邻近结构等极端数值的影响,值不稳定,而ADC10同样能反映肿瘤的病理特性,其结果更稳定,因此ADC10能更好地反映前列腺恶性成分[21]。因此,采用直方图分析DWI成像对前列腺良恶性病变的鉴别是可行的。
本研究不足之处:(1)本研究大部分病理结果为经直肠超声引导下系统穿刺,与MRI病灶不能完全一一对应,结果可能存在偏差;(2)本文为回顾性研究,且样本选择可能存在偏倚;(3)本组样本量相对不足,今后仍需要大样本多中心研究进一步证实。
综上所述,尽管超高b值与高b值所对应的ADC图直方图对外周带前列腺癌的诊断效能相似,但在b值为2000 s/mm2时的DWI图像的敏感度显著高于b值为1000 s/mm2时。因此,超高b值DWI有助于提高对外周带前列腺癌的诊断价值。
Key R&D Plan Project of Ningxia Hui Autonomous Region (No. 2019BEG03033); Ningxia Natural Science Foundation of China (No. 2020AAC03156).
全体作者均声明无利益冲突。



























