
探讨在钆塞酸二钠(gadolinium ethoxybenzyl diethylenetriamine pentaacetic acid,Gd-EOB-DTPA)增强MRI中慢性乙型肝炎相关肝硬化患者基于肝叶的信号强度参数与白蛋白-胆红素(Albumin-Bilirubin,ALBI)分级的关系。
对62例肝脏正常(n=15)、慢性乙型肝炎相关肝硬化ALBI 1级(n=23)、2级(n=18)、3级(n=6)患者的Gd-EOB-DTPA增强MRI图像进行了分析,分别计算出肝右叶、肝左内叶、肝左外叶、肝尾状叶的肝实质相对增强率(liver relative enhancement,LRE)及肝肌对比率(liver-to-muscle ratio,LMR),并在正常组和不同ALBI分级组之间进行比较。定量分析慢性乙型肝炎相关肝硬化患者各个肝叶的LRE、LMR与ALBI分级的关系,绘制ROC曲线评估各个肝叶区分ALBI 1级和ALBI 2~3级的准确性。
正常组和不同ALBI分级组之间各个肝叶的LRE值和LMR值差异有统计学意义(P<0.05)。各组两两比较结果显示各肝叶LRE值在ALBI 2级和ALBI 3级组之间差异无统计学意义(P>0.05),各肝叶LMR值在任意两组之间差异均具有统计学意义(P<0.001)。肝硬化患者各个肝叶的LRE、LMR值与ALBI分级呈负相关(P<0.001),肝右叶LRE对于区分ALBI 1级和ALBI 2~3级准确率最高,受试者工作特征曲线下面积为0.913。
Gd-EOB-DTPA增强MRI中慢性乙型肝炎相关肝硬化患者基于肝叶的LRE、LMR与肝功能ALBI分级存在相关性,LRE、LMR有望成为评估肝叶功能的影像学手段。

本刊刊出的所有论文不代表本刊编委会的观点,除非特别声明
病毒性肝炎是中国肝硬化患者的主要病因,其中慢性乙型肝炎最常见[1]。肝功能评估是肝硬化患者最重要的问题之一[2]。目前,常用于评估肝功能的评分系统有Child-Turcotte-Pugh (CTP)评分、终末期肝病模型(modle for end-stage liver disease,MELD)评分,CTP评分系统包括五个变量:总胆红素、血清白蛋白、凝血酶原时间、腹水及肝性脑病的程度,其中腹水和肝性脑病程度是主观参数,需要根据临床医生的经验去判断。MELD评分包括三个变量:总胆红素、肌酐、国际标准化比率,虽然避免了主观因素的影响,但该模型仅适用于晚期肝病患者且计算公式复杂。与CTP评分和MELD评分相比,Johnson等[3]最近提出的白蛋白-胆红素(Albumin-Bilirubin,ALBI)分级只需要白蛋白和总胆红素这两个参数,避免了确定腹水和肝性脑病等级的主观偏见,而且适用于慢性肝病的不同阶段。虽然ALBI分级对于肝功能的评价效能已经很好,但其只能反映整个肝脏的功能,无法进行局部评价。
钆塞酸二钠(gadolinium ethoxybenzyl diethylenetriamine pentaacetic acid,Gd-EOB-DTPA)是用于T1加权成像的顺磁性对比剂,兼具有非特异性细胞外对比剂和肝细胞特异性对比剂的特性,很容易被肝细胞摄取并分泌到胆道系统,在摄取和排泄的过程中并没有发生代谢的变化[4, 5]。因此,Gd-EOB-DTPA增强MRI成像不仅用于肝脏病变的诊断,还可以用来评估肝功能[6]。与上述评分系统相比,Gd-EOB-DTPA增强MRI成像能更直观、全面地了解肝脏受损情况,提供更为丰富的功能信息[7]。
在Gd-EOB-DTPA增强MRI成像中,使用信号强度比来评估肝功能是最简单、方便的方法[2]。常用的信号强度参数包括肝实质相对增强率(liver relative enhancement,LRE)、肝肌对比率(liver-to-muscle ratio,LMR)、肝脾对比率(liver-to-spleen ratio,LSR)等[8, 9, 10]。然而目前对这些参数的研究主要集中于全肝功能的评估,在临床实践中,肝叶的功能的评估能为肝脏手术方式的选择及手术风险的评估提供重要的信息[11]。肝硬化过程中,肝右叶、肝左内叶、肝左外叶和肝尾状叶的体积会随着肝硬化的程度而发生变化,但仅仅依靠形态学的观察,并不能准确地反映肝叶的功能[12]。因此,本研究的目的是探讨慢性乙型肝炎相关肝硬化患者基于肝叶的信号强度参数与肝功能ALBI分级的相关性。
本研究为回顾性研究,经医院伦理委员会批准(批准号:2020JS09),免除受试者知情同意。收集从2019年1月至2021年4月在哈尔滨医科大学附属第一医院进行Gd-EOB-DTPA增强MRI检查的患者相关资料,肝硬化组纳入标准:(1)慢性乙型肝炎肝硬化病史(所有肝硬化患者诊断均符合2019年中华医学会肝病学分会《肝硬化诊治指南》诊断标准[13]);(2) MRI检查前后一周内进行肝功能实验室检查;(3)未接受过肝脏手术;(4)无胆结石、胆管扩张及其他胆道疾病。肝硬化组排除标准:(1)患者不配合,图像伪影过多;(2)弥漫性肝肿瘤、囊肿;(3)除乙型肝炎感染外其他原因所导致的肝硬化。正常对照组纳入标准:(1)肝功能正常,无病毒性肝炎、无肝硬化;(2)无肝脏手术史;(3)无酒精及药物滥用史。正常对照组排除标准:(1)影像学检查肝脏异常征象;(2)患者不配合,图像伪影过多。
记录好正常对照组和肝硬化组肝功能实验室检查数据,指标包括白蛋白(albumin,ALB)、球蛋白(globulin,GLB)、总胆红素(total bilirubin,TBiL)、直接胆红素(direct bilirubin,DBiL)、间接胆红素(indirect bilirubin,IBiL)、谷丙转氨酶(alanine aminotransferase,ALT)及谷草转氨酶(aspartate transaminase,AST)。根据白蛋白和总胆红素水平计算出肝硬化组患者的ALBI评分,ALBI评分的计算公式如下。
ALBI=(-0.085×ALB g/L) + (0.66×log10TBiL μmol/L)
ALBI评分分为三级:1级:≤-2.60;2级:>-2.60,≤-1.39;3级:>-1.39。
使用Siemens Amira 1.5 T MR扫描仪,13通道表面相控阵腹部线圈进行MR扫描,在MR检查前患者保持空腹状态,进行吸气屏气训练。采用高压注射器自肘静脉注入Gd-EOB-DTPA (Primo-vist; Bayer Schering Pharma AG, Berlin, Germany),注射剂量约10 mL (0.025 mmol/kg),注射速率为2 mL/s,然后以相同速率注射20 mL生理盐水冲洗,注射Gd-EOB-DTPA后20 s获得动脉期图像、门脉期55 s、平衡期3 min、肝胆期20 min。增强前后的TIWI扫描采用多回波三维容积内插水脂分离快速扰相(three dimensional multi-echo Dixon volumetricinterpolated breath-hold examination, Dixon-VIBE)序列,具体参数为:TR=6.73 ms,TE=2.39 ms,反转角=12°,带宽=490 HZ,视野=380 mm×400 mm,层厚=3 mm。
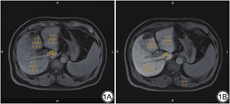
由两名具有多年腹部磁共振成像经验,且对患者的临床、实验室信息不知情的放射科医师对图像进行感兴趣区(ROI)选取,将二者测量结果取均值并进行记录,具体方法如下:使用工作站(eFilm workstation)分别在增强前和增强后20 min肝胆期(hepatobiliary phase,HBP)图像上绘制感兴趣区并测量信号强度(signal intensity,SI)。分别在肝右叶、肝左内叶、肝左外叶、肝尾状叶画取3个ROI,肝右叶、肝左内叶、肝左外叶的ROI面积为120~180 mm2,肝尾状叶ROI面积为20~30 mm2,画取时要避开局灶性病变、血管和胆管以及成像伪影,连续选取三个层面,每个层面的ROI大小和位置要尽量相同,每个肝叶共画取九个ROI,取平均值得到各个肝叶的增强前信号强度(SIpre)和肝胆期信号强度(SIHBP)。随后在相应层面的竖脊肌上分别画取一个ROI,面积为120~150 mm2,取平均值得到竖脊肌信号强度(SI肌肉),见图1。LRE由肝胆期和增强前肝实质信号强度的差值除以增强前肝实质信号强度,LMR由肝胆期的肝实质信号强度除以竖脊肌信号强度,计算公式如下。

LRE=(SIHBP-SIpre)/SIpre
LMR=SI肝脏/SI肌肉
使用SPSS 23.0软件进行统计分析,连续定量数据以±s表示,所有测试均为双侧,P<0.05为差异有统计学意义。
采用Shapiro-Wilk检验评估测量数据的正态性,使用t检验或Mann-Whitney U检验比较正常组和肝硬化组各个指标的差异,采用Kruskal-Wallis秩和检验比较正常组和不同ALBI分级之间基于肝叶的LRE值和LMR值差异性。采用Spearman等级相关分析评价肝叶的LRE和LMR与ALBI分级的相关性。根据受试者-操作特征(receiver operating characteristic,ROC)曲线,以定量指标ROC曲线下面积(area under the curve,AUC)评价各个肝叶的LRE和LMR对ALBI 1级和ALBI 2~3级区分的准确性。
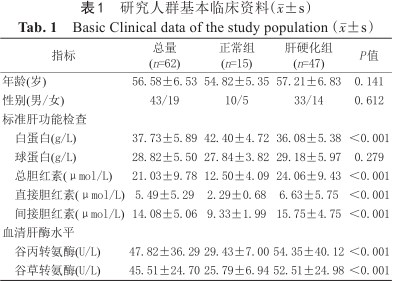
最终的研究人群包括15名肝脏正常和47名慢性乙型肝炎相关肝硬化患者,其中ALBI 1级(n=23)、2级(n=18)、3级(n=6)。研究人群的基本临床资料如表1所示,在正常对照组和肝硬化组中,患者的年龄、性别、GLB差异均无统计学意义。但两组间TBiL、DBiL、IBiL、ALB、ALT、AST的差异有统计学意义(P<0.001)。
研究人群基本临床资料(±s)
Basic Clinical data of the study population(±s)
研究人群基本临床资料(±s)
Basic Clinical data of the study population(±s)
| 指标 | 总量 (n=62) | 正常组 (n=15) | 肝硬化组 (n=47) | P值 |
|---|---|---|---|---|
| 年龄(岁) | 56.58±6.53 | 54.82±5.35 | 57.21±6.83 | 0.141 |
| 性别(男/女) | 43/19 | 10/5 | 33/14 | 0.612 |
| 标准肝功能检查 | ||||
白蛋白(g/L) | 37.73±5.89 | 42.40±4.72 | 36.08±5.38 | <0.001 |
球蛋白(g/L) | 28.82±5.50 | 27.84±3.82 | 29.18±5.97 | 0.279 |
总胆红素(μmol/L) | 21.03±9.78 | 12.50±4.09 | 24.06±9.43 | <0.001 |
直接胆红素(μmol/L) | 5.49±5.29 | 2.29±0.68 | 6.63±5.75 | <0.001 |
间接胆红素(μmol/L) | 14.08±5.06 | 9.33±1.99 | 15.75±4.75 | <0.001 |
| 血清肝酶水平 | ||||
谷丙转氨酶(U/L) | 47.82±36.29 | 29.43±7.00 | 54.35±40.12 | <0.001 |
谷草转氨酶(U/L) | 45.51±24.70 | 25.79±6.94 | 52.51±24.98 | <0.001 |
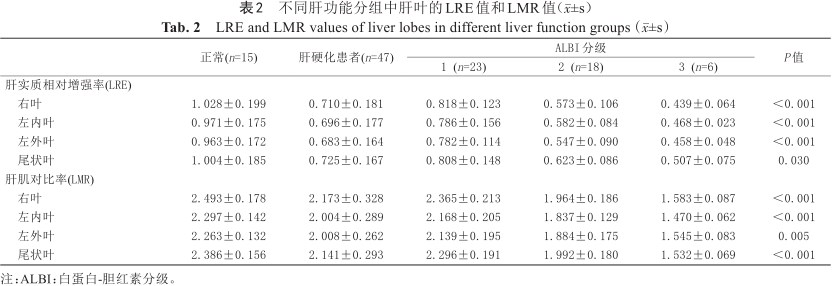
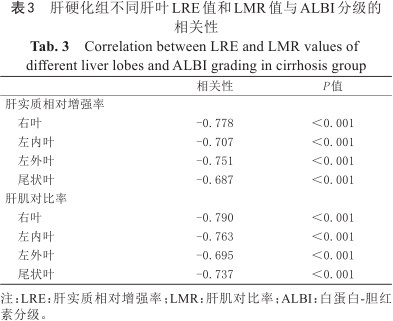
正常组和肝硬化组各个肝叶LRE、LMR如表2所示,根据Kruskal-Wallis秩和检验,正常组和不同ALBI分级组之间各个肝叶的LRE值和LMR值差异有统计学意义(P<0.05)。各组两两比较结果显示各肝叶LRE值在ALBI 2级和ALBI 3级组之间差异无统计学意义(P>0.05),各肝叶LMR值在任意两组之间差异均有统计学意义(P<0.001)。Spearman等级相关分析显示,每个肝叶的LRE、LMR与ALBI分级呈负相关,如表3所示(P<0.001)。
不同肝功能分组中肝叶的LRE值和LMR值(±s)
LRE and LMR values of liver lobes in different liver function groups(±s)
不同肝功能分组中肝叶的LRE值和LMR值(±s)
LRE and LMR values of liver lobes in different liver function groups(±s)
| 正常(n=15) | 肝硬化患者(n=47) | ALBI分级 | P值 | |||
|---|---|---|---|---|---|---|
| 1 (n=23) | 2 (n=18) | 3 (n=6) | ||||
| 肝实质相对增强率(LRE) | ||||||
右叶 | 1.028±0.199 | 0.710±0.181 | 0.818±0.123 | 0.573±0.106 | 0.439±0.064 | <0.001 |
左内叶 | 0.971±0.175 | 0.696±0.177 | 0.786±0.156 | 0.582±0.084 | 0.468±0.023 | <0.001 |
左外叶 | 0.963±0.172 | 0.683±0.164 | 0.782±0.114 | 0.547±0.090 | 0.458±0.048 | <0.001 |
尾状叶 | 1.004±0.185 | 0.725±0.167 | 0.808±0.148 | 0.623±0.086 | 0.507±0.075 | 0.030 |
| 肝肌对比率(LMR) | ||||||
右叶 | 2.493±0.178 | 2.173±0.328 | 2.365±0.213 | 1.964±0.186 | 1.583±0.087 | <0.001 |
左内叶 | 2.297±0.142 | 2.004±0.289 | 2.168±0.205 | 1.837±0.129 | 1.470±0.062 | <0.001 |
左外叶 | 2.263±0.132 | 2.008±0.262 | 2.139±0.195 | 1.884±0.175 | 1.545±0.083 | 0.005 |
尾状叶 | 2.386±0.156 | 2.141±0.293 | 2.296±0.191 | 1.992±0.180 | 1.532±0.069 | <0.001 |
注:ALBI:白蛋白-胆红素分级。
肝硬化组不同肝叶LRE值和LMR值与ALBI分级的相关性
Correlation between LRE and LMR values of different liver lobes and ALBI grading in cirrhosis group
肝硬化组不同肝叶LRE值和LMR值与ALBI分级的相关性
Correlation between LRE and LMR values of different liver lobes and ALBI grading in cirrhosis group
| 相关性 | P值 | |
|---|---|---|
| 肝实质相对增强率 | ||
右叶 | -0.778 | <0.001 |
左内叶 | -0.707 | <0.001 |
左外叶 | -0.751 | <0.001 |
尾状叶 | -0.687 | <0.001 |
| 肝肌对比率 | ||
右叶 | -0.790 | <0.001 |
左内叶 | -0.763 | <0.001 |
左外叶 | -0.695 | <0.001 |
尾状叶 | -0.737 | <0.001 |
注:LRE:肝实质相对增强率;LMR:肝肌对比率;ALBI:白蛋白-胆红素分级。
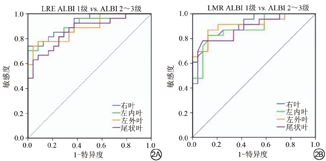
肝硬化组中各个肝叶的LRE、LMR区分ALBI 1级和ALBI 2~3级的ROC曲线分析如表4和图2所示。肝右叶LRE对于鉴别ALBI 1级和ALBI 2~3级准确性最高,AUC值为0.913。
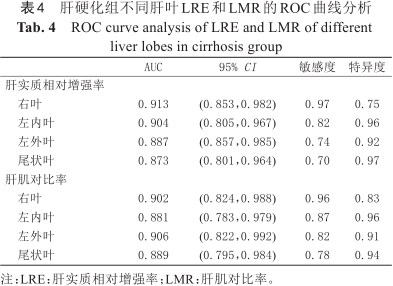
肝硬化组不同肝叶LRE和LMR的ROC曲线分析
ROC curve analysis of LRE and LMR of different liver lobes in cirrhosis group
肝硬化组不同肝叶LRE和LMR的ROC曲线分析
ROC curve analysis of LRE and LMR of different liver lobes in cirrhosis group
| AUC | 95% CI | 敏感度 | 特异度 | |
|---|---|---|---|---|
| 肝实质相对增强率 | ||||
右叶 | 0.913 | (0.853,0.982) | 0.97 | 0.75 |
左内叶 | 0.904 | (0.805,0.967) | 0.82 | 0.96 |
左外叶 | 0.887 | (0.857,0.985) | 0.74 | 0.92 |
尾状叶 | 0.873 | (0.801,0.964) | 0.70 | 0.97 |
| 肝肌对比率 | ||||
右叶 | 0.902 | (0.824,0.988) | 0.96 | 0.83 |
左内叶 | 0.881 | (0.783,0.979) | 0.87 | 0.96 |
左外叶 | 0.906 | (0.822,0.992) | 0.82 | 0.91 |
尾状叶 | 0.889 | (0.795,0.984) | 0.78 | 0.94 |
注:LRE:肝实质相对增强率;LMR:肝肌对比率。

本研究收集了慢性乙型肝炎相关肝硬化患者的临床及影像资料,研究了肝右叶、肝左内叶、肝左外叶、肝尾状叶的信号强度参数与ALBI分级的相关性,结果显示各个肝叶的LRE值、LMR值与ALBI分级呈负相关,同时,ROC分析表明,对于ALBI 1级和ALBI 2~3级的区分,各个肝叶的LRE值、LMR值均表现出了良好的准确性。本研究相比于其他Gd-EOB-DTPA增强MRI定量评估肝功能研究的创新处在于分别测量了不同肝叶信号强度参数与肝功能评分系统的相关性。同时,对于肝功能评分系统选择了更为简单、客观的ALBI分级方法,而不是常用的CTP评分系统。本研究提示,Gd-EOB-DTPA增强MRI中基于肝叶的LRE、LMR可以反映慢性乙型肝炎相关肝硬化患者肝叶的功能情况,可能是一种潜在的影像学测量手段。
LRE和LSR是常用于评估肝功能的信号强度参数,但之前的研究表明,肝实质的病理变化会导致脾脏也发生变化,使脾脏表现出不同程度的强化,从而影响LSR数据的准确性[14]。相比于LSR,LMR中的椎旁肌肉强化程度和病理改变都很小,几乎不受肝脏疾病的影响[15]。因此在本项研究中我们选择了将LRE、LMR作为评估肝功能的参数。
Gd-EOB-DTPA在肝胆期的摄取是由肝细胞膜表面有机阴离子转运肽(OATP1 B1/B3)介导的,注射20 min后,达到摄取量的峰值,然后通过多药耐药相关蛋白-2 (MRP2)排泄到胆道系统[16, 17]。在这项研究中我们发现,肝硬化组各个肝叶的LRE、LMR与正常组相比均显著降低,之前的几项研究表明,肝硬化会导致有机阴离子转运肽和多药耐药相关蛋白-2表达异常或数量减少[18, 19]。这些转运蛋白功能和数量的受损可能会导致肝细胞对对比剂的特异性摄取减少,解释了肝硬化患者LRE、LMR值降低的原因[20]。
ALBI分级是评估肝功能的一种简单、客观和有判别性的方法[3]。它只包含两个简单的参数:ALB和TBiL,ALB由肝脏产生,是一种多功能蛋白质,具有抗氧化、免疫调节和解毒功能[21]。在肝硬化患者中,ALB水平降低通常意味着肝功能紊乱和预后不良[22]。此外,Tbil也是肝功能的重要指标,肝细胞和胆汁淤积性肝损伤都可能导致血清胆红素水平升高[23]。在我们的研究中,慢性乙型肝炎相关肝硬化患者各个肝叶的LRE、LMR均与ALBI分级呈负相关。Wang等[24]研究表明,ALBI分级可以成为评估评估慢性乙型肝炎相关肝硬化严重程度和远期预后的指标。我们认为随着肝硬化患者ALBI分级的升高,肝细胞对Gd-EOB-DTPA的摄取会逐渐减少,进而导致信号强度的降低。Takatsu等[25]通过肝脾对比率和ALBI分级之间的相关性分析提示:随着ALBI分级的升高,Gd-EOB-DTPA在肝胆期的分布逐渐减少,这和我们的结论是一致的。通过研究结果我们认为,慢性乙型肝炎相关肝硬化患者基于肝叶的LRE、LMR可以反映出不同肝叶对Gd-EOB-DTPA的摄取情况。
ROC分析表明,各肝叶的LRE、LMR均可以很好地区分ALBI 1级和ALBI 2~3级,其中肝右叶LRE鉴别ALBI 1级和ALBI 2~3级准确性最高。我们猜测可能与肝右叶门静脉血流走行有一定关系,门静脉右支分出后直接进入肝实质,不会经过肝实质外,因此当肝硬化结节导致门静脉血流供应减少时,肝右叶变化要比其他肝叶更敏感[26]。其次肝右叶相对于其他肝叶较大的体积使得感兴趣区的选取能更加准确[27]。
本项研究中,存在一些局限型,首先,肝硬化患者的病理证据并不广泛。其次,本研究只是针对慢性乙型肝炎相关肝硬化患者,肝硬化的病因多种多样,如病毒性肝炎、酒精性肝炎和自身免疫性肝炎等,在不同来源的肝硬化患者中,Gd-EOB-DTPA的摄取和排泄模式可能不同。第三,信号强度测量会受到多种技术参数的影响,且与对比剂的浓度呈非线性关系[28],需要大样本的研究来验证结果的稳定性。第四,作为回顾性研究,有不可避免的选择偏移,同时该研究人群中ALBI三级患者的数量较少,因此,需要进一步的前瞻性和多中心研究,包括更多的ALBI三级患者。最后,本研究仅评估了肝叶的功能,今后将进一步探讨MRI对肝段功能的定量评估。
综上所述,Gd-EOB-DTPA增强MRI中基于肝叶的LRE、LMR与肝功能ALBI分级表现出较强的相关性,肝右叶LRE对于区分ALBI 1级和ALBI 2~3级表现出更高的准确性。我们希望这些发现能有助于慢性乙型肝炎相关肝硬化患者肝功能的评估,为临床治疗决策提供辅助手段。
全部作者均声明无利益冲突。



























