
采用静息态功能磁共振成像(resting-state functional magnetic resonance imaging,rs-fMRI)技术,探讨耳电针,即经皮耳穴迷走神经刺激(transcutaneous auricular vagus nerve stimulation,taVNS)治疗难治性抑郁症(treatment-resistant depression,TRD)的即刻脑效应。
纳入34例TRD和34例健康对照(health controls,HC),评估每位受试者相关临床量表,随后对TRD进行30 min taVNS即刻刺激治疗,采集相关rs-fMRI数据。比较患者与健康对照的低频振幅(amplitude of low-frequency fluctuation,ALFF)值,以及刺激前后的ALFF值变化;再与临床量表评分进行偏相关分析;再将差异脑区作为种子点,计算其与全脑的功能连接(functional connectivity,FC)。
刺激前,TRD组在左侧苍白球/下丘脑/尾状核、左侧中央前回/额中回的ALFF值较高;左侧中央前回/额中回分别与双侧扣带回、双侧辅助运动区、左侧内侧额上回、左侧豆状核(包括苍白球和壳核)的FC较高;左侧中央前回/额中回ALFF值分别与HAMD-17 (P=0.013,r=0.442)、SDS (P=0.026,r=0.400)评分成正相关。TRD治疗后在左侧额下中回眶部、双侧小脑1区、左侧小脑2区的ALFF值显著升高。
TRD患者存在边缘系统-皮层-纹状体-苍白球-丘脑神经环路脑功能活动异常,其中认知及运动皮层相关脑区脑功能异常可能与负性情绪有关;taVNS可即刻调节TRD患者的脑自发活动,涉及情感认知相关脑区,可能是耳甲电针治疗TRD的脑功能潜在靶点脑区。

本刊刊出的所有论文不代表本刊编委会的观点,除非特别声明
抑郁症(major depression disorder,MDD)是以情绪低落为核心,伴随着兴趣减退、愉快感缺乏、思维迟缓,注意力集中减退等症状的疾病[1]。现全球确诊的抑郁症患者超过3.5亿,在我国确诊的抑郁症患者有超过0.5亿人,且患病人数仍在增加[2]。目前国内外治疗抑郁症的方法以药物治疗为主,但有将近50%的患者对抗抑郁药无明显反应,成为难治性抑郁症(treatment-resistant depression,TRD)[3],因此寻找TRD能有效替代药物的治疗方法,是一个紧迫的临床问题[4]。
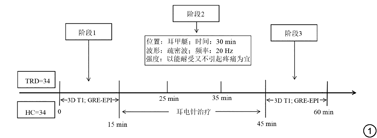

近年来研究表明,迷走神经刺激术(vagus nerve stimulation,VNS)对TRD有效[5]。本团队前期研究发现耳甲部电针,即经皮耳穴迷走神经刺激术(transcutaneous auricular vagus nerve stimulation,taVNS)产生了与VNS治疗抑郁症类似的疗效[6, 7, 8],进一步观察到taVNS对维持药物治疗的TRD患者具有明显的增效作用[9],但其神经影像机制尚不明确。本研究采用静息态功能磁共振成像(resting-state functional magnetic resonance imaging,rs-fMRI)技术,结合多种分析方法,观察TRD患者局部及全脑功能变化,探索taVNS治疗TRD的即刻脑效应,为揭示其长期刺激治疗的疗效脑机制提供参考。
本研究为前瞻性研究,纳入TRD患者以及健康对照(healthy controls,HC)各34例。首先通过了中国中医科学院广安门医院伦理委员会批准(批准号:2017-021-SQ),所有受试者均签署知情同意之后,前往广安门医院参加脑磁共振扫描及临床量表评分。
本研究共纳入2018年9月至2020年1月在广安门医院心身医学科门诊就诊的34例TRD患者。入组标准:(1)参照Sackeim[10]的诊断标准,两种或两种以上足量足疗程的抗抑郁药治疗无效的抑郁症患者,入组之前的抗抑郁治疗已经稳定6周以上;(2)年龄18~70岁;(3)右利手;(4) HAMD-17总分>17分;(5)临床查体和实验室检查无明显异常。排除标准:(1)合并其他精神障碍和神经系统疾病;(2)严重冲动、自杀倾向或自伤风险高;(3)近6个月有酒精和药物依赖;(4)处于怀孕和哺乳期;(5)有MRI检查禁忌证。
HC为同期经广告招募的34例身心健康者,并且是通过精神障碍诊断与统计手册第4版(DSM-Ⅵ)非患者版的结构化访谈合格者。入组标准:(1)年龄18~70岁;(2)右利手;(3) HAMD-17总分<7分;(4)既往无精神疾病史;(5)临床查体和实验室检查无明显异常;(6)无MRI检查禁忌证。
耳甲部经75%酒精常规消毒后,耳夹表皮电极分别置于双侧耳甲处,再连接治疗仪(SDZ-IIB,华佗牌,江苏苏州医疗仪器公司),接着打开刺激仪开关后,设置治疗参数为:疏密波,频率为20 Hz,调节电流强度,以能耐受又不引起疼痛为宜,既往经验显示为4~8 mA,每次持续刺激30 min。
本研究采用汉密尔顿抑郁量表(17-item Hamilton Depression Scale,HAMD-17)、汉密尔顿焦虑量表(14-item Hamilton Anxiety Scale,HAMA-14)、抑郁自评量表(Self-rating Depression Scale,SDS)、焦虑自评量表(Self-rating Anxiety Scale,SAS),对患者的抑郁和焦虑症状进行评估。
所有受试者均参加脑部磁共振扫描(Magneton Skyra 3.0 T,德国西门子公司),采用20通道头颈联合线圈。扫描时嘱咐受试者闭眼、保持安静、清醒、放松状态。首先进行T2加权像MRI平扫,以排除脑器质性病变。脑功能磁共振数据采集方法:先行3D T1脑结构像扫描,具体参数为:重复时间(TR) 2530 ms,回波时间(TE) 2.98 ms,视野(FOV) 256 mm×256 mm,层厚1.0 mm,层间距0 mm,层内分辨率256×192,翻转角(FA) 7°;然后采用血氧水平依赖序列(GRE-EPI)采集功能数据,具体参数为:TR 2000 ms,TE 30 ms,FA 90°,层厚3.5 mm,层间隔0.6 mm,层数32层,FOV 224 mm×224 mm,层间分辨率 64×64。TRD组刺激前及刺激治疗后即刻(约3 min内)各扫描一次fMRI,HC仅接受一次fMRI扫描,扫描序列、相关参数与TRD一致。
基于MATLAB (版本号R2020a)平台和DPABI V4.3 (http://rfmri.org/DPABI),对采集的rs-fMRI数据进行预处理。具体步骤包括:对DICOM格式进行转换,再剔除10个时间点数据,然后行时间校正、头动校正(在X、Y、Z三个方向上的平移不能超过1.5 mm,运动旋转不能超过1.5°,否则要求重新扫描)、空间标准化(3 mm×3 mm×3 mm)、再使用联合分割算法,将配准后的结构像进行分割,配准到一个组上平均模板,去除脑白质、脑脊液等协变量因素后,选用4 mm的全宽半高(FWHM)高斯平滑核进行空间平滑,以提高信噪比。
首先,对上述预处理图像数据进行去线性漂移,对0.01 Hz~0.1 Hz信号的功率谱进行开方,得到ALFF值,将每个体素的ALFF值减去全脑信号幅值均值,再除以标准差,对全脑体素进行标准化处理。
首先,对上述预处理图像数据进行去线性漂移,再进行滤波;然后采用种子点相关分析法,根据TRD与HC两组组间、TRD接受刺激前后ALFF差异有统计学意义脑区的peak点(-48,6,48)作为感兴趣区,以6 mm为半径的球形区域为种子,进行全脑FC分析。提取并计算每一个被试的ROI里所有体素的平均时间序列,与全脑体素的时间序列做Pearson相关分析,从而得到感兴趣区与全脑功能连接图,功能连接值用相关系数(r值)表示,然后经过Fisher's检验转变为z值,使其符合正态分布。
采用SPSS 25.0软件统计分析数据。计数资料采用卡方检验。计量资料采用均数±标准差(±s)的形式表示,符合正态性和方差齐性的资料,两组比较采用独立样本t检验,方差不齐采用校正独立t检验;不符合正态性则采用秩和检验,数据用中位数±四分位数(±QR)表示。检验水准为α=0.05,P<0.05表示差异有统计学意义。
采用DAPBI软件中的统计模块对ALFF图和功能连接图进行分析。采用两样本t检验,将年龄、性别、受教育程度作为协变量,比较刺激前TRD与HC两组ALFF图、FC图的差异脑区,采用配对t检验分别比较TRD刺激前后的ALFF图的差异性脑区。经高斯随机场校正(Gaussian random field,GRF)后,以体素水平阈值P<0.005,簇水平P<0.05的脑区定义为差异有统计学意义的脑区。进一步提取差异有统计学意义的脑区的ALFF值,将年龄、性别、受教育程度作为协变量,与临床量表包括HAMD-17、HAMA、SDS、SAS进行偏相关分析,以P<0.05为差异有统计学意义。
TRD组与HC组分别为34例,一共68例;2组间年龄、受教育程度差异均无统计学意义,但性别差异有统计学意义(P<0.05)。TRD组的HAMD、HAMA、SDS、SAS评分均明显高于HC组(P<0.001),差异有统计学意义(表1)。
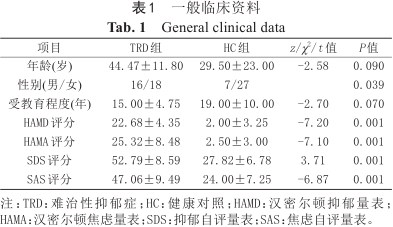
一般临床资料
General clinical data
一般临床资料
General clinical data
| 项目 | TRD组 | HC组 | z/χ2/t值 | P值 |
|---|---|---|---|---|
| 年龄(岁) | 44.47±11.80 | 29.50±23.00 | -2.58 | 0.090 |
| 性别(男/女) | 16/18 | 7/27 | 0.039 | |
| 受教育程度(年) | 15.00±4.75 | 19.00±10.00 | -2.70 | 0.070 |
| HAMD评分 | 22.68±4.35 | 2.00±3.25 | -7.20 | 0.001 |
| HAMA评分 | 25.32±8.48 | 2.50±3.00 | -7.10 | 0.001 |
| SDS评分 | 52.79±8.59 | 27.82±6.78 | 3.71 | 0.001 |
| SAS评分 | 47.06±9.49 | 24.00±7.25 | -6.87 | 0.001 |
注:TRD:难治性抑郁症;HC:健康对照;HAMD:汉密尔顿抑郁量表;HAMA:汉密尔顿焦虑量表;SDS:抑郁自评量表;SAS:焦虑自评量表。
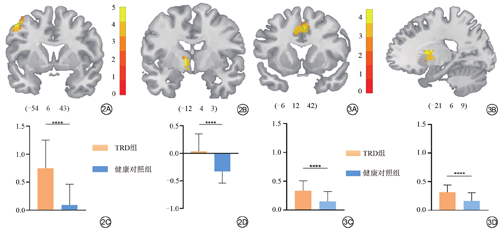
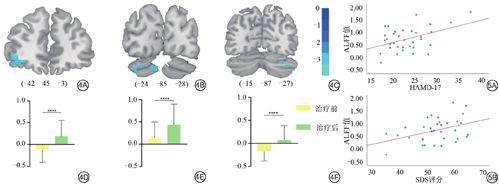
与HC组比较,刺激前TRD组患者在左侧中央前回、左侧额中回、左侧苍白球、左侧下丘脑、左侧尾状核的ALFF值显著增高(表2、图2);TRD患者治疗前较治疗后,在左侧额下、中回眶部、双侧小脑1区、左侧小脑2区的ALFF值显著降低(表3、图4)。以上结果均经GRF校正,阈值为voxel P<0.005,cluster P<0.05。

TRD组与HC组ALFF值差异有统计学意义脑区
Brain regions differences in ALFF values between the TRD and HC
TRD组与HC组ALFF值差异有统计学意义脑区
Brain regions differences in ALFF values between the TRD and HC
| 脑区 | 半球 | BA分区 | MNI坐标 | 体素 | t值 | ||
|---|---|---|---|---|---|---|---|
| X | Y | Z | |||||
| 中央前回/额中回 | 左 | 6 | -54 | 6 | 43 | 39 | 5.03 |
| 苍白球/尾状核 | 左 | -12 | 4 | 3 | 31 | 3.13 | |
注:TRD:难治性抑郁症;HC:健康对照;ALFF:低频振幅;BA分区:大脑布罗德曼分区。


TRD组刺激前后ALFF值差异有统计学意义脑区
Brain regions differences in ALFF values before and after stimulation in the TRD
TRD组刺激前后ALFF值差异有统计学意义脑区
Brain regions differences in ALFF values before and after stimulation in the TRD
| 脑区 | 半球 | BA分区 | MNI坐标 | 体素 | t值 | ||
|---|---|---|---|---|---|---|---|
| X | Y | Z | |||||
| 额下回/额中回眶部 | 左 | 7 | -42 | 45 | -3 | 119 | -4.59 |
| 小脑1区 | 左、右 | ±24 | -85 | -28 | 36 | -3.11 | |
| 小脑2区 | 左 | -15 | -87 | -27 | 26 | -4.45 | |
注:TRD:难治性抑郁症;ALFF:低频振幅;BA分区:大脑布罗德曼分区。

与HC组相比刺激前TRD的FC较高,包括:左侧中央前回/额中回与左侧豆状核、双侧中扣带回、左侧内侧额上回、左侧辅助运动区;但两组受试者左侧苍白球与全脑的功能连接差异无统计学意义(表4、图3)。以上结果均经GRF校正,阈值为voxel P<0.005,cluster P<0.05。
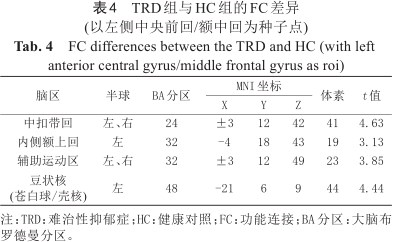
TRD组与HC组的FC差异(以左侧中央前回/额中回为种子点)
FC differences between the TRD and HC (with left anterior central gyrus/middle frontal gyrus as roi)
TRD组与HC组的FC差异(以左侧中央前回/额中回为种子点)
FC differences between the TRD and HC (with left anterior central gyrus/middle frontal gyrus as roi)
| 脑区 | 半球 | BA分区 | MNI坐标 | 体素 | t值 | ||
|---|---|---|---|---|---|---|---|
| X | Y | Z | |||||
| 中扣带回 | 左、右 | 24 | ±3 | 12 | 42 | 41 | 4.63 |
| 内侧额上回 | 左 | 32 | -4 | 18 | 43 | 19 | 3.13 |
| 辅助运动区 | 左、右 | 32 | ±3 | 12 | 49 | 23 | 3.85 |
豆状核 (苍白球/壳核) | 左 | 48 | -21 | 6 | 9 | 44 | 4.44 |
注:TRD:难治性抑郁症;HC:健康对照;FC:功能连接;BA分区:大脑布罗德曼分区。
TRD组左侧额中回ALFF值与HAMD-17 (P=0.013,r=0.442)、SDS (P=0.026,r=0.400)评分成正相关(图5),与HAMA、SAS评分相关性差异无统计学意义(P>0.05)。左侧苍白球、左侧前丘脑ALFF值与HAMD-17、HAMA、SDS、SAS评分相关性差异无统计学意义(P>0.05)。
本研究基于rs-fMRI比较了TRD与HC脑功能差异,进一步观察了耳甲部电针刺激TRD前后的即刻脑功能变化,结果显示:TRD组在左侧苍白球、左侧中央前回/左侧额中回ALFF存在异常,且左侧中央前回/左侧额中回ALFF值与HAMD-17、SDS量表评分成正比;TRD患者的左侧中央前回/额中回与双侧扣带回、双侧辅助运动区、左侧内侧额上回、左侧豆状核(包括苍白球和壳核)等脑区的FC较高;耳电针使TRD患者的左侧额下回/额中回眶部,双侧小脑1区,左侧小脑2区ALFF出现即刻增高。
边缘系统-皮层-纹状体-苍白球-丘脑神经环路异常被认为是抑郁症发病的重要环路[11, 12]。本研究发现TRD患者左侧额中回、苍白球、尾状核ALFF值较高,左侧额中回/中央前回与中扣带回、额上回、豆状核FC异常,与既往研究结果相近[13, 14, 15],其中额上回、额中回是情绪认知控制网络的重要组成部分,参与情感调节、认知执行,记忆、决策判断等过程[16],豆状核作为憎恨环路的关键节点[17],更是与情绪处理有关;Guo等[18]也发现TRD患者在默认网络(额上中回和前扣带回)ALFF值较高。也有研究提示抑郁诊患者豆状核体积缩小,且抑郁症可加快壳核体老化进程,同时壳核的拓扑网络异常与发作次数成正比[19, 20, 21],由此可推测,TRD患者情绪相关脑区的功能也存在异常,且TRD患者较非TRD患者更容易出现纹状体脑功能异常。本研究通过FC分析发现左侧中央前回/额中回与辅助运动区的FC增强,推测这可能与纹状体可接受来自额叶运动区如中央前回的神经信息、情绪可影响运动前的行为反应有关。另外左额中回、中央前回ALFF值与HAMD、SDS评分成正相关,说明TRD伴随的负性情绪可能影响认知及运动区相关脑区如中央前回、额中回的脑自发活动异常有关,这也有可能是TRD患者会出现中央前回/额上回与辅助运动区FC增强的原因。综上,TRD患者也存在抑郁症常见的边缘系统-皮层-纹状体-苍白球-丘脑神经环路中多脑区功能异常,而TRD与认知关系似乎更为密切,但具体与普通抑郁症的区别值得进一步深入研究。
本研究经过30 min的耳电针刺激后,即刻发现左侧额下、中回眶部、双侧小脑1区、左侧小脑2区ALFF值增加。由杏仁核发出的投射束可经丘脑传至眶额叶[22],是额叶眶回作为情绪环路的重要组成部分,感受奖赏信号、情绪加工、冲动控制的解剖基础[23, 24]。有研究发现抑郁症组识别负性情绪面孔时皮质下通路效能连接相对减弱,而在识别喜悦面孔时介数中心性指标较HC在双侧眶内额上回、右侧眶部额上回、右侧杏仁核均下降,且右侧眶部额上回节点全局效率属性和介数中心指数分别与HAMD-17评分成负相关、焦虑/躯体化因子分成负相关,提示抑郁症患者对情绪识别、加工及认知活动信息调控能力减弱[25, 26]。本研究发现耳电针刺激后额叶眶回ALFF发生变化,综合以往研究,可推测耳电针可能对TRD患者眶额叶情感认知皮层的脑自发活动有即刻调节作用,以改善边缘系统-皮层-纹状体-苍白球-丘脑神经环路的状态,结合孙也婷等[27]的发现,可进一步推测对眶额叶脑功能的调节可能是耳电针长期治疗TRD患者有效的脑机制基础。
既往研究发现小脑可参与情绪调节,注意和工作记忆等过程,并与涉及情感、认知功能的额叶和边缘网络脑区存在紧密联系[28, 29]。研究发现TRD患者在双侧小脑后叶ALFF升高,左侧小脑后叶fALFF升高,左侧小脑ReHo值降低[30];Guo等[31]、陈丽梅等[32]提出小脑是区分难治和非难治抑郁症的关键脑区;Guo等进一步以小脑作为种子点,发现TRD患者小脑和前额叶皮层包括额中回、额上回额下回FC增强;Wu等[33]利用18FDG PET观察重复经颅磁刺激TRD患者,发现抑郁症患者病程越长,小脑代谢越低,使其接受刺激背外侧前额叶治疗,提高了小脑的代谢,同时患者的症状也得到了较大的改善;舒燕萍等[34]发现自杀未遂青年抑郁症患者的在左小脑后叶fALFF值低于对照组,在通过8周认知疗法联合药物疗法后该脑区的自发活动基本恢复正常。因此,小脑可能是与抑郁症,特别是TRD疗效相关的关键脑区。本研究发现,耳电针刺激后双侧小脑1区,左侧小脑2区ALFF值增加,这些脑区的自发神经活动较刺激前更活跃,推测在耳电针的作用下,可能启动了小脑参与的情感认知调控功能,协同额叶眶回,共同调节抑郁症患者的负性情绪。
长期针灸临床发现,耳电针治疗抑郁症有效。最近,本团队Rong等[6]用taVNS盲法治疗轻中度抑郁症8周明显缓解了抑郁症状;其中部分受试者接受fMRI检查发现,经过4周的耳电针治疗,默认网络和额叶眶回FC增加,且与HAMD-24的减分率明显相关[35]。在Li等[36]首次报道了一例taVNS治疗TRD 8周有效后,许等[9]进一步扩大样本发现对保持药物治疗的TRD具有明显增效效应,且不良反应较少。本研究经过30 min的即刻刺激后初步发现额叶眶回脑自发活动发生改变,提示在TRD患者情绪调节网络对耳电针刺激较为敏感,且与长期治疗脑功能变化相关脑区一致,由此可推测耳电针对TRD患者的即刻调节作用可能是长期治疗的基础,但小脑在长期治疗中的效应值得进一步探讨。
本研究存在以下不足:研究样本量较少,结果可能存在偏倚;其次即刻调节引起变化的脑区较少,与长期治疗后的脑区可能存在一定差异,需要一定周期的治疗才能全面地发现并总结耳电针对TRD患者脑区功能的调节作用。在未来的研究中,将进一步扩大样本量,行随机对照研究,运用多种功能影像研究方法,进一步探讨耳电针对TRD患者的疗效脑机制。
综上所述,本研究结合多种分析方法初步研究了静息态下TRD患者局部脑功能差异脑区以及局部差异脑区与全脑功能连接的特点,结果显示TRD患者存在边缘系统-皮层-纹状体-苍白球-丘脑神经环路脑功能活动异常,其中认知和运动区相关脑区可能与TRD患者的负性情绪有关;同时这也是第一个探索耳电针可即刻调节TRD患者的脑自发活动的研究,结果涉及前额叶眶回、小脑等情感及认知相关脑区,结合既往研究发现,推测这些脑区可能是耳电针长期治疗TRD患者有效的脑功能效应靶点。
National Key Research and Development Program of China (No. 2018YFC1705802); National Natural Science Foundation of China (No. 81774433); China Academy of Chinese Medical Sciences (CACMS) 2019 'One Belt And One Road' International Cooperation Special Project (No. GH201912).
全部作者声明不存在利益冲突。



























