
探讨应用超微超顺磁性氧化铁纳米颗粒(ultra-micro superparamagnetic iron oxide nanoparticle,USPIO)标记小鼠巨噬细胞株RAW264.7的最适浓度以及比较MRI中不同扫描序列在细胞吞噬功能评价中的敏感度差别。
用终浓度为0、25、50、75、100、125 μg/mL的USPIO分别与小鼠巨噬细胞共培养24 h后,细胞计数试剂法(CCK-8)计算细胞存活率以及USPIO对该细胞的半数抑制浓度(IC50);光学显微镜下观察细胞形态学变化;普鲁士蓝染色确认细胞对USPIO的吞噬效应;3.0 T MRI扫描细胞-琼脂糖凝胶模型,记录T1WI和T2WI序列的弛豫时间和弛豫率并计算弛豫时间降低率。
当USPIO浓度为25 μg/mL时,对细胞的存活率无影响,差异无统计学意义(P>0.05);当USPIO浓度≥50 μg/mL时,细胞存活率随USPIO浓度增加显著降低(P均<0.05);USPIO对细胞的半数抑制浓度IC50为(186.5±7.2) μg/mL;当USPIO浓度为50 μg/mL时,细胞形态开始皱缩、透光度减低;当USPIO浓度为25 μg/mL时,普鲁士蓝染色呈显著阳性;MRI显示,与对照组相比,当USPIO浓度为25 μg/mL时,细胞即见显著信号改变;随USPIO浓度增加,T1、T2弛豫时间显著缩短(P均<0.01),对应弛豫率R1、R2逐渐升高;相同USPIO浓度下,各组T2弛豫时间降低率显著高于T1弛豫时间降低率(P均<0.001)。
浓度为25 μg/mL的USPIO对细胞没有明显毒性作用,而且标记效率高、MRI即见显著信号改变与较好的成像效果,为标记巨噬细胞的最适浓度;MRI能用于细胞标记后的体外成像,T2WI序列在检测细胞吞噬USPIO后的信号变化优于T1WI序列。

本刊刊出的所有论文不代表本刊编委会的观点,除非特别声明
巨噬细胞趋化是其发挥吞噬功能的前提[1],在肿瘤免疫耐受的进程中,肿瘤细胞常常通过控制迁移来“驯化”巨噬细胞实现免疫逃逸[2, 3]。细胞标记技术是了解细胞在体内迁移路径的重要手段[4, 5]。超微超顺磁性氧化铁纳米颗粒(ultra-micro superparamagnetic iron oxide nanoparticle,USPIO)作为小分子(直径5~40 nm)的磁性纳米颗粒,因具有良好的生物相容性及多能性,被越来越多地应用于细胞标记[6, 7]。高浓度的USPIO有助于优质细胞MRI图像的获取,然而研究表明,USPIO对细胞也具有一定的毒性作用[8, 9]。Ohki等[10]使用USPIO标记脐带间充质干细胞 (UC-MSCs),发现标记浓度为100 μg/mL时细胞的增殖能力显著降低。然而对于巨噬细胞RAW264.7的USPIO标记浓度的研究目前尚无相关文献报道,因此在开展巨噬细胞活体示踪前,有必要优化USPIO的标记浓度。本实验检测了既能获得较好MRI图像又能使巨噬细胞毒性作用最小的最佳USPIO标记浓度,也探讨了不同MRI成像序列检测USPIO标记细胞的信号变化的敏感度,为进一步开展基于USPIO标记的细胞活体示踪提供了理论依据。
小鼠巨噬细胞株RAW264.7细胞购自中国科学院上海细胞库,高糖DMEM (Dulbecco's Modified Eagle Media)购自以色列BI公司,胎牛血清(fetal bovine serum,FBS)购自美国Gibco公司,USPIO (粒径5 nm,货号:725331)购自美国Sigma-Aldrich公司,CCK-8试剂盒购自江苏凯基生物公司,普鲁士蓝染液购自北京雷根生物公司,酶标仪购自美国Bio-Rad公司,正倒置一体荧光显微镜购自美国Echo-labs公司。
小鼠巨噬细胞株RAW264.7用含10% FBS的DMEM培养液常规培养,待细胞覆盖率至80%~90%时传代。
制备细胞悬液,按每孔103个细胞接种于96孔板,每孔加入100 μL培养液,次日各孔加入USPIO至终浓度分别为25、50、75、100、125 μg/mL,以0 μg/mL孔作为对照组,培养基-无细胞组作为空白对照,各组设3个复孔,常规培养24 h。按 CCK-8试剂盒说明,加入CCK-8液,37 ℃孵育1 h,用酶标仪测定波长为450 nm处细胞的吸光度(absorbance,OD),计算细胞存活率及IC50。细胞存活率=(实验组吸光度-空白组吸光度)/(对照组吸光度-空白组吸光度)×100%。IC50即细胞存活率为50%时对应的USPIO浓度。
对USPIO终浓度为0 μg/mL与25 μg/mL的细胞按试剂盒说明分别行普鲁士蓝染色。根据是否出现蓝染细胞(含有Fe3+的细胞被染成蓝色,而正常细胞被普鲁士蓝染液染成红色)及蓝染细胞的比例评价细胞吞噬效果。
将巨噬细胞消化后计数,按每孔105个细胞接种于6孔板,并加入2 mL培养液,次日加入USPIO至终浓度分别为0、25、50、75、100、125 μg/mL,继续培养24 h。消化收集细胞,每孔取106个细胞,固定于含2 mL煮沸的1%琼脂糖凝胶的EP管中混匀,待凝固后行MRI扫描。
使用美国GE公司SIGNA HDxt 3.0 T超导MR扫描仪和48通道AIR头部线圈行冠状位扫描。扫描序列为Magic序列,层厚5 mm,层间距0.2 mm,矩阵320×320,FOV 24 mm×24mm;T1WI:TR 500 ms,TE 10 ms;T2WI:TR 4500 ms,TE 100 ms。扫描完成后,由一名经验丰富的高年资主任技师以盲法使用MAGIC软件在获得的图像上分别沿各管内径勾画感兴趣区,每个扫描序列选取3个层面分别测量弛豫时间与弛豫率,最终数据取平均值,重复测量3次。计算弛豫时间降低率=(对照组弛豫时间-实验组弛豫时间)/对照组弛豫时间×100%评价不同扫描序列的敏感度。
使用SPSS 23.0软件进行统计分析,测得的数据计量资料用±s表示。不同USPIO浓度下细胞存活率、弛豫时间变化分别与对照组的比较采用Dunnett-t检验;相同USPIO浓度下,弛豫时间降低率的比较采用两独立样本t检验。P<0.05表示差异有统计学意义。
与对照组相比,当USPIO浓度≥50 μg/mL时,RAW264.7细胞CCK-8检测的吸光度值随USPIO浓度增加而显著减低,提示细胞存活率与USPIO浓度反相关,差异有统计学意义(P均<0.01) (表1,图1)。USPIO对巨噬细胞的IC50为(186.5±7.2) μg/mL,提示细胞在低于该浓度范围的USPIO中耐受性较好。
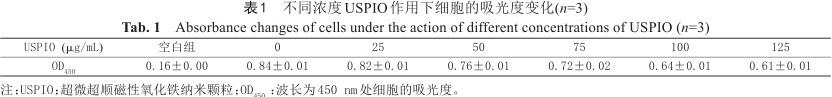
不同浓度USPIO作用下细胞的吸光度变化(n=3)
Absorbance changes of cells under the action of different concentrations of USPIO (n=3)
不同浓度USPIO作用下细胞的吸光度变化(n=3)
Absorbance changes of cells under the action of different concentrations of USPIO (n=3)
| USPIO (μg/mL) | 空白组 | 0 | 25 | 50 | 75 | 100 | 125 |
|---|---|---|---|---|---|---|---|
| OD450 | 0.16±0.00 | 0.84±0.01 | 0.82±0.01 | 0.76±0.01 | 0.72±0.02 | 0.64±0.01 | 0.61±0.01 |
注:USPIO:超微超顺磁性氧化铁纳米颗粒;OD450:波长为450 nm处细胞的吸光度。
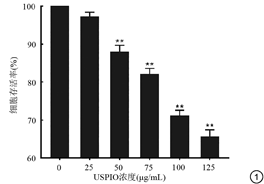

与对照组相比,光学显微镜下观察发现,当USPIO浓度为25 μg/mL时,细胞形态无明显改变;而当USPIO浓度≥50 μg/mL时,细胞明显皱缩、透光度减低(图2)。表明USPIO浓度≥50 μg/mL时,对细胞即有毒性作用。

与对照组相比,USPIO浓度为25 μg/mL时光镜下可见大量蓝染细胞,即普鲁士蓝染色阳性(图3)。提示细胞在USPIO浓度为25 μg/ml时仍具有强大的吞噬能力。
3.0 T MRI显示,USPIO浓度为25 μg/mL时,细胞即见显著T1高信号与T2低信号;USPIO浓度越高,信号改变越显著(图4);随USPIO浓度增加,T1和T2弛豫时间均明显缩短(P均<0.01) (表2),对应弛豫率R1和R2均呈逐渐上升趋势(图5)。在相同USPIO浓度下,T2弛豫时间降低率明显高于T1弛豫时间变化率(P均<0.001) (图6),提示T2WI序列对基于USPIO的细胞MRI更敏感。


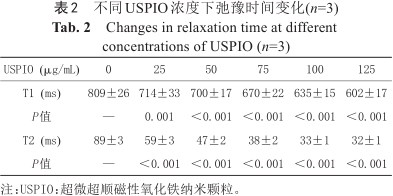
不同USPIO浓度下弛豫时间变化(n=3)
Changes in relaxation time at different concentrations of USPIO (n=3)
不同USPIO浓度下弛豫时间变化(n=3)
Changes in relaxation time at different concentrations of USPIO (n=3)
| USPIO (μg/mL) | 0 | 25 | 50 | 75 | 100 | 125 |
|---|---|---|---|---|---|---|
| T1 (ms) | 809±26 | 714±33 | 700±17 | 670±22 | 635±15 | 602±17 |
| P值 | — | 0.001 | <0.001 | <0.001 | <0.001 | <0.001 |
| T2 (ms) | 89±3 | 59±3 | 47±2 | 38±2 | 33±1 | 32±1 |
| P值 | — | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 |
注:USPIO:超微超顺磁性氧化铁纳米颗粒。
本研究首先观察了USPIO浓度对细胞存活率与形态的影响,证实了25 μg/mL为USPIO标记小鼠巨噬细胞的安全浓度。普鲁士蓝染色显示该安全浓度下细胞仍能够吞噬大量的USPIO颗粒,且细胞体外MRI扫描可见显著信号。鉴于高浓度USPIO对细胞的毒性作用,因此确定USPIO标记巨噬细胞行MRI的最佳浓度为25 μg/mL。同时本研究首次采用弛豫时间的变化率来评价MRI扫描不同序列的敏感度,证实T2WI序列对USPIO信号检测的敏感度高于T1WI。不同细胞类型对磁性纳米颗粒的摄取能力和毒性反应浓度均不相同[10, 11]。本研究首次从成像效果和细胞活性两方面评价了USPIO标记巨噬细胞的最佳浓度,研究说明开展磁性颗粒标记的细胞示踪研究时,不应为追求高质量MRI图像而忽略了标记物对细胞的毒性作用。上述结果为后续利用MRI实时监测巨噬细胞的体内趋化轨迹和评价其免疫活性提供了重要的实验参考。
巨噬细胞作为造血系统中可塑性最强的细胞类型,广泛存在于各种组织器官中,参与了发育、稳态维持、组织修复和免疫防御等过程[12, 13]。在免疫防御过程中,巨噬细胞作为体内重要的抗原呈递细胞,能够趋化、识别和吞噬“非己”物质,如病原体和肿瘤细胞等,将其加工为特异性抗原,呈递给T淋巴细胞,诱导活化[14, 15]。然而大量研究发现,部分肿瘤细胞或病原体能够“驯化”巨噬细胞,抑制其迁移和吞噬成功实现免疫逃逸[2, 3]。因此,监测吞噬细胞的迁移路径及趋化方向对于评价巨噬细胞的活性具有重要的意义。
USPIO对细胞毒性作用受到细胞类型、USPIO标记浓度和标记时间等多方面因素的影响[16]。和其他类型的细胞相比,巨噬细胞因具有卓越的吞噬能力[17],因而对生物标记物的毒性反应更敏感。应用USPIO标记巨噬细胞时,在评价其成像效果时,必须兼顾其细胞毒性作用。以往文献大多通过台盼蓝染色评价损伤细胞比例或基于四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)的细胞增殖实验通过IC50评价药物的细胞毒性作用[18, 19, 20]。前者的结果易受镜下视野的选择和染色剂作用时间等因素的影响,而后者得出的安全浓度远高于实际安全浓度。本研究计算出的USPIO对巨噬细胞的IC50为186.5 μg/mL,理论上最大的用药浓度不得超过1/2 IC50 (93 μg/mL)。而光学显微镜下可见USPIO浓度高于25 μg/mL时,细胞即出现明显皱缩、透光度减低等毒性作用征象。因此,本研究显示,制备有活性的磁性颗粒标记细胞必须同时兼顾IC50和细胞形态学检测。
25 μg/mL是目前文献报道中USPIO标记细胞的较低浓度[10]。然而鉴于巨噬细胞强大的吞噬能力[17],普鲁士染色法显示该USPIO浓度下细胞中可见大量的蓝染颗粒,说明低浓度依然可以保证足够的USPIO进入巨噬细胞,提示USPIO标记巨噬细胞模型制备成功。
近年来活细胞体内示踪这一分子影像学的热点内容被广泛应用于细胞趋化路径的观察和评价[21],既往文献对于细胞示踪的研究大多是基于光学成像中的荧光蛋白、荧光染料等标记的体外成像[22, 23],存在着荧光穿透能力弱、特异性低、半衰期短等不足[24],难以实现长时间动态观察。巨噬细胞作为体内的清道夫细胞[25],凭借其强大的吞噬和消化能力,荧光蛋白或染料被吞噬后极易发生降解而使信号衰减[24],因此对其进行示踪较为困难。磁性纳米颗粒USPIO为纳米级的高分子材料,具有很好的生物相容性、半衰期长和可被机体降解吸收等优点,作为MRI细胞示踪剂具有很好的应用前景[6, 7]。因此本研究首次利用MRI技术对USPIO标记的巨噬细胞进行成像观察,结果显示细胞均呈现短T1短T2信号,定量检测也证实USPIO能显著缩短T1、T2弛豫时间,升高弛豫率R1、R2,该结果也与已报道文献相符[6, 7]。虽然随着USPIO浓度逐渐升高,MRI信号变化也越显著,但是绝大部分研究仅限于原位观察,未进行标记细胞活性评价,因此限制了这项技术的进一步应用。我们的研究发现,即使用较低浓度(25 μg/mL)的USPIO标记,巨噬细胞也可出现显著的信号改变,因此不应为追求标记效果而一味地选择高浓度标记,细胞一旦损伤反而会影响后续体内细胞功能的观察[26]。
USPIO作为MRI阴性对比剂[27]能显著缩短T1与T2弛豫时间,多数文献直接研究了T2WI序列的图像,而未给出T1WI序列图像[28, 29],二者对于USPIO检测MRI信号变化敏感度高低尚未报道,因此本研究首次通过比较T1与T2弛豫时间降低率高低来间接判断二者对于检测USPIO信号变化的敏感度,结果显示T2弛豫时间降低率均明显高于T1弛豫时间降低率。说明T2WI序列在检测USPIO标记细胞后信号变化的敏感度优于T1WI序列。
(1)本研究只讨论了24 h后的USPIO对巨噬细胞毒性作用,对于更长时间下的毒性作用变化尚需进一步验证;(2)本研究旨在探讨USPIO标记巨噬细胞体外成像规律,尚未应用该细胞行活体内示踪研究。今后将侧重于USPIO标记巨噬细胞细胞的活体内成像的研究。
综上所述,本研究结果确定了USPIO标记小鼠巨噬细胞株RAW264.7细胞行MRI的最佳浓度为25 μg/mL;MRI在检测USPIO标记细胞后信号变化的敏感度上T2WI序列优于T1WI序列。
National Natural Science Found of China (No. 81860538, 31860328).
全体作者均声明无利益冲突。



























