
探讨应用静息态功能磁共振成像(resting state functional magnetic resonance imaging,rs-fMRI)技术研究原发性失眠(primary insomnia,PI)患者较为一致的易损脑区,从而揭示PI脑损伤可能的神经机制。
检索2022年4月7日之前采用局部一致性(regional honogeneity,ReHo)及低频振幅/比率低频振幅/动态低频振幅(amplitude of low-frequency fluctuation/fraction amplitude of low-frequency fluctuation/dynamic amplitude of low-frequency fluctuation,ALFF/fALFF/dALFF)分析方法探讨PI患者脑功能改变的文献,按照严格的纳排标准,采用激活似然估计法(activation likelihood estimation,ALE)对既往研究中PI患者相对于健康对照组(healthy controls,HCs)自发神经活动异常的脑区进行整合分析。
共纳入19篇文献20个研究(PI 706例,HCs 681例)。结合ReHo及ALFF/fALFF/dALFF数据元分析结果显示,PI患者相对于HCs左侧梭状回和海马旁回活动增加(体素分别为3640、928 mm3,P<0.05),并未发现活动减低的脑区。单独ALFF数据元分析结果显示,PI患者相对于HCs左侧梭状回活动增加(体素为1360 mm3,P<0.05),并未发现活动减低的脑区。单独ReHo数据元分析结果显示,PI患者相对于HCs并未出现任何活动增高或减低的脑区。
本文通过ALE元分析发现PI患者较为一致的易损脑区为左侧梭状回和海马旁回,这有助于进一步从神经病理学的角度理解PI脑损伤。

本刊刊出的所有论文不代表本刊编委会的观点,除非特别声明
原发性失眠(primary insomnia,PI)是一个重要的社会健康问题,全球约33%的人都经历过失眠[1]。早醒、难以入睡、睡眠维持困难或无法恢复为其特征。睡眠不足会导致心血管疾病、认知和情感障碍[2]及肥胖[3]等各种健康问题。目前,PI患者较为一致的易损脑区尚未明确,临床治疗多以心理疗法、口服安眠药为主,但效果欠佳[4],因此需要发现治疗失眠的敏感、有效的靶区。功能磁共振成像(functional magnetic resonance imaging,fMRI)技术自1990年创立以来已广泛用于神经认知领域、心理学以及精神病学的研究。国内外学者更是应用静息态fMRI(resting state fMRI,rs-fMRI)揭示了PI患者脑功能活动变化,为PI患者的中枢生物标志物探寻提供了新的思路。然而,各研究结果并不完全一致[5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23],仍有争议,可能与病程和疾病严重程度不一、对PI未进行明确分型以及选用不同的分析方法有关。
虽然Tahmasian等[24]和Jiang等[25]分别应用激活似然估计法(activation likelihood estimation,ALE)和标记差异映射分析(signed differential mapping,SDM)对睡眠障碍患者进行了研究。但整合结果是否会因纳入了功能连接(functional connectivity,FC)、独立成分分析(independent component analysis,ICA)及脑灌注等不同的数据而不同,以及不同的分析方法是否会影响PI患者脑区生物标志物的分布仍值得进一步探讨。因为有学者[26]认为FC和ICA方法主要是研究种子点与周围脑区之间功能的相关性,与局部一致性(regional honogeneity,ReHo)、低频振幅(amplitude of low-frequency fluctuation,ALFF)、比率低频振幅(fraction amplitude of low-frequency fluctuation,fALFF)及动态低频振幅(dynamic amplitude of low-frequency fluctuation,dALFF)所反映的自发神经脑功能活动并不一致,且除非探讨的是同类网络研究,否则不适合做元分析。此外,脑灌注则是通过测量局部脑血流来反映相应脑区的代谢情况与神经活动,并不能完全反映大脑神经元自发脑功能活动状况[27]。
因此,为进一步研究PI患者较为一致的易损脑区,本研究旨在选同类数据文献以扩大研究的样本量,应用ALE元分析工具[28]计算整合后的大脑激活区域,探究PI患者的神经生物标志物。
以“原发性失眠”“原发性睡眠障碍”“局部一致性”“低频振幅”“比率低频振幅”“静息态”“功能磁共振成像”为中文检索词;以“primary insomnia” “primary insomnia disorder” “PI” “regional honogeneity” “amplitude of low-frequency fluctuation” “fraction amplitude of low-frequency fluctuation” “resting” “functional magnetic resonance” “fMRI”为英文检索词,于Web of Science、PubMed及CNKI等数据库进行检索,检索时间为自建库至2022年4月7日。为防止遗漏,对已有综述或元分析文献的参考文献补充检索获得原始数据,并导入EndNote X9文献管理工具中进行筛选。
纳入标准:(1)所纳入文献中的PI诊断标准均符合第Ⅳ版或第Ⅴ版《精神障碍诊断和统计手册》;(2)早醒、难以入睡或睡眠维持困难1个月以上;(3)所纳入文献均为PI患者与健康对照组(healthy controls,HCs)在rs-fMRI下大脑功能活动组间差异的全脑分析;(4)采用ReHo和(或) ALFF/fALFF/dALFF的分析方法;(5) PI患者相对于HCs差异脑区结果必须以蒙特利尔神经学研究所(Montreal Neurological Institute,MNI)或Talairach三维峰值坐标呈现。排除标准:(1)采用FC、小世界、度中心度、默认模式网络及其他网络等rs-fMRI方法研究的文献;(2)文献类型为元分析、综述及个案报道;(3)三维空间峰值坐标不明。
采用纽卡斯尔-渥太华量表(Newcastle-Ottawa Scale,NOS)[29]对纳入的文献进行质量评价。NOS有3个层面,共8个条目:(1)研究对象选择4个条目;(2)组间可比性1个条目;(3)结果测量3个条目。总分为9分。若结果≥5分,则可纳入进行数据分析。
背景信息:研究设计类型、第一作者、发表年份、受试者样本量、年龄及文化程度;rs-fMRI信息:磁共振扫描设备机型和场强、所用的分析软件和分析方法、PI相对于HCs差异脑区的个数以及结果呈现的中心坐标。
ALE元分析方法基于GingerALE 3.0.2分析工具(www.brainmap.org/ale)。本研究在MNI标准空间下进行,因此,需要将以Talairach空间标准报告的坐标通过Ginger ALE 3.0.2内置插件(Lancaster转换)将Talairach坐标转换成MNI坐标。随后根据该研究组的激活坐标集,进行三维高斯模型,得到ALE地图,基于高斯模型计算脑区激活概率P值,构建3D-P值分布图。基于3D-P值分布图设定统计检验阈值,设定参数如下:错误发现率(false-discovery rate,FDR) P<0.05,体素大小>200 mm3,最终得到阈值图(ALE-image)。最后使用Mango软件(http://rii.uthscsa.edu/mango/)查看分析得到的ALE结果阈值图。
采用Jackknife敏感性分析方法对元分析结果的可重复性进行检测,每次剔除1项研究后,对剩余研究的数据使用Ginger ALE 3.0.2软件进行ALE元分析,重复19次这样的操作,查看剔除某项研究后的结果与原结果的可重复性。
基于以上纳排标准,对检索出的522篇文献进行筛选:剔除67篇重复文献、356篇不相关文献、22篇FC、14篇默认网络及其他网络研究、2篇小世界、2篇度中心度研究、13篇综述和元分析、1篇个案报道、25篇经过治疗后的研究以及1篇数据重复使用,最终纳入19篇文献[5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23](图1)。其中有1篇分别采用ReHo及ALFF方法对同一组PI患者和HCs进行研究[23],另有2篇ALFF采用Slow-4和Slow-5频段对同一组PI患者和HCs进行研究[8,17]。本文将这些研究结果分别纳入到元分析中,最终纳入20个研究,包括9个ReHo研究、7个ALFF研究、3个fALFF研究及1个dALFF研究。
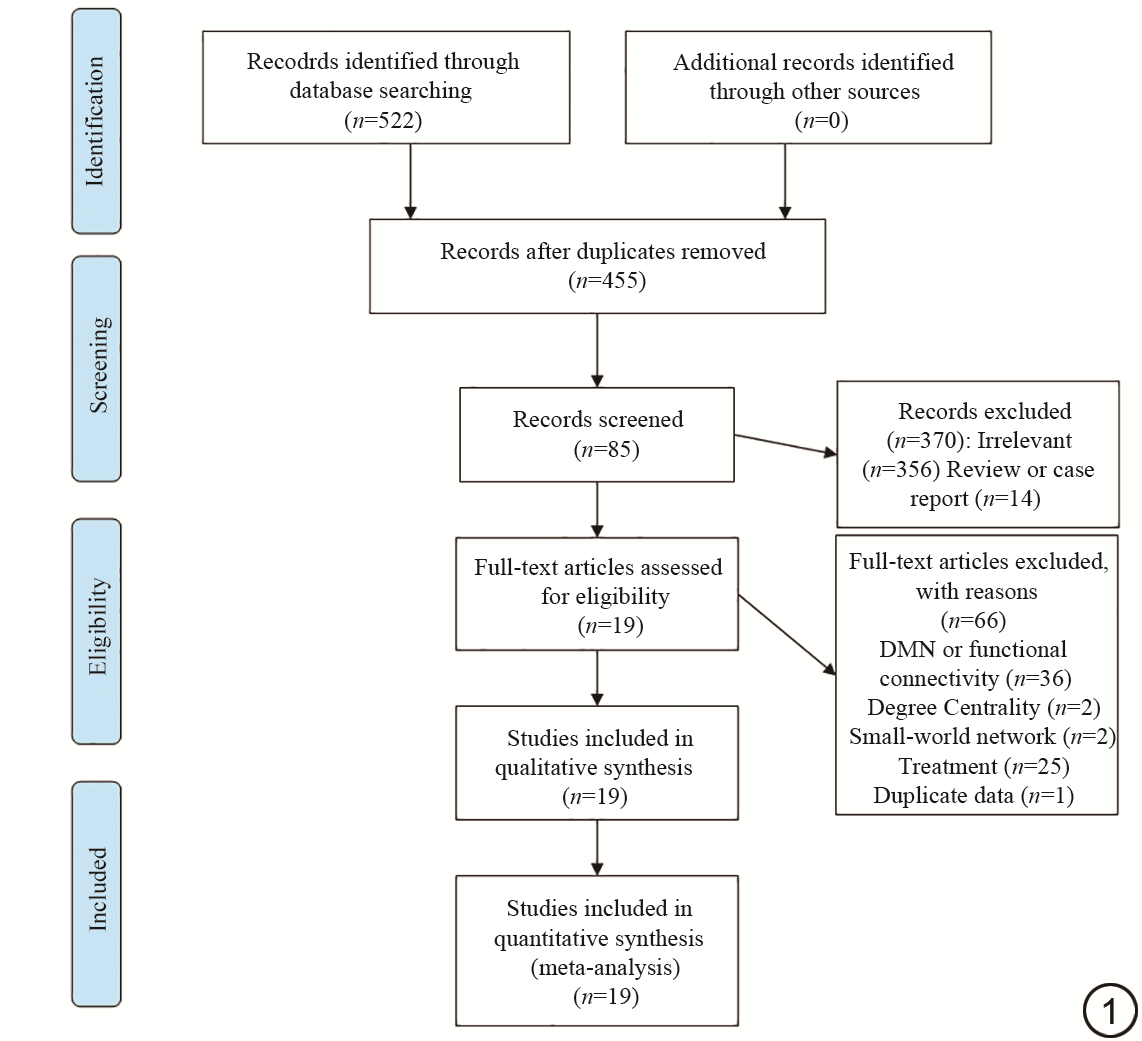

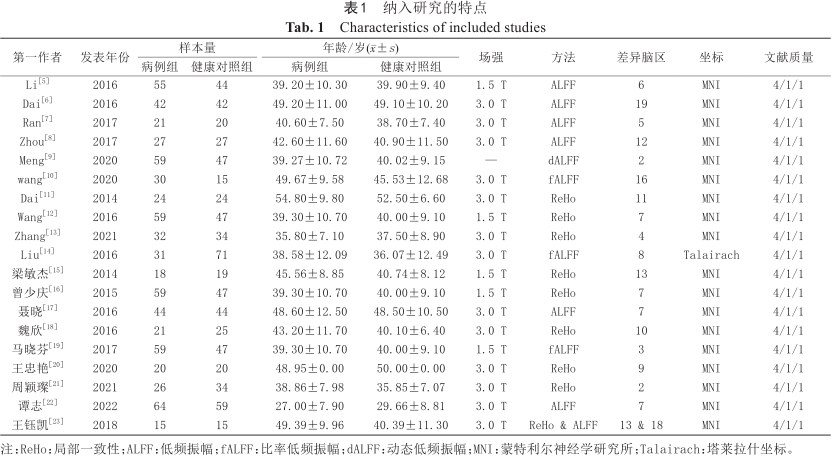
共提取PI患者706名,HCs 681名。ReHo差异脑区76个、ALFF差异脑区74个、fALFF差异脑区27个、dALFF差异脑区2个,共计179个。所纳入文献特征见表1。
纳入研究的特点
Characteristics of included studies
纳入研究的特点
Characteristics of included studies
| 第一作者 | 发表年份 | 样本量 | 年龄/岁(±s) | 场强 | 方法 | 差异脑区 | 坐标 | 文献质量 | ||
|---|---|---|---|---|---|---|---|---|---|---|
| 病例组 | 健康对照组 | 病例组 | 健康对照组 | |||||||
| Li[5] | 2016 | 55 | 44 | 39.20±10.30 | 39.90±9.40 | 1.5 T | ALFF | 6 | MNI | 4/1/1 |
| Dai[6] | 2016 | 42 | 42 | 49.20±11.00 | 49.10±10.20 | 3.0 T | ALFF | 19 | MNI | 4/1/1 |
| Ran[7] | 2017 | 21 | 20 | 40.60±7.50 | 38.70±7.40 | 3.0 T | ALFF | 5 | MNI | 4/1/1 |
| Zhou[8] | 2017 | 27 | 27 | 42.60±11.60 | 40.90±11.50 | 3.0 T | ALFF | 12 | MNI | 4/1/1 |
| Meng[9] | 2020 | 59 | 47 | 39.27±10.72 | 40.02±9.15 | — | dALFF | 2 | MNI | 4/1/1 |
| wang[10] | 2020 | 30 | 15 | 49.67±9.58 | 45.53±12.68 | 3.0 T | fALFF | 16 | MNI | 4/1/1 |
| Dai[11] | 2014 | 24 | 24 | 54.80±9.80 | 52.50±6.60 | 3.0 T | ReHo | 11 | MNI | 4/1/1 |
| Wang[12] | 2016 | 59 | 47 | 39.30±10.70 | 40.00±9.10 | 1.5 T | ReHo | 7 | MNI | 4/1/1 |
| Zhang[13] | 2021 | 32 | 34 | 35.80±7.10 | 37.50±8.90 | 3.0 T | ReHo | 4 | MNI | 4/1/1 |
| Liu[14] | 2016 | 31 | 71 | 38.58±12.09 | 36.07±12.49 | 3.0 T | fALFF | 8 | Talairach | 4/1/1 |
| 梁敏杰[15] | 2014 | 18 | 19 | 45.56±8.85 | 40.74±8.12 | 1.5 T | ReHo | 13 | MNI | 4/1/1 |
| 曾少庆[16] | 2015 | 59 | 47 | 39.30±10.70 | 40.00±9.10 | 1.5 T | ReHo | 7 | MNI | 4/1/1 |
| 聂晓[17] | 2016 | 44 | 44 | 48.60±12.50 | 48.50±10.50 | 3.0 T | ALFF | 7 | MNI | 4/1/1 |
| 魏欣[18] | 2016 | 21 | 25 | 43.20±11.70 | 40.10±6.40 | 3.0 T | ReHo | 10 | MNI | 4/1/1 |
| 马晓芬[19] | 2017 | 59 | 47 | 39.30±10.70 | 40.00±9.10 | 1.5 T | fALFF | 3 | MNI | 4/1/1 |
| 王忠艳[20] | 2020 | 20 | 20 | 48.95±0.00 | 50.00±0.00 | 3.0 T | ReHo | 9 | MNI | 4/1/1 |
| 周颖璨[21] | 2021 | 26 | 34 | 38.86±7.98 | 35.85±7.07 | 3.0 T | ReHo | 2 | MNI | 4/1/1 |
| 谭志[22] | 2022 | 64 | 59 | 27.00±7.90 | 29.66±8.81 | 3.0 T | ALFF | 7 | MNI | 4/1/1 |
| 王钰凯[23] | 2018 | 15 | 15 | 49.39±9.96 | 40.39±11.30 | 3.0 T | ReHo & ALFF | 13 & 18 | MNI | 4/1/1 |
注:ReHo:局部一致性;ALFF:低频振幅;fALFF:比率低频振幅;dALFF:动态低频振幅;MNI:蒙特利尔神经学研究所;Talairach:塔莱拉什坐标。
结合ReHo及ALFF/fALFF/dALFF数据元分析结果显示,PI患者相对于HCs左侧梭状回和海马旁回活动增高(见表2、图2),并未发现活动减低的脑区。分别对ReHo及ALFF/fALFF方法进行单独元分析:ALFF数据元分析结果显示,PI患者相对于HCs左侧梭状回活动增高(见表2、图3),并未发现活动减低的脑区;ReHo数据元分析结果显示,PI患者相对于HCs并未出现任何活动增高或减低的脑区。
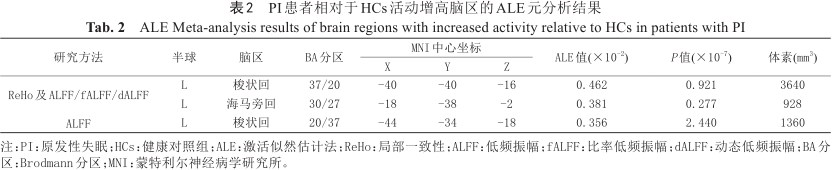
PI患者相对于HCs活动增高脑区的ALE元分析结果
ALE Meta-analysis results of brain regions with increased activity relative to HCs in patients with PI
PI患者相对于HCs活动增高脑区的ALE元分析结果
ALE Meta-analysis results of brain regions with increased activity relative to HCs in patients with PI
| 研究方法 | 半球 | 脑区 | BA分区 | MNI中心坐标 | ALE值(×10-2) | P值(×10-7) | 体素(mm3) | ||
|---|---|---|---|---|---|---|---|---|---|
| X | Y | Z | |||||||
| ReHo及ALFF/fALFF/dALFF | L | 梭状回 | 37/20 | -40 | -40 | -16 | 0.462 | 0.921 | 3640 |
| L | 海马旁回 | 30/27 | -18 | -38 | -2 | 0.381 | 0.277 | 928 | |
| ALFF | L | 梭状回 | 20/37 | -44 | -34 | -18 | 0.356 | 2.440 | 1360 |
注:PI:原发性失眠;HCs:健康对照组;ALE:激活似然估计法;ReHo:局部一致性;ALFF:低频振幅;fALFF:比率低频振幅;dALFF:动态低频振幅;BA分区:Brodmann分区;MNI:蒙特利尔神经病学研究所。
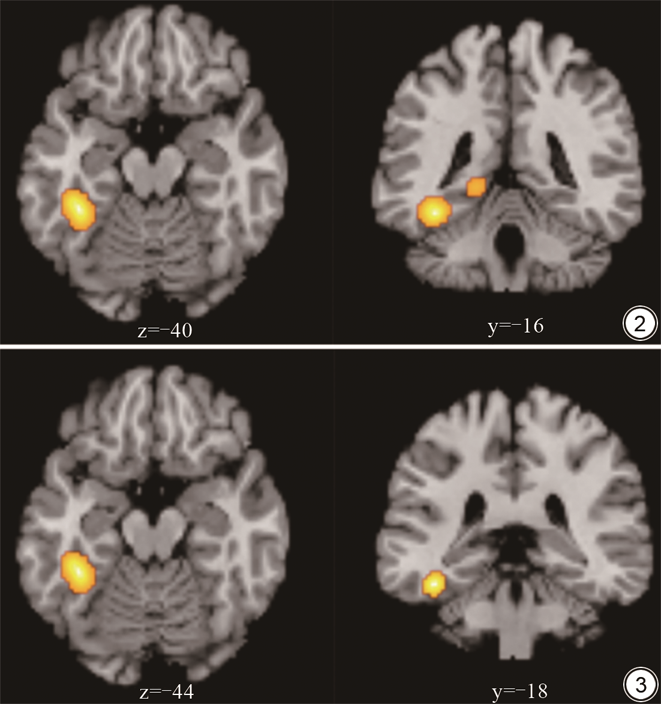

左侧梭状回和海马旁回在20次分析中重复性均达到了17次。
本研究采用ALE元分析方法探讨了应用rs-fMRI技术研究PI患者相对于HCs大脑活动改变的脑区,元分析结果显示,PI患者易损脑区主要分布于左侧梭状回和左侧海马旁回。本元分析通过对以往研究的整合分析,获得PI患者脑功能活动改变较为一致的脑区,揭示了PI脑损伤可能的神经影像学机制,从而为临床提供治疗失眠特异的靶向区域。
梭状回和海马旁回属于边缘系统的一部分,梭状回在高空间频率刺激的感知、负面情绪加工、整合视觉信号、介导空间工作记忆等功能中起重要的整合作用,而海马旁回在负面情绪加工、处理视觉空间信息和情景记忆等功能中起同等重要的作用,其激活可概括为视听觉叙事中嵌入的空间信息[30, 31, 32, 33, 34, 35, 36, 37]。本研究发现PI患者左侧梭状回和海马旁回活动增高,推测可能与PI患者处于高觉醒状态有关,此外,因为PI患者的大量心理活动影响了睡眠的起始或维持,从而导致PI患者睡眠期间出现学习、注意力和工作记忆等功能受损和记忆形成缺陷[38],这也与睡眠障碍的高唤起理论一致,进一步验证了梭状回和扣海马旁回在PI中的重要性。Dai等[11]发现PI患者左侧梭状回与匹兹堡睡眠指数量表显著相关。Yu[39]也报道了PI患者右侧眶额皮质和梭状回的皮质厚度与失眠的严重程度呈正相关性,这说明梭状回的功能和结构改变与PI的严重程度有关。Gong等[40]验证了海马旁回与失眠症状有关。最近的一项研究[41]发现PI患者左侧杏仁核与双侧海马旁回的FC增强可能是PI患者出现认知、情绪调节障碍的机制之一,这从功能整合角度为PI患者的情绪唤醒理论提供了证据。
本元分析出现左侧梭状回和海马旁回活动增高的必然性在于:首先,在本研究纳入的19项研究(PI 706名,HCs 681名)中,样本量足够大;其次,左侧梭状回的活动增高在3项研究(PI 66名,HCs 66名)中出现[8,11,23],左侧海马旁回的活动增高在4项研究(PI 146名,HCs 119名)中出现[6,9,10,23];最后,ALFF值在左侧梭状回[8,23]和海马旁回[6,23]中增高的研究各占了两项,因此在提取中心坐标(活动脑区的位置信息)时比较集中,即坐标信息足够让此脑区显现出来。此外,ALE元分析作为一种概率分布,报告了较多激活点的研究对元分析的影响更大,进而使研究结果落在与激活点接近脑区的概率就更大,这可能是出现此结果的一个偶然因素。
入睡是从清醒到睡眠的一系列心理生理变化的复杂过程转变,其特点是大脑对外部刺激的反应能力逐渐降低,行为平静度增加[42]。本元分析结果表明,PI患者功能网络的改变或失衡集中在视觉认知网络(左侧梭状回活动增加)、情绪调节(左侧海马旁回活动增加)方面。从神经影像学的角度来看,这些改变的功能网络可作为潜在的治疗靶点,如经皮耳廓迷走神经刺激可以减轻PI患者感觉运动网络的过度激活,重新平衡睡眠稳态,改善PI患者的睡眠质量和延长睡眠时间[43, 44]。重复经颅磁刺激可以改善睡眠质量、优化睡眠结构并在更大程度上保持治疗效果[45]。因为失眠是精神障碍发作的预测因素[46],并且情绪调节困难的个体则容易出现失眠[47],所以对失眠的治疗提供了预防重度抑郁症发作的关键机会[48]。
本元分析方法通过增加样本量、改进纳排标准(只纳入反映大脑自发神经活动改变的文献)得出左侧梭状回和海马旁回的活动增高。然而,Jiang等[25]基于SDM元分析发现异常活动(活动增高)出现在右侧海马旁回和左侧扣带回/扣带回旁回脑区,而在右侧小脑和左侧额上回/眶内侧回的活动减少。本研究未得出以上结果,可能的原因是:采用了不同的元分析软件;本研究纳入文献提取的中心坐标(活动脑区的位置信息)过于分散或者是数量过少从而没有满足阈值,因此没有显现出来;本研究各样本既存在性别、年龄、文化程度以及病程等方面的差异,亦有疾病的严重程度与其对日间功能的损害情况存在差异,也可能会导致研究结果不同。此外,Tahmasian等[24]基于ALE元分析没有发现异常活动的脑区,可能是由于没有纳入足够的文献导致样本量不足;也有可能是与他们的研究不仅纳入了ReHo、ALFF、FC、ICA,还纳入了t-fMRI、VBM和PET有关,因为t-fMRI、PET、VBM与rs-fMRI(ReHo、ALFF、FC、ICA)的试验设计、数据预处理以及统计方法不完全相同,所以导致没有发现异常活动的脑区。
本元分析尚未发现PI患者脑区有活动减低,这可能与纳入研究中报道的活动减低脑区比较少有关。所纳入19个研究中,有16个研究报道了活动减低的脑区,其中就有5个研究异常活动脑区的中心坐标均小于3个。而且,ALE元分析作为一种概率分布,报告了较多激活点的研究对元分析的影响更大,分析过程中若坐标较少可能导致不能满足阈值,或这些活动脑区的位置信息过于分散,不能使研究结果落在与激活点接近的脑区[27],这也可能是单独对ReHo进行元分析为什么没有出现任何活动增高或减低脑区的原因。因此,PI患者相对于HCs是否有活动减低的脑区以及单独对ReHo进行元分析是否有活动增高或减低的脑区还有待进一步探讨。
虽然本文较之前的元分析更能反映PI患者大脑自发神经活动改变,但仍存在局限性。(1)本研究采用了较为严格的排除标准,排除了通过药物或针刺治疗的文章,导致最终纳入分析的文献较少;(2)纳入研究的样本量尚有欠缺,这些文献中只有3个研究采用了fALFF分析方法,只有1个研究采用了dALFF分析方法,fALFF和dALFF的研究数量太少从而不能单独做Meta分析,(3) ALE元分析不仅忽略了研究间的变异,也没有考虑到激活的强度,这可能导致激活强度不高的脑区被遗漏。然而,脑成像的ALE元分析方法具有对不同研究中位置信息整合的优点,未来可应用ALE元分析方法探讨某种疾病的患者脑功能活动改变较为一致的脑区。
综上所述,本文通过ALE元分析发现PI患者较为一致的易损脑区为左侧梭状回和海马旁回,有助于从神经影像学的角度进一步理解PI脑损伤。
Gansu Science and Technology Support Program (No. 18JR2FA001); Major Project of Education Department in Gansu Province (No. LCCX2021001).
全体作者均声明无利益冲突。



























