
探讨多参数MRI中子宫肌瘤患者高强度聚焦超声(high intensity focused ultrasound, HIFU)术后无再干预危险因素,建立无再干预概率列线图预测模型。
回顾性分析川北医学院附属医院2016年3月至2017年12月期间诊断为子宫肌瘤并行HIFU治疗的患者MRI影像资料及临床特征。通过电话随访的方式了解患者HIFU术后再干预治疗情况。使用Kaplan-Meier、Cox比例风险回归筛选出子宫肌瘤HIFU术后再干预的独立危险因素;应用R软件建立预测子宫肌瘤HIFU术后3年、5年的无再干预概率的列线图模型,并验证其预测性能。
共纳入191例患者,术后再干预率为23.6%(45/191),单因素分析显示,年龄、肌瘤体积、T2WI信号类型、T1WI强化类型、标准表观扩散系数(standard apparent diffusion coefficient, StandardADC)值、慢速表观扩散系数(SlowADC)值为潜在危险因素。多因素Cox比例风险回归分析结果显示,年龄、T2WI信号类型、T1WI强化类型、SlowADC值是子宫肌瘤HIFU术后的独立预后因素,依此建立的列线图C-index为0.745(95%置信区间为0.672~0.818)。3年和5年受试者工作特征(receiver operating characteristic, ROC)曲线下面积(area under the curve, AUC)分别为0.833、0.749,校准曲线也证实模型与实际再干预情况的一致性较好。
基于MRI多参数指标与临床特征可预测子宫肌瘤HIFU术后3年、5年的再干预情况,可为临床个性化治疗提供参考依据。

本刊刊出的所有论文不代表本刊编委会的观点,除非特别声明
子宫肌瘤(uterine leiomyoma)是女性生殖系统最常见的良性肿瘤,育龄期女性患病率约20%~25%[1]。常见临床症状包括月经量过多、不孕、流产、胎儿生长受限等,影响育龄期女性身心健康及优生优育。传统治疗方式包括子宫切除术、子宫肌瘤剜除术等,存在麻醉风险、术后恢复时间较长等缺点。子宫动脉栓塞术(uterine artery embolization, UAE)、腹腔镜子宫肌瘤剔除术等微创手术一定程度降低了手术创伤,但仍存在影响卵巢功能、术后粘连等风险[2, 3]。高强度聚焦超声(high intensity focused ultrasound, HIFU)具有无手术切口、术后恢复快和保留生育能力等特点,逐渐成为子宫肌瘤患者的首选治疗手段[4, 5]。从理论上讲,任何一种保留子宫的治疗手段,都存在子宫肌瘤复发和再次干预治疗的可能。子宫与直肠、膀胱、回肠等空腔脏器毗邻,在HIFU消融治疗的过程中,为了尽量避免对毗邻脏器、组织的损伤,可能会存在对肌瘤边缘组织消融不彻底的情况,部分子宫肌瘤患者HIFU消融术后出现症状性复发或肌瘤再生长等,需要进行再次治疗。随着接受HIFU治疗患者数量的增加及随访时间的延长,再干预的比例明显上升[6, 7]。早期识别再干预高风险人群是降低子宫肌瘤HIFU术后复发、促进症状缓解的重要手段。有必要以是否再干预作为长期随访结局指标来筛选子宫肌瘤HIFU术后再干预治疗的高危因素。临床上用于预测子宫肌瘤HIFU疗效的手段有计算机体层摄影(computed tomography, CT)增强、超声造影(contrast-enhanced ultrasound, CEUS)和磁共振成像(magnetic resonance imaging, MRI)等,MRI凭借其软组织分辨率高、无电离辐射及多参数、多方位成像等优点,成为了HIFU治疗子宫肌瘤疗效评价的重要手段[8]。目前国内外多项研究将多参数MRI应用于HIFU治疗子宫肌瘤的术前疗效预测[9, 10]、手术安全性评估[11]、术中监测[12]以及术后疗效评估[13, 14],而术后再干预[15]或肌瘤局部复发[16, 17]的影响因素多结合临床指标和单一MRI参数特点来判定[18, 19],预测效能并不稳定。尚未见基于多参数MRI评估子宫肌瘤HIFU术后再干预危险因素的文献报道。本研究对HIFU治疗后的子宫肌瘤患者进行了回顾性队列分析,探索建立子宫肌瘤患者HIFU术后无再干预概率预测模型,为临床医生精确预测子宫肌瘤患者HIFU治疗预后,制订个性化治疗方案提供参考依据。
本研究为回顾性队列研究,获得川北医学院附属医院伦理委员会的批准,免除受试者知情同意,伦理批件号:2021ER197-1。连续收集2016年3月至2017年12月期间在我院行HIFU治疗的子宫肌瘤患者病例,经纳入标准与排除标准筛选后,最终有191例患者病例被纳入本次研究。纳入标准:(1)经MRI或超声检查确诊为子宫肌瘤并行HIFU治疗的患者;(2)治疗前一周内行MRI检查;(3)治疗的肌瘤为单发肌瘤或多发肌瘤中最大的肌瘤;(4)育龄期女性;(5)临床资料完整。排除标准:(1)子宫肌瘤可疑恶变;(2)子宫或盆腔合并急性感染;(3)合并子宫或盆腔恶性肿瘤;(4)合并内分泌系统疾病、血液系统疾病;(5)HIFU治疗后因非肌瘤相关原因进行子宫肌瘤再次干预治疗。
采用GE 3.0 T超导全身磁共振扫描仪(Discovery MR750,GE Medical Systems, Milwaukee, Wis, USA)。患者检查前适度饮水或排尿保持膀胱轻度充盈状态。扫描序列、参数如下:(1)横轴位T1WI序列,TR 4.12 ms,TE 1.74 ms,FOV 38 cm×38 cm,矩阵384×256,翻转角15°~20°,层厚5 mm,层距1 mm,激励次数0.75。(2)横断位、矢状位T2WI扫描快速反转自旋回波(fast recovery fast spin echo, FRFSE)序列,TR 5050 ms,TE 120 ms,FOV 38 cm×38 cm,矩阵384×256,翻转角90°,层厚5 mm,层距1 mm,激励次数2。(3)动态增强采用基于T1WI的三维肝脏扰向内插快速采集(3D-LAVA-Flex-T1WI)序列行多期动态增强扫描,经肘静脉高压注射对比剂钆双胺注射液,注射18 s后开始扫描,TR 4.12 ms,TE 1.74 ms,FOV 38 cm×38 cm,矩阵268×224,翻转角15°~20°,层厚5 mm,层距1 mm,激励次数0.70。体素内不相干运动扩散加权成像(intravoxel incoherent motion diffusion-weighted imaging, IVIM-DWI)序列采用横断位扫描,TR 5100 ms,TE 128 ms,FOV 42 cm×42 cm,矩阵128×192,激励次数8,层厚5 mm,层间距0,梯度因子b值选择为0、10、20、50、100、800、1000、1500 s/mm2。所有患者每次检查均采用相同的序列和参数进行,HIFU治疗前一周内进行MRI检查。
记录肌瘤类型(黏膜下、肌壁间、浆膜下),肌瘤位置(前壁、侧壁、后壁、底壁)。在T2WI矢状位图像上测量腹壁厚度、肌瘤腹皮距(肌瘤腹面到腹壁皮肤的最小距离)、肌瘤背骶距(肌瘤背面到骶骨的最小距离)。肌瘤的体积通过测量横径(a)、左右径(b)、上下径(c)三个径线获得。体积计算公式为:V1=0.5233×a×b×c。根据肌瘤在T2WI序列上信号强度与骨骼肌对比,将其T2WI信号分为均匀低信号、均匀等信号、均匀高信号、混杂高低信号四种类型。根据肌瘤与子宫肌层强化程度的对比,将其强化方式分为轻度强化、中度强化、显著强化三种强化类型。
所有数据后处理在ADW 4.4图形工作站上利用Func tools软件进行,在肌瘤最大层面上勾画感兴趣区域(region of interest, ROI),测量时避开钙化、坏死、血管及出血区域,取得以下参数:标准表观扩散系数(standard apparent diffusion coefficient, StandardADC)值、快速表观扩散系数(FastADC)值、慢速表观扩散系数(SlowADC)值、灌注分数(f)值。所有参数测量三次取平均值。以上各数据测量及图像判定由两位影像科医师(1位23年腹部影像诊断经验的副主任医师、1位10年腹部影像诊断经验的主治医师)分别采用双盲法进行。
通过临床病历系统记录191例患者的基线临床特征,内容包括:年龄、生育情况等。通过电话回访的方式了解患者HIFU术后再干预治疗情况(再干预的原因、方式及时间)。将再干预定义为:子宫肌瘤患者接受HIFU治疗后,因症状未缓解或症状复发、肌瘤再生长,而进行了再次手术治疗,治疗方式包括HIFU治疗、子宫动脉栓塞术、子宫肌瘤剔除术、子宫全切术。随访结局终点事件为患者接受再次干预治疗子宫肌瘤。随访时间的计算方法为从进行HIFU治疗到进行再干预治疗的时间,或者研究中止时间(2021年10月31日),或者失访时间(病历系统内最后一次能追踪到的时间)。
采用SPSS 26.0及R语言统计学软件(版本R4.1.0)进行统计分析,所有假设检验的检验水准设为α=0.05,以双侧检验P<0.05为差异具有统计学意义。符合正态分布的数据以均数±标准差(±s)表示,非正态分布的数据以中位数与四分位数表示。两名医生参数测量值一致性采用组内相关系数(intraclass correlation coefficient, ICC)进行检验,以ICC<0.40为一致性差,0.40≤ICC<0.75为一致性中等,ICC≥0.75为一致性好;以Kappa检验评价观察者间肌瘤位置等分类数据一致性判定,Kappa<0.40为一致性差,0.40≤Kappa<0.75为一致性中等,Kappa≥0.75为一致性好。P<0.05为差异有统计学意义。采用X-Tile软件(v3.1.6,https://medicine.yale.edu/lab/rimm/research/software/)进行各组定量资料相关截断值的筛选[20]。采用Kaplan-Meier分析及Log-Rank检验进行单因素分析,将分析得到的危险因素建立Cox比例风险回归模型,并采用列线图可视化多变量分析结果,采用一致性指数(coherence-index, C-index)及校准曲线验证模型的预测性能。通过受试者工作特征(receiver operating characteristic, ROC)曲线下面积(area under the curve, AUC)评估列线图模型的预测稳定性。
共191例子宫肌瘤患者符合条件入组,年龄24~47岁,中位年龄41岁。其中45例患者接受了再干预治疗,再干预率为23.6%。再干预的方式:HIFU治疗2例、子宫肌瘤剔除术19例、子宫全切21例、子宫动脉栓塞术3例。再干预的原因:症状未缓解14例,肌瘤再生长6例,肌瘤再生长并症状复发20例,症状性复发5例。
两位影像医师之间影像判读结果的一致性检验结果显示,腹壁厚度、肌瘤腹皮距、肌瘤背骶距、肌瘤最大径、肌瘤体积、StandardADC值、SlowADC值、FastADC值、f值的ICC值均大于0.75(P<0.05),肌瘤位置、肌瘤类型、T2WI信号类型、T1WI强化类型的Kappa值均大于0.75(P<0.05),说明一致性很好。本研究采用的是经验更为丰富的副主任医师的影像判读结果。
对可能影响子宫肌瘤患者HIFU术后再干预的14个变量(年龄、腹壁厚度、肌瘤腹皮距、肌瘤背骶距、肌瘤最大径、肌瘤体积、肌瘤位置、肌瘤类型、T2WI信号类型、T1WI强化类型、StandardADC值、SlowADC值、FastADC值、f值)进行单因素Kaplan-Meier法分析及Log-Rank检验,其中的定量资料用X-tile软件计算其最佳截断值将其分为两组。依据既往报道[21],根据肌瘤消融难易程度,肌瘤位置分为前壁、底壁、侧壁、后壁4组,肌瘤类型按黏膜下型、浆膜下型、肌壁间型分为3组。结果显示,年龄、T1强化类型、T2信号类型、肌瘤体积、SlowADC值、StandardADC值共6个因素影响子宫肌瘤HIFU术后再干预(P<0.05),而肌瘤位置、肌瘤类型、肌瘤最大径、FastADC值、f值、腹壁厚度、肌瘤腹皮距、肌瘤背骶距与子宫肌瘤HIFU术后再干预无关(表1、图1)。
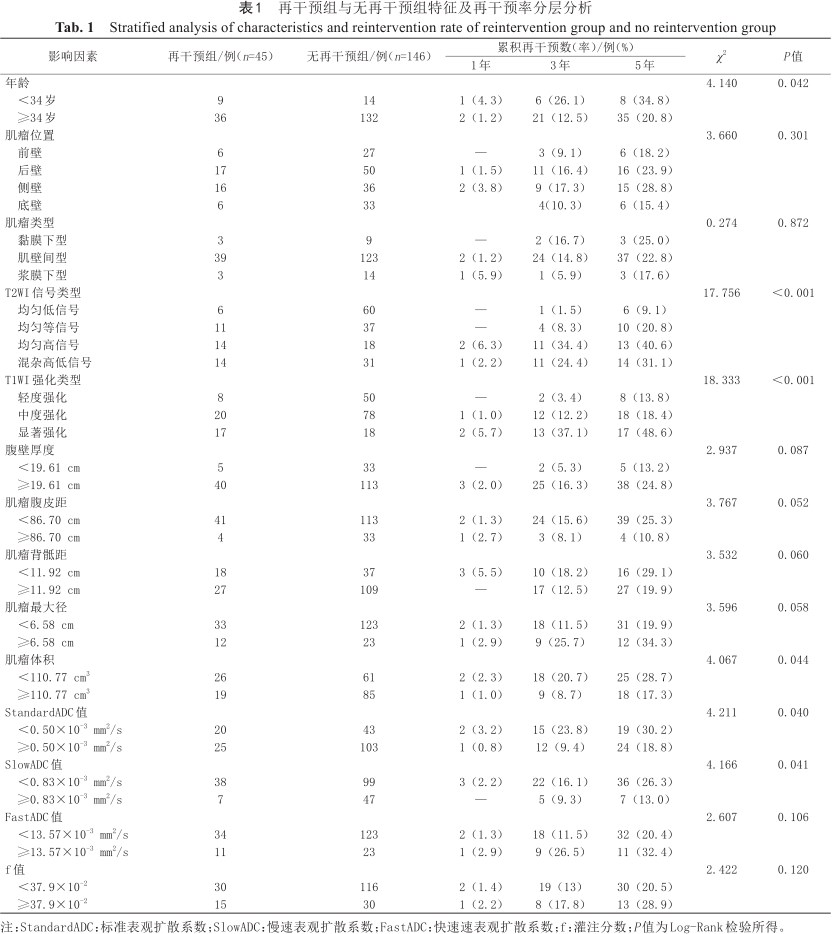
再干预组与无再干预组特征及再干预率分层分析
Stratified analysis of characteristics and reintervention rate of reintervention group and no reintervention group
再干预组与无再干预组特征及再干预率分层分析
Stratified analysis of characteristics and reintervention rate of reintervention group and no reintervention group
| 影响因素 | 再干预组/例(n=45) | 无再干预组/例(n=146) | 累积再干预数(率)/例(%) | χ2 | P值 | ||
|---|---|---|---|---|---|---|---|
| 1年 | 3年 | 5年 | |||||
| 年龄 | 4.140 | 0.042 | |||||
| <34岁 | 9 | 14 | 1(4.3) | 6(26.1) | 8(34.8) | ||
| ≥34岁 | 36 | 132 | 2(1.2) | 21(12.5) | 35(20.8) | ||
| 肌瘤位置 | 3.660 | 0.301 | |||||
| 前壁 | 6 | 27 | — | 3(9.1) | 6(18.2) | ||
| 后壁 | 17 | 50 | 1(1.5) | 11(16.4) | 16(23.9) | ||
| 侧壁 | 16 | 36 | 2(3.8) | 9(17.3) | 15(28.8) | ||
| 底壁 | 6 | 33 | 4(10.3) | 6(15.4) | |||
| 肌瘤类型 | 0.274 | 0.872 | |||||
| 黏膜下型 | 3 | 9 | — | 2(16.7) | 3(25.0) | ||
| 肌壁间型 | 39 | 123 | 2(1.2) | 24(14.8) | 37(22.8) | ||
| 浆膜下型 | 3 | 14 | 1(5.9) | 1(5.9) | 3(17.6) | ||
| T2WI信号类型 | 17.756 | <0.001 | |||||
| 均匀低信号 | 6 | 60 | — | 1(1.5) | 6(9.1) | ||
| 均匀等信号 | 11 | 37 | — | 4(8.3) | 10(20.8) | ||
| 均匀高信号 | 14 | 18 | 2(6.3) | 11(34.4) | 13(40.6) | ||
| 混杂高低信号 | 14 | 31 | 1(2.2) | 11(24.4) | 14(31.1) | ||
| T1WI强化类型 | 18.333 | <0.001 | |||||
| 轻度强化 | 8 | 50 | — | 2(3.4) | 8(13.8) | ||
| 中度强化 | 20 | 78 | 1(1.0) | 12(12.2) | 18(18.4) | ||
| 显著强化 | 17 | 18 | 2(5.7) | 13(37.1) | 17(48.6) | ||
| 腹壁厚度 | 2.937 | 0.087 | |||||
| <19.61 cm | 5 | 33 | — | 2(5.3) | 5(13.2) | ||
| ≥19.61 cm | 40 | 113 | 3(2.0) | 25(16.3) | 38(24.8) | ||
| 肌瘤腹皮距 | 3.767 | 0.052 | |||||
| <86.70 cm | 41 | 113 | 2(1.3) | 24(15.6) | 39(25.3) | ||
| ≥86.70 cm | 4 | 33 | 1(2.7) | 3(8.1) | 4(10.8) | ||
| 肌瘤背骶距 | 3.532 | 0.060 | |||||
| <11.92 cm | 18 | 37 | 3(5.5) | 10(18.2) | 16(29.1) | ||
| ≥11.92 cm | 27 | 109 | — | 17(12.5) | 27(19.9) | ||
| 肌瘤最大径 | 3.596 | 0.058 | |||||
| <6.58 cm | 33 | 123 | 2(1.3) | 18(11.5) | 31(19.9) | ||
| ≥6.58 cm | 12 | 23 | 1(2.9) | 9(25.7) | 12(34.3) | ||
| 肌瘤体积 | 4.067 | 0.044 | |||||
| <110.77 cm3 | 26 | 61 | 2(2.3) | 18(20.7) | 25(28.7) | ||
| ≥110.77 cm3 | 19 | 85 | 1(1.0) | 9(8.7) | 18(17.3) | ||
| StandardADC值 | 4.211 | 0.040 | |||||
| <0.50×10-3 mm2/s | 20 | 43 | 2(3.2) | 15(23.8) | 19(30.2) | ||
| ≥0.50×10-3 mm2/s | 25 | 103 | 1(0.8) | 12(9.4) | 24(18.8) | ||
| SlowADC值 | 4.166 | 0.041 | |||||
| <0.83×10-3 mm2/s | 38 | 99 | 3(2.2) | 22(16.1) | 36(26.3) | ||
| ≥0.83×10-3 mm2/s | 7 | 47 | — | 5(9.3) | 7(13.0) | ||
| FastADC值 | 2.607 | 0.106 | |||||
| <13.57×10-3 mm2/s | 34 | 123 | 2(1.3) | 18(11.5) | 32(20.4) | ||
| ≥13.57×10-3 mm2/s | 11 | 23 | 1(2.9) | 9(26.5) | 11(32.4) | ||
| f值 | 2.422 | 0.120 | |||||
| <37.9×10-2 | 30 | 116 | 2(1.4) | 19(13) | 30(20.5) | ||
| ≥37.9×10-2 | 15 | 30 | 1(2.2) | 8(17.8) | 13(28.9) | ||
注:StandardADC:标准表观扩散系数;SlowADC:慢速表观扩散系数;FastADC:快速速表观扩散系数;f:灌注分数;P值为Log-Rank检验所得。

Kaplan-Meier分析及Log-Rank检验所得到的6个危险因素作为自变量,将术后再干预情况(无再干预=0,再干预=1)作为因变量,建立Cox比例风险回归模型及生存分析函数图(图2)。变量赋值情况为:年龄(<34岁=0,≥34岁=1)、T2WI信号类型(均匀低信号=1、均匀等信号=2、均匀高信号=3、混杂高低信号=4)、T1WI强化类型(轻度强化=1、中度强化=2、显著强化=3)、肌瘤体积(<110.77 cm3=0、≥110.77 cm3=1)、StandardADC值(<0.50×10-3 mm2/s=0、≥0.50×10-3 mm2/s=1)、SlowADC值(<0.83×10-3 mm2/s=0、≥0.83×10-3 mm2/s=1)。变量筛选方法采用“向前”法(α=0.05)。Cox回归分析结果显示,回归模型具有统计学意义(P<0.05),年龄、T2WI信号类型、T1WI强化类型、SlowADC值4个变量是影响子宫肌瘤HIFU术后再干预的独立危险因素(表2)。


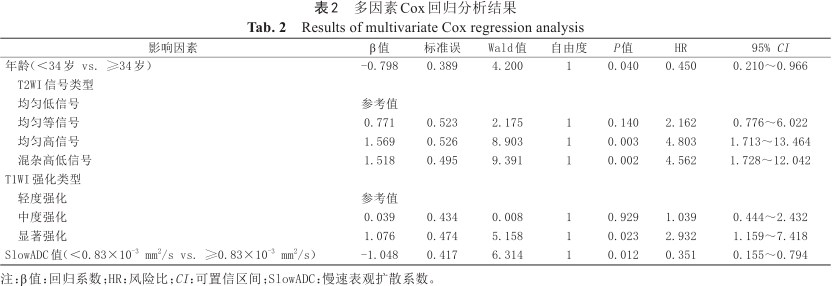
多因素Cox回归分析结果
Results of multivariate Cox regression analysis
多因素Cox回归分析结果
Results of multivariate Cox regression analysis
| 影响因素 | β值 | 标准误 | Wald值 | 自由度 | P值 | HR | 95% CI |
|---|---|---|---|---|---|---|---|
| 年龄(<34岁 vs. ≥34岁) | -0.798 | 0.389 | 4.200 | 1 | 0.040 | 0.450 | 0.210~0.966 |
| T2WI信号类型 | |||||||
| 均匀低信号 | 参考值 | ||||||
| 均匀等信号 | 0.771 | 0.523 | 2.175 | 1 | 0.140 | 2.162 | 0.776~6.022 |
| 均匀高信号 | 1.569 | 0.526 | 8.903 | 1 | 0.003 | 4.803 | 1.713~13.464 |
| 混杂高低信号 | 1.518 | 0.495 | 9.391 | 1 | 0.002 | 4.562 | 1.728~12.042 |
| T1WI强化类型 | |||||||
| 轻度强化 | 参考值 | ||||||
| 中度强化 | 0.039 | 0.434 | 0.008 | 1 | 0.929 | 1.039 | 0.444~2.432 |
| 显著强化 | 1.076 | 0.474 | 5.158 | 1 | 0.023 | 2.932 | 1.159~7.418 |
| SlowADC值(<0.83×10-3 mm2/s vs. ≥0.83×10-3 mm2/s) | -1.048 | 0.417 | 6.314 | 1 | 0.012 | 0.351 | 0.155~0.794 |
注:β值:回归系数;HR:风险比;CI:可置信区间;SlowADC:慢速表观扩散系数。
基于Cox回归分析的结果以列线图的形式展示。采用R软件中“rms”程序包构建子宫肌瘤HIFU术后3年、5年无再干预时间列线图模型(图3)。列线图显示T2WI信号类型对预后影响最大,T1WI强化类型次之。为了验证该模型的预测性能,我们计算了模型的C-index值和校准曲线(图4),C-index为0.745(95% CI:0.672~0.818),校准曲线表明该模型与实际观测结果一致性较好,结果证实了模型的一致性较好,X轴代表列线图模型预测的无再干预率,Y轴代表实际的无再干预率。该模型预测3年无再干预率与5年无再干预率的AUC分别为0.833、0.749(图5、6)。


本研究通过对191名子宫肌瘤患者病例进行了9~68个月的回顾性队列分析,分析其临床及多参数MRI特征,建立并验证了一个列线图模型来预测子宫肌瘤HIFU术后3年、5年的再干预情况。该列线图总共包含了年龄、T2WI信号类型、T1WI强化类型、SlowADC值4个变量。年龄、SlowADC值与术后3年、5年再干预概率呈负相关,即年龄越小、SlowADC值越小,术后再干预概率越大。T2WI信号类型和T1WI强化类型中,T2WI均匀高信号肌瘤和T1WI显著强化肌瘤再干预可能性最大。国内外尚未见将多参数MRI应用于子宫肌瘤HIIFU治疗后再干预预测的报道,MRI参数相对于临床参数具有客观性好、可重复性高的优点。本研究结果或可帮助临床医生早期识别再干预高风险人群,为子宫肌瘤制订个性化治疗方案提供新思路。
本研究所建立的列线图中,T2WI信号类型的影响力最高。多项研究表明[10, 15, 16],子宫肌瘤HIFU治疗后的消融率与T2信号相关,而消融率与治疗后肌瘤术后长期症状缓解、肌瘤局部复发、再干预均有相关性。本研究结果显示,相比T2低信号,均匀高信号与混杂高低信号是再干预的独立危险因素,相关系数分别为1.569、1.518,T2WI均匀高信号再干预的风险是低信号的4.803倍,而混杂高低信号再干预的风险为低信号的4.562倍,均匀高信号的再干预风险最高,与既往研究结论一致[22]。不同的病理类型是子宫肌瘤不同T2WI信号特征的基础[23],普通型子宫肌瘤细胞纤维成分较多而细胞液较少,常表现为T2低信号;退变型肌瘤内部常合并变性、液化坏死、出血、钙化等,组织结构较复杂,多表现为混杂信号;富细胞型肌瘤细胞密度高、排列规律、含水量多、胶原纤维稀疏,常表现为均匀稍高信号[24]。高含水量或富血液都会不同程度带走HIFU消融过程中汇集于焦点的部分热量,不利于能量沉积,造成消融效果不满意[25]。雌激素和孕激素在富细胞型肌瘤中高表达[26],也是其容易复发的因素之一。因此,不同T2WI信号特征所对应的肌瘤不同的细胞组织构成,也说明了均匀高信号子宫肌瘤消融难度最大,术后再干预风险最高。
本研究发现肌瘤强化类型也是再干预的风险因素之一,明显强化的子宫肌瘤HIFU治疗后再次干预治疗的风险大于轻度强化的肌瘤,其再干预的可能性是轻度强化肌瘤的2.932倍。既往研究发现[27, 28],相比血供不丰富的子宫肌瘤,HIFU治疗时的能量在血供丰富的肌瘤中沉积更加困难。HIFU治疗的原理是将体外超声汇集于靶点,使靶组织温度升高而产生不可逆的凝固性坏死。流动的血液会带走一部分超声治疗时的热量,使得局部治疗能量的沉积减少,焦点组织温度升高减慢,造成超声治疗时间延长,消融困难,容易出现局部残留。Zhao等[29]采用离体肝脏灌注系统探究了微循环灌注流量对HIFU消融体积产生的影响,结果显示,在连续高强度聚焦超声的作用下,组织坏死体积的大小与血流灌注量成反比。子宫微环境中,血管内皮生长因子及其受体的高表达对子宫肌瘤血管的生成也发挥了重要作用[30],活跃的血管形成将促进肌瘤的复发,肌瘤的生长速度与其内血管比例呈正相关[31]。因此,明显强化的子宫肌瘤HIFU治疗后接受再次干预治疗的风险较轻度强化的肌瘤更大。
扩散加权成像(diffusion-weighted imaging, DWI)是目前唯一能反映活体生物组织内部微观分子结构运动的成像方式,常规单指数模型DWI只反映了组织中水分子的扩散运动,忽略了活体组织中毛细血管网中血流灌注对ADC值的影响。采用多b值扫描的IVIM-DWI基于双指数模型计算出SlowADC值、FastADC值、f值,无需对比剂就能分辨出组织的扩散信息和灌注信息,可更为全面地反映目标组织纯水分子的扩散和微循环灌注的特征。本研究中纳入了4种扩散相关参数,即StandardADC值、SlowADC值、FastADC值和f值,最终只有SlowADC值进入Cox比例风险回归方程。SlowADC值即真性扩散系数,基于高b值(b值>200 s/mm2)计算得出,反映体素内水分子真实扩散状态,主要受细胞结构、密集度和核质比等因素影响[32, 33],通常认为SlowADC值与组织细胞数目、核质比呈负相关。高SlowADC值说明水分子扩散快、细胞密度低[34]。而SlowADC值较低的肌瘤平滑肌细胞含量丰富、排列紧密,细胞外间隙较小、间质胶原纤维较少、水分子扩散明显受限[35],这样的微观结构与富细胞型肌瘤镜下表现比较符合,也符合既往研究富细胞型子宫肌瘤消融困难的结论[36]。Cox回归分析显示SlowADC值与子宫肌瘤HIFU治疗术后再干预呈负相关,即SlowADC值越低,再干预风险越高。
本研究中,患者年龄与再干预情况呈负相关,与既往研究结论一致[10]。子宫肌瘤是激素依赖性肿瘤,其生长与激素水平有密切联系,相比年龄较大的女性,年轻女性通常具有较高的雌孕激素水平。年龄较大的女性尤其是围绝经期女性,子宫往往存在不同程度的萎缩,肌瘤血供也相应减少[37]。少血供是超声能量易于沉积的一个重要因素,这可能是年龄较大女性HIFU疗效较好的原因之一。在随访的过程中我们还观察到,个别围绝经期女性即使在HIFU治疗后症状缓解不明显或症状复发,也未进行再干预治疗,追问原因是患者期望进入绝经期后症状无好转再进行干预,这可能也是年龄较大组患者再干预率低的原因之一。再者,年轻女性距离绝经期的生命周期更长,这也增加了肌瘤复发的可能性。
上述研究结果表明,年龄<34岁、T2WI呈均匀高信号或混杂高低信号、T1WI增强呈显著强化、SlowADC值<0.83×10-3 mm2/s,存在这些特点的患者HIFU术后有再次干预治疗的风险,可能并不适合进行HIFU治疗,或者在进行子宫肌瘤HIFU消融时针对该部分患者应适当增大治疗功率或延长消融时间,在其治疗前应与患者进行充分沟通告知相关风险。临床医生应根据患者的实际情况,制订更为精确的个性化治疗方案,以降低再干预的发生率,提高子宫肌瘤患者术后的长期生活质量,可缩短患者住院时间、间接降低社会经济负担。
本研究的局限性:(1)本次研究为回顾性研究,选择研究对象时只纳入了单发肌瘤或多发肌瘤中最大的肌瘤进行分析,同时部分信息不完整的患者被排除,研究对象的选择存在一定的偏倚;(2)因本研究中再干预患者人数有限,仅进行了内部验证,无法获取足够的人群进行有效外部验证;(3)再干预治疗的影响因素较多,患者经济条件、受教育程度、心理因素等均可能影响其是否接受再干预治疗,这些异质性可能会对研究结果产生不同程度的影响。后期研究中,将针对这些问题做更大样本量、多中心、多因素的前瞻性研究。
综上所述,我们基于多参数MRI评估了子宫肌瘤患者HIFU治疗后再干预的相关风险因素,并进行了风险分层,所构建的列线图可以客观、较准确地预测子宫肌瘤HIFU术后的预后,并且可以带来潜在的临床获益。对列线图预测模型进行充分、合理地利用,可以帮助临床医生制订个体化治疗方案,从而降低子宫肌瘤HIFU治疗后再干预的风险。
Major Cultivation Project of Sichuan Province Natural Science Foundation (No. 17CZ0014).
全体作者均声明无利益冲突。



























