
本研究经河北省人民医院伦理委员会批准,免除受试者知情同意,批准文号:2022083。患者男,67岁,主因“发现血糖升高5年,体质量下降4个月”入河北省人民医院。查体:右侧腿部纤维瘤切除术后,右侧大腿根部长约5 cm的手术瘢痕。有慢性乙肝病史5年。实验室检查:AFP 13.880 ng/mL、CA19-9 41.840 U/mL、T-Bil 27.8l mol/L、D-Bil 7.4l mol/L升高。2021年4月27日行MRI(强化应用莫迪司对比剂)示:肝右后叶可见团块状T1WI、T2WI高低混杂信号影,DWI序列呈不均匀高信号影,范围约为101 mm×58 mm,边界欠清,其内可见分隔,T1WI同反相位信号未见明显变化,增强扫描(图1A~1G)呈不均匀强化,内可见片状无强化信号,边缘及分隔强化较明显,肝胆期(延迟1 h扫描)信号不均匀。肝左叶外侧段可见一小圆形异常强化影,直径约8 mm,增强扫描动脉期呈明显强化。门静脉右支可见对比剂充盈缺损影(图1G)。时隔5天后行CT平扫及增强示:肝右叶一类椭圆形略低密度影,增强扫描动脉期呈周边晕状中等强化,间隔强化(图1H),增强扫描门脉期及延迟期病灶由边缘向中心逐渐填充(图1I~1J)。病变边缘可见钙化灶。影像诊断:不典型肝癌可能性大;肝左叶外侧段转移可能。经患者知情同意后于2021年5月8日进行手术,行根治性切除肿瘤。在剖腹手术中,肝脏呈粉红色硬化,肿瘤位于右后肝段。因此,我们进行了右后肝切除加右后门静脉血栓的清除,并在超声引导下的子焦点射频消融。病理上,切除的病灶肉眼观察为多结节型,大小约10 cm×8 cm×6.5 cm。肿瘤切面灰白色、灰红色,质稍硬,局部可见坏死。免疫组织化学染色显示,部分嵌套式生长的上皮细胞表达HepPar-1、CKPAN、精氨酸酶-1,局灶性表达Glypical3,提示为肝细胞癌;而另一部分腺体结构的上皮细胞表达CK7和CK19,不表达精氨酸酶-1和Glypical3,提示为胆管细胞癌。两种上皮成分的波形蛋白均为阴性。肉瘤细胞波形蛋白阳性(图1L),细胞角蛋白7和19、上皮膜抗原和CD34阴性。患者恢复良好,11天后出院。术后行肝动脉化疗和栓塞术。不幸的是手术后仅39天,CT检查发现右肺有早期转移。
本刊刊出的所有论文不代表本刊编委会的观点,除非特别声明
本研究经河北省人民医院伦理委员会批准,免除受试者知情同意,批准文号:2022083。患者男,67岁,主因“发现血糖升高5年,体质量下降4个月”入河北省人民医院。查体:右侧腿部纤维瘤切除术后,右侧大腿根部长约5 cm的手术瘢痕。有慢性乙肝病史5年。实验室检查:AFP 13.880 ng/mL、CA19-9 41.840 U/mL、T-Bil 27.8l mol/L、D-Bil 7.4l mol/L升高。2021年4月27日行MRI(强化应用莫迪司对比剂)示:肝右后叶可见团块状T1WI、T2WI高低混杂信号影,DWI序列呈不均匀高信号影,范围约为101 mm×58 mm,边界欠清,其内可见分隔,T1WI同反相位信号未见明显变化,增强扫描(图1A~1G)呈不均匀强化,内可见片状无强化信号,边缘及分隔强化较明显,肝胆期(延迟1 h扫描)信号不均匀。肝左叶外侧段可见一小圆形异常强化影,直径约8 mm,增强扫描动脉期呈明显强化。门静脉右支可见对比剂充盈缺损影(图1G)。时隔5天后行CT平扫及增强示:肝右叶一类椭圆形略低密度影,增强扫描动脉期呈周边晕状中等强化,间隔强化(图1H),增强扫描门脉期及延迟期病灶由边缘向中心逐渐填充(图1I~1J)。病变边缘可见钙化灶。影像诊断:不典型肝癌可能性大;肝左叶外侧段转移可能。经患者知情同意后于2021年5月8日进行手术,行根治性切除肿瘤。在剖腹手术中,肝脏呈粉红色硬化,肿瘤位于右后肝段。因此,我们进行了右后肝切除加右后门静脉血栓的清除,并在超声引导下的子焦点射频消融。病理上,切除的病灶肉眼观察为多结节型,大小约10 cm×8 cm×6.5 cm。肿瘤切面灰白色、灰红色,质稍硬,局部可见坏死。免疫组织化学染色显示,部分嵌套式生长的上皮细胞表达HepPar-1、CKPAN、精氨酸酶-1,局灶性表达Glypical3,提示为肝细胞癌;而另一部分腺体结构的上皮细胞表达CK7和CK19,不表达精氨酸酶-1和Glypical3,提示为胆管细胞癌。两种上皮成分的波形蛋白均为阴性。肉瘤细胞波形蛋白阳性(图1L),细胞角蛋白7和19、上皮膜抗原和CD34阴性。患者恢复良好,11天后出院。术后行肝动脉化疗和栓塞术。不幸的是手术后仅39天,CT检查发现右肺有早期转移。
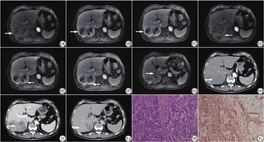

Lao等[1]提出原发性肝癌肉瘤(primary hepatic carcinosarcoma, PHC)是一种包含肝细胞癌和肉瘤的原发性肝脏恶性肿瘤。2000年,世界卫生组织将肝细胞癌归类为一种肝脏间充质肿瘤,并明确将其定义为一种含有致癌物质(肝癌或胆管细胞癌)和肉瘤成分的恶性肿瘤。目前,PHC的组织学起源尚不清楚,但基本有两种理论,一种理论认为,在组织学上起源于肝脏多能干细胞,然后分化为癌和肉瘤[2];另一种理论支持肉瘤成分通过化生机制由癌变成分转化而来[3]。本例癌性成分和肉瘤成分之间有明确的界限,没有观察到过渡区域。PHC最常见于食道、卵巢、子宫和膀胱[4],罕见发生在肝脏,没有特殊临床症状,主诉多为腹痛、腹胀和消化不良[5]。实验室检测可以发现肝脏损伤和肿瘤标志物(如甲胎蛋白和CA19-9)升高,但如果这些标志物在正常范围内,则也无法排除发生PHC的可能性。由于PHC中癌和肉瘤成分的比例和病理类型不同,以往的影像表现有所不同。PHC的CT平扫多表现为不均匀低密度灶,伴有大片坏死囊性改变,CT增强时,门静脉及平衡期肿瘤实质由周围向中央逐渐充盈,门静脉及平衡期肿瘤实质略呈低密度或等密度[6, 7],MRI扫描表现为T1WI低信号、T2WI高信号,周围有不规则强化结节,边缘及分隔强化明显。本例MRI显示:(1)病灶右侧边缘实性成分动脉期呈明显强化,门静脉及平衡期强化程度快速下降,呈“快进快出”特征性影像表现,与肝细胞癌强化特点相符;(2)病变左下部边缘呈“渐进性”增强影像特点,与胆管细胞癌的强化特点相一致。本例CT图像也观察到病灶在动脉期呈边缘不规则环形强化,间隔中等强化,和从外到内的连续进行性强化,中心区域为低密度,并且在肿瘤边缘见与骨皮质密度接近的钙化灶。结合组织学检查提示为肝细胞癌、胆管细胞癌、肉瘤三种成分混合的肝癌肉瘤,以往文献具有这三种组织成分影像表现的报道少见。另外,由肿瘤的间质成分引起的强化的线状、索状分隔和结节是肝细胞癌和胆管细胞癌中罕见的,假如有这样的影像学特征,我们应该注意PHC的可能性。本例门静脉可见癌栓,这表明了其恶性程度高,侵犯性强,易转移的特点。肿瘤边缘纤维组织假包膜的形成可能是由慢性肝病引起的,导致肝实质纤维组织增生或考虑肿瘤压迫肝实质引起纤维组织增生所致。
此病主要与以下疾病鉴别:(1)巨块型肝细胞癌,肿瘤多为实性成分,囊性比例少,边界不清,形态不规则,增强扫描显示“快进快出”的特征影像表现;(2)肝脏肉瘤样癌,兼有上皮和间充质特点的肿瘤细胞,影像学显示具有癌与肉瘤的双重特性,周围与内部条状分隔大多不断增强;(3)肝胆管细胞癌,多发生于肝左叶外侧段,多数乏血供,增强扫描延迟强化,边界不清,病灶中央及周围常发现不同程度胆管扩张。
综上所述,目前PHC的最终诊断依赖于术后组织病理学检查。PHC的临床和影像学表现缺乏特异性,术前诊断困难。然而,术前影像学数据可以为疾病的术前定性定位以及病变与周围组织的关系提供重要信息。
全部作者均声明无利益冲突。


























