
旨在探索MR引导下聚焦超声(MR-guided focus ultrasound, MRgFUS)治疗药物难治性特发性震颤(essential tremor, ET)患者术后局部自发性脑活动的长期纵向变化及与临床震颤评分的相关性。
前瞻性纳入于2019年1月至2019年5月在中国人民解放军总医院接受MRgFUS丘脑消融术的药物难治性ET患者(ET组)及年龄和性别匹配的健康对照(helathy controls, HC)组各9例,收集ET组基线、MRgFUS术后6个月及MRgFUS术后2年静息态功能磁共振成像(resting state functional magnetic resonance imaging, rs-fMRI)数据和临床震颤评定量表(Clinical Rating Scale for Tremor, CRST)以及HC组rs-fMRI数据。采用基于MATLAB平台的REST plus v1.2工具包中局部一致性(regional homogeneity, ReHo)方法,基于全脑体素配对样本t检验确定ET组基线与MRgFUS术后2年显著差异性脑区,使用DPABI v5.1工具包提取HC组及ET组该显著差异性脑区ReHo值。利用两独立样本t检验比较HC组与ET组该显著差异性脑区自发性和同步性脑活动,采用单因素重复测量方差分析比较ET组基线、MRgFUS术后6个月和MRgFUS术后2年该显著差异性脑区自发性和同步性脑活动。利用Spearman相关性分析对ET组术后临床震颤改善与ET组ReHo值改变之间的变化趋势进行相关性分析;利用Pearson相关性分析对ET组MRgFUS术后2年震颤改善率与ET组基线ReHo值进行相关性分析。
ET组基线与MRgFUS术后2年显著差异性脑区位于右侧中央后回;与HC组比较,ET组基线右侧中央后回ReHo值显著减低(P<0.01),ET组MRgFUS术后两年右侧中央后回差异无统计学意义(P>0.05);ET组基线、MRgFUS术后6个月、MRgFUS术后2年,右侧中央后回ReHo值升高(F=3.95,P<0.05)。术后临床震颤改善与ReHo值改变之间的变化趋势成正相关;ET组MRgFUS术后2年CRST-A改善率与ET组基线ReHo值呈负相关(r=-0.709,P=0.032)。
MRgFUS治疗有助于药物难治性ET患者缓解震颤症状,MRgFUS治疗影响ET患者脑自发性及同步性脑功能活动,且ReHo值与临床震颤改善具有相关性,有助于为MRgFUS术后神经重塑的评估提供神经影像学依据。

本刊刊出的所有论文不代表本刊编委会的观点,除非特别声明
特发性震颤(essential tremor, ET)是最常见的运动障碍性疾病,其发病特点是双上肢动作性或姿势性震颤,同时伴有认知功能障碍、精神异常等多种非运动症状[1, 2]。目前,控制ET患者的震颤症状主要以普萘洛尔和扑米酮为主的药物方式,但仍有高达50%的患者对药物治疗反应欠佳[3]。随着无创功能神经外科技术的发展,以丘脑腹侧中间核(ventral intermediate thalamic nucleus, VIM)为消融靶点的MR引导下聚焦超声(MR-guided focus ultrasound, MRgFUS)技术成为控制药物难治性ET患者震颤的有效方式[4, 5, 6]。同时,静息态功能磁共振成像(resting state functional magnetic resonance imaging, rs-fMRI)技术对于揭示运动障碍性疾病的发病机制、疗效评价及预后评估发挥了重要作用,逐渐成为研究MRgFUS导致的术后神经重塑等相关改变的评价手段[7, 8, 9]。
rs-fMRI是一种观察活体功能活动及代谢活动的MRI技术[10]。目前,功能MRI以血氧水平依赖(blood oxygenation level dependent, BOLD)技术为主,该技术通过脑血管内去氧血红蛋白的含量变化间接反映大脑局部功能活动变化[11]。rs-fMRI中局部一致性(regional homogeneity, ReHo)指标可反映全脑体素在局部脑区神经元活动同步性,因其对样本分布无特殊要求、适用性强等优点在神经系统性疾病中得以广泛应用[12, 13, 14]。既往研究发现ReHo可用于区分ET患者及健康对照(helathy controls, HC)组,并揭示了其内在的大脑活动[15]。方维东等[16]的研究发现小脑及初级运动皮层的ReHo异常与ET患者的震颤严重程度评分相关。以上研究说明ReHo可作为检测和量化ET功能性病理机制变化的生物学标志物。
然而,ET患者MRgFUS术后是否存在静息状态下局部脑功能改变尚不清楚,同时也缺乏长期纵向的研究评价MRgFUS术后神经功能恢复情况。因此,本研究以接受MRgFUS治疗的药物难治性ET患者为研究对象,通过收集基线、MRgFUS术后6个月及术后2年的rs-fMRI及临床数据,采用ReHo指标分析MRgFUS术后局部脑功能活动变化情况,为MRgFUS术后神经重塑的评估提供神经影像学依据。
本研究为前瞻性纵向研究,该研究经中国人民解放军总医院伦理委员会批准(批准文号:S2018-021-1),临床试验号:NCT04570046,所有受试者研究前均签署知情同意书。所有患者经运动障碍神经科医生或神经外科医生根据诊断标准诊断为ET(ET组),诊断标准如下:双侧上肢动作性震颤、持续时间至少3年、伴或不伴随其他部位的震颤(如头部、声音或下肢)、无其他神经系统体征(如肌张力障碍、共济失调或帕金森病)[16, 17, 18]。主要纳入及排除标准参考Elias等[5]所述,纳入标准包括:(1)中度至重度手部姿势性或意向性震颤[通过临床震颤评定量表(Clinical Rating Scale for Tremor, CRST)对ET患者进行震颤评估,每个评估成分的分数范围为0~4分,分数越高表明震颤越严重]和残疾(CRST残疾部分8项中任一项≥2分);(2)额外的纳入标准为药物治疗效果不佳或难以耐受药物副作用。排除标准包括:(1)脑血管疾病;(2)脑肿瘤;(3)癫痫;(4)其他神经退行性疾病;(5)认知功能受损的精神疾病;(6)MRI的禁忌证;(7)脑深部刺激治疗;(8)立体定向消融术;(9)在基线前5个月内在手臂、颈部或面部注射肉毒杆菌毒素;(10)颅骨密度比≤0.35。10名药物难治性ET右利手患者于2019年1月至2019年5月在中国人民解放军总医院接受了左侧MRgFUS丘脑VIM核消融,并于基线、MRgFUS术后6个月及术后2年进行影像及临床随访,一名患者因在治疗后失访而排除,最终共纳入9名患者及同时期年龄和性别匹配的右利手健康志愿者(HC组)。HC组排除标准包括:(1)脑血管疾病;(2)脑肿瘤;(3)癫痫;(4)其他神经退行性疾病;(5)认知功能受损的精神疾病;(6)MRI禁忌证;(7)脑深部刺激治疗;(8)立体定向消融术。
使用中国人民解放军总医院GE Discovery MR 750 MR设备收集HC组及ET组基线、MRgFUS术后6个月及MRgFUS术后2年rs-fMRI数据,rs-fMRI采用梯度回波-平面回波成像序列(gradient recalled echo-echo planar imaging, GRE-EPI)扫描,参数如下:TR 2000 ms,TE 30 ms,FA 90°,层厚 3.5 mm,层间隔0.5 mm,矩阵 64×64,FOV 240 mm×240 mm,总扫描时间6 min。在无药物治疗状态下,由两名有5年以上经验的主治医生于基线、MRgFUS术后6个月和MRgFUS术后2年通过CRST对ET患者进行震颤评估,CRST包括A、B、C三个部分,其中:CRST-A主要评估震颤部位、类型及幅度,共120分;CRST-B评估特殊任务时的震颤情况(写字、画画、倒水),共16分;CRST-C评估震颤引起的功能残疾程度(言语、饮水、进食、穿衣、写作、工作、个人卫生及社会活动),共24分。CRST总分合计共160分。优势手震颤子分数作为主要的临床终点,由评估手部震颤和执行任务能力的八个项目相加得出(CRST-A及CRST-B中计算得出,范围从0~32,分数越高表示震颤越严重)。震颤改善率通过(基线评分-随访评分)/基线评分公式得出[5]。
使用REST plus v1.2工具包进行图像数据预处理,主要步骤如下:(1)去除前10个时间点;(2)时间层校正;(3)头动校正(排除任意方向头部平移大于1.5 mm及旋转角度大于1.5°的受试者);(4)EPI模板空间配准;(5)去除低频线性漂移;(6)回归干扰因素(Friston 24参数模型、脑白质信号、脑脊液信号和全局信号);(7)带通滤波(0.01~0.08 Hz)。进行27个体素的ReHo分析,得到肯德尔和谐系数(Kandall coefficient of concordace, KCC)[19],公式如下:
对原始ReHo值进行Z-Score标准化处理,并采用全宽半高值为6 mm的各向同性高斯核进行空间平滑处理。使用SPM12工具包对治疗前后ET患者进行全脑体素配对样本t检验,获得显著差异性脑区[多重比较校正初始阈值为体素水平P=0.001(未校正),簇水平P<0.05(FWEc校正)]。后在标准模板上显示结果,参照自动解剖标签(automated anatomical labeling, AAL)模板来记录相关差异的脑区及其对应的蒙特利尔神经学研究所(Montreal Neurological Institute, MNI)坐标、体素大小以及t值。使用DPABI v5.1提取HC组及ET组基线、MRgFUS术后6个月和MRgFUS术后2年该显著差异脑区的ReHo值。不同时间点的ReHo值变化通过(基线ReHo值-随访ReHo值)/基线ReHo值公式得出。
应用GraphPad Prism 9.3软件进行统计学分析,所有数据分析前进行正态性检验,采用两独立样本t检验分析ET组与HC组指标差异,采用单因素重复测量方差分析ET组基线、MRgFUS术后6个月和MRgFUS术后2年差异脑区ReHo值变化。使用Spearman相关性分析对ET组MRgFUS术后临床震颤改善与ReHo值改变之间的变化趋势进行相关性分析;使用Pearson相关性分析对ET组MRgFUS术后2年震颤改善率与基线ReHo值进行相关性分析。P<0.05表示差异具有统计学意义。
本研究ET组共入组9例MRgFUS术后ET患者,年龄(65.11±5.56)岁,男女比例为6∶3,病程(16.78±11.56)年,颅骨密度比值为(0.48±0.075),患者详细临床资料见表1;HC组招募9名性别及年龄相匹配的健康对照者,年龄(64.00±2.45)岁,男女比例为6∶3。两组性别上差异无统计学意义(χ2=0,P=1);两组在年龄上差异无统计学意义(t=0.549,P=0.591)。ET组MRgFUS治疗前后临床震颤评分见表2,与基线相比,MRgFUS术后6个月及术后2年震颤症状较前明显改善,术后2年疗效稍减退。
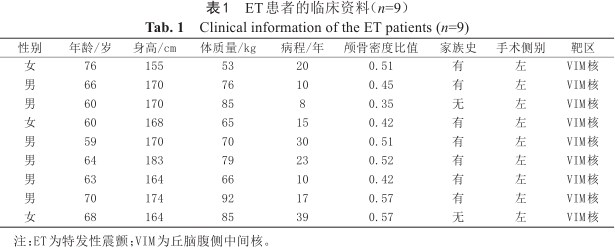
ET患者的临床资料(n=9)
Clinical information of the ET patients (n=9)
ET患者的临床资料(n=9)
Clinical information of the ET patients (n=9)
| 性别 | 年龄/岁 | 身高/cm | 体质量/kg | 病程/年 | 颅骨密度比值 | 家族史 | 手术侧别 | 靶区 |
|---|---|---|---|---|---|---|---|---|
| 女 | 76 | 155 | 53 | 20 | 0.51 | 有 | 左 | VIM核 |
| 男 | 66 | 170 | 76 | 10 | 0.45 | 有 | 左 | VIM核 |
| 男 | 60 | 170 | 85 | 8 | 0.35 | 无 | 左 | VIM核 |
| 女 | 60 | 168 | 65 | 15 | 0.42 | 有 | 左 | VIM核 |
| 男 | 59 | 170 | 70 | 30 | 0.51 | 有 | 左 | VIM核 |
| 男 | 64 | 183 | 79 | 23 | 0.52 | 有 | 左 | VIM核 |
| 男 | 63 | 164 | 66 | 10 | 0.42 | 有 | 左 | VIM核 |
| 男 | 70 | 174 | 92 | 17 | 0.57 | 有 | 左 | VIM核 |
| 女 | 68 | 164 | 85 | 39 | 0.57 | 无 | 左 | VIM核 |
注:ET为特发性震颤;VIM为丘脑腹侧中间核。
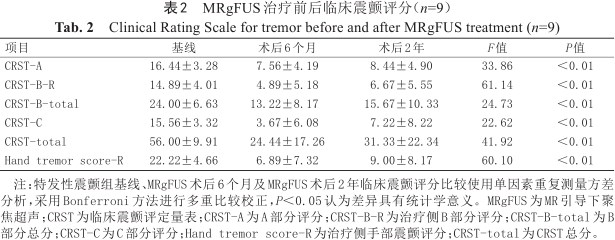
MRgFUS治疗前后临床震颤评分(n=9)
Clinical Rating Scale for tremor before and after MRgFUS treatment (n=9)
MRgFUS治疗前后临床震颤评分(n=9)
Clinical Rating Scale for tremor before and after MRgFUS treatment (n=9)
| 项目 | 基线 | 术后6个月 | 术后2年 | F值 | P值 |
|---|---|---|---|---|---|
| CRST-A | 16.44±3.28 | 7.56±4.19 | 8.44±4.90 | 33.86 | <0.01 |
| CRST-B-R | 14.89±4.01 | 4.89±5.18 | 6.67±5.55 | 61.14 | <0.01 |
| CRST-B-total | 24.00±6.63 | 13.22±8.17 | 15.67±10.33 | 24.73 | <0.01 |
| CRST-C | 15.56±3.32 | 3.67±6.08 | 7.22±8.22 | 22.62 | <0.01 |
| CRST-total | 56.00±9.91 | 24.44±17.26 | 31.33±22.34 | 41.92 | <0.01 |
| Hand tremor score-R | 22.22±4.66 | 6.89±7.32 | 9.00±8.17 | 60.10 | <0.01 |
注:特发性震颤组基线、MRgFUS术后6个月及MRgFUS术后2年临床震颤评分比较使用单因素重复测量方差分析,采用Bonferroni方法进行多重比较校正,P<0.05认为差异具有统计学意义。MRgFUS为MR引导下聚焦超声;CRST为临床震颤评定量表;CRST-A为A部分评分;CRST-B-R为治疗侧B部分评分;CRST-B-total为B部分总分;CRST-C为C部分评分;Hand tremor score-R为治疗侧手部震颤评分;CRST-total为CRST总分。
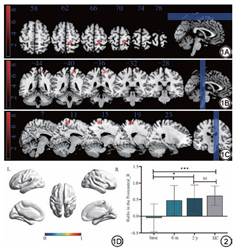
使用基于MATLAB平台的SPM12工具包对全脑体素进行配对样本t检验显示,ET组基线与MRgFUS术后2年显著差异脑区位于右侧中央后回(Postcentral_R;峰值MNI坐标:x=-12,y=-39,z=60;体素大小=60;峰值t=4.500)(图1)。本研究进一步分别对HC组,ET组基线、MRgFUS术后6个月和MRgFUS术后2年进行比较,结果如下:与HC组比较,ET组基线右侧中央后回ReHo值显著减低(P<0.01);与HC组比较,ET组MRgFUS术后2年右侧中央后回差异无统计学意义(P>0.05);ET组基线、MRgFUS术后6个月、MRgFUS术后2年右侧中央后回ReHo值升高(F=3.95,P<0.05)(图2)。

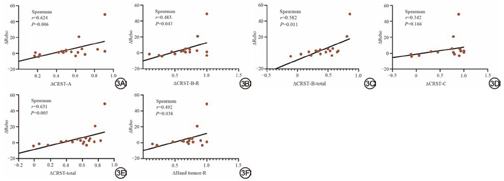
利用Spearman相关性分析对ET组MRgFUS术后临床震颤改善与ReHo值改变之间的变化趋势进行相关性分析,结果显示:ΔCRST-A、ΔCRST-B-R、ΔCRST-B-total、ΔCRST-total、ΔHand tremor-R与ΔReHo呈正相关(r=0.624,P=0.006;r=0.483,P=0.043;r=0.582,P=0.011;r=0.631,P=0.005;r=0.492,P=0.038),ΔCRST-C与ΔReHo无显著相关性(图3)。利用Pearson相关性分析对ET组MRgFUS术后2年震颤改善率与基线ReHo值进行相关性分析,结果显示:ET组MRgFUS术后2年CRST-A改善率与基线ReHo值呈负相关(r=-0.709,P=0.032),ET组MRgFUS术后2年CRST-B-R、CRST-B-total、CRST-total、Hand tremor-R及CRST-C改善率与基线ReHo值无显著相关性(图4)。

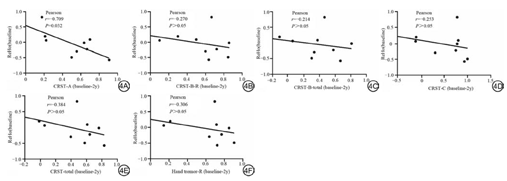

本研究采用ReHo指标评估MRgFUS治疗药物难治性ET患者术后2年静息状态下局部脑功能变化,并研究这种脑功能活动变化与震颤症状改善的相关性。本研究发现,MRgFUS治疗药物难治性ET术后,ET患者的震颤情况得到明显改善,术后右侧中央后回ReHo升高,且术前术后ReHo值的变化与临床震颤改善率呈正相关。本研究认为,MRgFUS治疗有助于缓解药物难治性ET患者震颤症状,能有效调节ET患者的右侧中央后回神经功能活动,其ReHo变化与震颤改善密切相关,提示ReHo可能是潜在预测MRgFUS术后震颤缓解的神经影像标志物。
目前,ET的rs-fMRI研究主要评估患者外科手术前的脑功能情况,对于MRgFUS术后导致的功能影像机制变化研究较少。根据既往以震颤为主的帕金森病(Parkinson's disease, PD)MRgFUS治疗的经验,发现以VIM为靶点消融的MRgFUS对药物难治性震颤PD患者术后自发性神经活动有影响,且这种影响与PD术后的震颤改善相关[9],这为本研究利用ReHo指标探讨ET患者MRgFUS术后局部脑功能变化提供数据支持。既往研究已经证实ET患者存在ReHo指标的异常,该指标异常主要分布在小脑-丘脑-皮层通路和非运动皮层[16]。既往研究也报道ReHo对于抑郁性ET[20]、鉴别ET和震颤为主的PD[21]同样具有指导作用。这些发现表明ReHo可以作为评价和检测ET患者的神经影像标志物。本研究在术前和术后都检测到了ReHo指标的异常,这与既往研究相一致[22, 23],提示该区域存在fMRI信号异常同步性,提示MRgFUS治疗对于ET患者自发性神经活动有影响。
本研究基于全脑体素分析发现MRgFUS治疗前后显著差异性脑区位于右侧中央后回。中央后回主要包含初级体感皮层(S1),是负责感觉的重要大脑区域[24, 25, 26]。既往研究已经证实中央后回与运动障碍性疾病密切相关,它为运动反馈回路提供外周本体感受信息[27],其通过小脑-丘脑皮质环路参与震颤调节[28]。Benito-León等[29]发现,ET患者的整体功能效率受到干扰,右中央后回的局部效率和聚类系数更高。因此本研究在确定MRgFUS治疗前后显著差异性脑区位于中央后回后,进一步提取该脑区ROI,探索MRgFUS治疗前后ReHo的变化情况。本研究发现与基线相比,MRgFUS治疗术后6个月、术后2年右侧中央后回ReHo值逐渐升高,且术后2年ReHo值较HC组无明显统计学差异,提示MRgFUS治疗对于ET患者自发性神经活动有影响。根据PD的MRgFUS短期随访研究发现短期随访患者初级体感皮层自发活动异常的影响约1周后恢复[30]。然而本研究显示,长达2年的纵向随访数据表明,中央后回局部脑功能改变并非术后短暂的神经功能重塑,而是持续存在的,提示中央后回可能参与了震颤调节。
查阅过往研究发现,ET患者ReHo的改变与MRgFUS诱导的震颤改善相关性尚不清楚。为了探索两者间的相关性,本研究进一步对CRST中各项评分变化与右侧中央后回的ReHo值变化进行相关性分析,以及ET组基线-MRgFUS术后2年临床震颤改善率与基线ReHo值进行相关性分析。本研究发现CRST中各项评分变化与右侧中央后回的ReHo值变化之间呈正相关趋势。基线-术后2年临床震颤改善率(CRST-A)与基线ReHo值呈显著负相关。提示我们ReHo指标对于预测ET患者的临床震颤改善有一定意义。MRgFUS导致患者的震颤改善具体机制尚不清楚,既往研究表明,MRgFUS导致的ET患者运动相关脑区连接减少与临床震颤评分相关[31]。长期随访经验提示MRgFUS术后的结构改变和多巴胺能特征之间存在一个长期的动态循环,提示可能与临床震颤的长期改善密切相关[7]。ET患者丘脑毁损术后的rs-fMRI研究显示,术后患者因被动手腕运动引起的初级体感皮层(Brodmann area 3a区)激活被抑制[32]。此外,与震颤改善较差的患者相比,中央后回与MRgFUS术后震颤改善显著相关,提示震颤改善与中央后回结构连接程度具有相关性[33]。以上发现支持了中央后回可能在ET患者震颤改善及MRgFUS术后震颤抑制中发挥一定作用,也支持了本研究结果中央后回的ReHo值的变化与临床震颤改善之间存在相关性。
首先,本研究的局限性为样本量相对较小,虽然本研究为纵向研究,采用单因素重复测量设计,能减少个体差异带来的误差,且ReHo指标是一个基于数据驱动的全脑体素水平分析方法,可以一定程度提高研究敏感度,节约被试,但未来增大样本量来对结果进一步验证仍然是有必要的。其次,本研究随访时期跨度较大,因新型冠状病毒肺炎疫情的暴发,患者6月随访完成后,2年再次进行影像随访,因此未来仍需要补充不同时间点的随访数据进一步体现局部功能的动态变化。最后,临床震颤评分可能受患者当时的状态及评估医生主观因素影响以及fMRI数据预处理无法完全排除生理噪声(呼吸、心率等)等影响。
综上所述,MRgFUS治疗有助于药物难治性ET患者缓解震颤症状和提高生活质量。本研究表明MRgFUS能有效调节ET患者的右侧中央后回神经功能活动,其ReHo变化趋势与震颤改善密切相关,提示ReHo有望成为预测MRgFUS术后震颤缓解的神经影像标志物,对理解MRgFUS术后震颤改善机制提供了神经影像学依据。
National Natural Science Foundation of China (No. 82151309).
全体作者均声明无利益冲突。































