
评价Kaiser评分与表观扩散系数(apparent diffusion coefficient, ADC)值对乳腺BI-RADS 4类病变的诊断效能。
回顾性分析2020年6月至2022年2月于河北省人民医院行乳腺MRI检查归类为BI-RADS 4类且病理结果明确的患者病例。对病例的每个病灶进行Kaiser评分、ADC值测量,Kaiser评分由两名放射科医生商议决定,ADC值的测量由经验丰富的医师指定感兴趣区域(region of interest, ROI)并测量,使用logistic回归联合Kaiser评分与ADC值后获得一个新的预测指标Kaiser+。应用受试者工作特征(receiver operating characteristic, ROC)曲线评价Kaiser评分和ADC值的诊断效能,应用Delong检验对曲线下面积(area under the curve, AUC)进行比较。
128例患者共165个病灶,Kaiser评分的总体诊断效能(AUC=0.882)显著高于ADC(AUC=0.582,P<0.05),Kaiser+与Kaiser评分之间的AUC无显著性差异(P=0.885)。与ADC相比,Kaiser评分诊断效能不受背景实质增强影响。
对于乳腺MRI诊断的BI-RADS 4类病变,Kaiser评分具有较高的诊断效能且优于ADC,可以减少不必要的活检;Kaiser评分与ADC值联合相对于单独Kaiser评分的诊断效能没有显著优势。

本刊刊出的所有论文不代表本刊编委会的观点,除非特别声明
乳腺癌是女性最常见的恶性肿瘤,MRI是鉴别乳腺内良恶性病变的重要影像学检查方法,敏感性很高[1]。扩散加权成像(diffusion-weighted imaging, DWI)及其定量参数表观扩散系数(apparent diffusion coefficient, ADC)值可应用于乳腺病变良恶性的评估,已有研究表明恶性病变的ADC值显著低于良性病变[2],可以避免不必要的临床干预[3]。目前DWI与动态对比增强(dynamic contrast enhanced, DCE)两种MRI检查序列联合应用可对乳腺癌进行影像学诊断[4],然而对于恶性概率跨度极大的乳腺影像报告和数据系统(Breast Imaging-Reporting and Data System, BI-RADS)4类病变的诊断价值有限,BI-RADS 4类病变的恶性概率为2%~95%[1,5],这预示部分良性病灶将被误诊为恶性病灶而接受不必要的手术,增加了患者的心理和经济负担。作为一种临床决策依据,纳入五种影像特征的Kaiser评分在评估乳腺病变方面具有极佳的敏感性和特异性[6, 7],分值从1到11,相关文献认为评分≥4建议进行活检[8, 9]。本研究的目的是比较Kaiser评分与ADC值对BI-RADS 4类病变的诊断效能,并获取Kaiser评分诊断良恶性的截断值,以减少不必要的有创活检。
回顾性分析2020年6月至2022年2月于河北省人民医院行术前乳腺3.0 T MRI平扫及动态对比增强检查的女性患者病例共128例,年龄9~83(47±13)岁。纳入标准:诊断报告为BI-RADS 4类的强化病灶;影像资料及病理结果完善、清晰。排除标准:MRI检查前行乳腺穿刺、手术或放化疗。本研究经河北省人民医院伦理委员会批准,免除受试者知情同意,批准文号:2022082。
所有病例MRI扫描采用美国GE 3.0 T MRI仪,使用16通道乳腺表面相控阵线圈,取俯卧位,扫描范围包括双侧乳腺及腋窝。轴位快速自旋回波T2WI脂肪抑制成像序列扫描参数:TR 7061 ms,TE 104.3 ms,层厚5 mm,层间距5 mm,FOV 350×350;轴位T1WI序列扫描参数:TR 420 ms,TE 7.6 ms,层厚5 mm,层间距5 mm,FOV 350×350;DWI序列扫描参数:TR 5113 ms,TE 66.6 ms,层厚5 mm,层间距5 mm,FOV 350 mm×210 mm,b值取1000 s/mm2;DCE-MRI扫描参数:TR 5.7 ms,TE 1.8 ms,层厚1.6 mm,层间距0,FOV 350 mm×350 mm,共采集7期图像,对比剂为钆喷酸葡胺,剂量0.2 mmol/kg,流速2 mL/s,注射后用20 mL生理盐水以3 mL/s的速度自动冲洗注射器。
由两位高年资乳腺诊断医师(诊断医师1为工作经验30年的主任医师;诊断医师2为工作经验15年的副主任医师)根据Kaiser评分系统解读所有检查结果,出现分歧时协商达成一致。该评分系统包括5个独立的诊断标准,即毛刺征、时间-信号强度曲线(time-signal intensity curve, TIC)类型、病变边缘、内部强化模式及瘤周水肿。两位诊断医师均不知道病理结果和BI-RADS 分级,计算并记录每个病变的最终Kaiser评分。Kaiser评分系统的流程图如图1所示。


所有MRI原始数据传到AW 4.2后处理工作站,应用Functool软件进行后处理,感兴趣区(region of interest, ROI)包括病灶的实性区域,避开坏死、囊变或出血的区域,避开纤维腺体及血管,测量每个ROI的ADC值及TIC,重复测量两次,以平均值作为最终数据。测量ADC值时,于DWI序列上病变明显高信号处勾画ROI。动态对比增强扫描采用乳腺容积成像即VIBRANT技术,第一期为蒙片,在第二或三期病变早期明显强化时勾画ROI测量TIC。背景实质增强(background parenchymal enhancement, BPE)即乳腺MRI图像上正常实质的强化,由两位高年资医生(诊断医师1为工作经验30年的主任医师;诊断医师2为工作经验15年的副主任医师)依据DCE-MRI图像按照BI-RADS系统分为4类:少量、轻度、中度、重度,分别代表<25%、25%~50%、51%~75%、>75%的腺体组织强化。
数据分析采用SPSS 25.0及MedCalc 20.0(Medcalc Software)软件处理,服从正态分布的计量资料以(±s)表示,组间比较采用独立样本t检验,应用配对卡方检验比较敏感度、特异度,采用Kappa值评价两种方法是否具有一致性。使用logistic回归联合Kaiser评分与ADC值作为一个新的预测指标Kaiser+。诊断效能采用受试者工作特征(receiver operating characteristic, ROC)曲线评估,应用准确度、敏感度、特异度、阳性预测值和阴性预测值评估诊断价值,应用DeLong检验比较曲线下面积(area under the curve, AUC),P<0.05为差异有统计学意义。
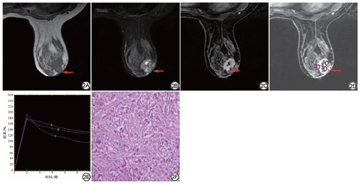
128例患者病例共165个病灶,其中肿块样病灶111个,非肿块样病灶54个;恶性67个,良性98个。恶性病灶中,浸润性导管癌27个,导管原位癌17个,导管内乳头状癌5个,导管原位癌伴浸润性导管癌8个,浸润性小叶癌4个,包裹性乳头状癌1个,浸润性筛状癌1个,浸润性癌伴黏液分化1个,黏液癌2个,浸润性微乳头状癌1个;良性病灶中,纤维腺瘤37个,导管内乳头状瘤25个,腺病17个,肉芽肿性乳腺炎7个,炎症4个,硬化性腺病4个,良性叶状肿瘤3个,良性肌上皮瘤1个。典型病例见图2。

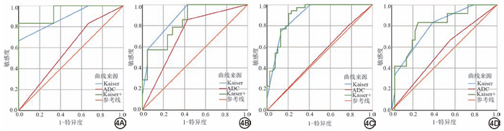
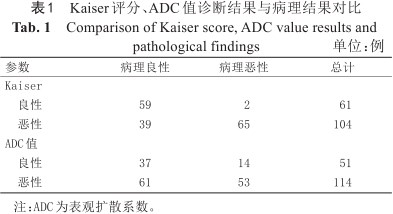
Kaiser评分与ADC值诊断结果见表1。恶性病变的Kaiser评分高于良性病变,ADC值低于良性病变,差异具有统计学意义(P<0.05),结果见表2。对于所有病变、肿块型强化病变,Kaiser评分的AUC均高于ADC值的AUC,差异具有统计学意义(P<0.001),但在非肿块病变中,差异无统计学意义(P=0.152)。Kaiser评分+的AUC在所有病变、肿块及非肿块型强化病变中均高于ADC值的AUC,差异具有统计学意义(P<0.05)。在所有病变、肿块及非肿块型强化病变中,Kaiser评分与Kaiser评分+AUC比较,差异均不具有统计学意义,结果见表3、图3。依据BI-RADS系统将BPE分为4类,比较Kaiser、Kaiser+与ADC值的AUC,结果见图4、表3。在BPE 1~4类乳腺中,Kaiser评分的AUC均高于ADC值的AUC,这表明Kaiser评分在诊断BI-RADS 4类病变时不受BPE影响。



Kaiser评分、ADC值诊断结果与病理结果对比 单位:例
Comparison of Kaiser score, ADC value results and pathological findings
Kaiser评分、ADC值诊断结果与病理结果对比 单位:例
Comparison of Kaiser score, ADC value results and pathological findings
| 参数 | 病理良性 | 病理恶性 | 总计 |
|---|---|---|---|
| Kaiser | |||
| 良性 | 59 | 2 | 61 |
| 恶性 | 39 | 65 | 104 |
| ADC值 | |||
| 良性 | 37 | 14 | 51 |
| 恶性 | 61 | 53 | 114 |
注:ADC为表观扩散系数。
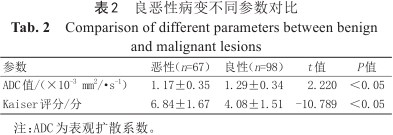
良恶性病变不同参数对比
Comparison of different parameters between benign and malignant lesions
良恶性病变不同参数对比
Comparison of different parameters between benign and malignant lesions
| 参数 | 恶性(n=67) | 良性(n=98) | t值 | P值 |
|---|---|---|---|---|
| ADC值/(×10-3 mm2/·s-1) | 1.17±0.35 | 1.29±0.34 | 2.220 | <0.05 |
| Kaiser评分/分 | 6.84±1.67 | 4.08±1.51 | -10.789 | <0.05 |
注:ADC为表观扩散系数。
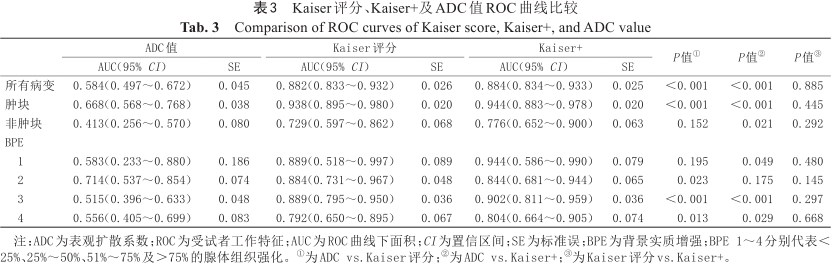
Kaiser评分、Kaiser+及ADC值ROC曲线比较
Comparison of ROC curves of Kaiser score, Kaiser+, and ADC value
Kaiser评分、Kaiser+及ADC值ROC曲线比较
Comparison of ROC curves of Kaiser score, Kaiser+, and ADC value
| ADC值 | Kaiser评分 | Kaiser+ | P值① | P值② | P值③ | ||||
|---|---|---|---|---|---|---|---|---|---|
| AUC(95% CI) | SE | AUC(95% CI) | SE | AUC(95% CI) | SE | ||||
| 所有病变 | 0.584(0.497~0.672) | 0.045 | 0.882(0.833~0.932) | 0.026 | 0.884(0.834~0.933) | 0.025 | <0.001 | <0.001 | 0.885 |
| 肿块 | 0.668(0.568~0.768) | 0.038 | 0.938(0.895~0.980) | 0.020 | 0.944(0.883~0.978) | 0.020 | <0.001 | <0.001 | 0.445 |
| 非肿块 | 0.413(0.256~0.570) | 0.080 | 0.729(0.597~0.862) | 0.068 | 0.776(0.652~0.900) | 0.063 | 0.152 | 0.021 | 0.292 |
| BPE | |||||||||
| 1 | 0.583(0.233~0.880) | 0.186 | 0.889(0.518~0.997) | 0.089 | 0.944(0.586~0.990) | 0.079 | 0.195 | 0.049 | 0.480 |
| 2 | 0.714(0.537~0.854) | 0.074 | 0.884(0.731~0.967) | 0.048 | 0.844(0.681~0.944) | 0.065 | 0.023 | 0.175 | 0.145 |
| 3 | 0.515(0.396~0.633) | 0.048 | 0.889(0.795~0.950) | 0.036 | 0.902(0.811~0.959) | 0.036 | <0.001 | <0.001 | 0.297 |
| 4 | 0.556(0.405~0.699) | 0.083 | 0.792(0.650~0.895) | 0.067 | 0.804(0.664~0.905) | 0.074 | 0.013 | 0.029 | 0.668 |
注:ADC为表观扩散系数;ROC为受试者工作特征;AUC为ROC曲线下面积;CI为置信区间;SE为标准误;BPE为背景实质增强;BPE 1~4分别代表<25%、25%~50%、51%~75%及>75%的腺体组织强化。①为ADC vs.Kaiser评分;②为ADC vs.Kaiser+;③为Kaiser评分vs.Kaiser+。
对于所有病变,Kaiser评分与ADC值诊断一致性较差(Kappa=0.192,95% CI:0.039~0.345,P=0.013),Kaiser评分的准确度(124/165,75%)高于ADC值的准确度(90/165,55%),但差异无统计学意义(P>0.05)。Kaiser评分的敏感度(65/67,97.0%)、特异度(59/98,60.2%)均高于ADC值的敏感度(53/67,79.1%)、特异度(37/98,37.8%),差异具有统计学意义(P<0.001)。根据ROC曲线确定约登指数,确定Kaiser评分评估BI-RADS 4类病变良恶性的截断值为4,截断值对应的敏感度为97.0%(65/67),特异度为60.2%(59/98),阳性预测值为62.5%(65/104),阴性预测值为96.7%(59/61)。对于所有病变应用Kaiser评分可以减少不必要的活检。
本研究采用随机对照研究中的配对设计方法评估了Kaiser评分、ADC值和两者联合在乳腺BI-RADS 4类病变诊断中的效能,结果显示在乳腺BI-RADS 4类病变中,Kiser评分诊断效能高于ADC值,可以减少临床不必要的活检,联合应用Kaiser评分和ADC值并不能显著提高诊断效能。本研究为国内首次在BI-RADS 4类病变中同时应用Kaiser评分和ADC值,并对两者的诊断效能做出比较。
DWI是一种功能MRI技术,被广泛应用于评估乳腺病变,可以提高MRI的诊断准确性[10, 11, 12],在临床上可以通过其定量参数ADC值评估组织中水分子的扩散程度[4,10]。在恶性病变中,由于肿瘤细胞增殖、细胞外空间受压,扩散受限,导致DWI信号增高,相应的ADC值降低。作为一种定量诊断工具,ADC值在初步评估乳腺病变良恶性方面表现良好,但ADC值容易受到病变成分及扫描参数的影响,并且对于那些表现为T2WI或DWI等信号、非肿块强化或存在广泛坏死的病变,测量其数值困难,导致其诊断效能下降,易出现假阴性结果;另外,某些病变如黏液癌,表现为ADC值升高,与良性病变相似,单独依靠ADC值容易误诊[13]。
Kaiser评分是Baltzer等[14]提出的一种病变分类算法,基于常规T2WI压脂序列及DCE-MRI序列,应用了五个独立的形态学及动态增强相关的特征,范围从1到11,提供了病变的恶性可能性,分数≤4时可以在很大程度上排除恶性,评分高则需要活检,评分结果不受设备参数及增强扫描期相影响[15],易于推广。相对于BI-RADS系统仅做到使诊断报告标准化,Kaiser评分可以作为诊断依据辅助评估病变良恶性。Kaiser评分的诊断标准符合BI-RADS[16],观察者间一致性良好,即使不同观察者的个人评分不同,但最终是否需要活检的最终结果是一致的,且重复性高[17, 18, 19]。Kaiser评分敏感性高,在高危女性中,采用4作为病变的阈值可以避免超过45% BI-RADS 4类的病灶进行不必要的活检[9],并且可以对X线表现为可疑恶性的钙化进行风险分层,降低58.3%~65.3%不必要的定向活检[8]。Rong等[20]得出结论,对比增强乳腺X线摄影技术与Kaiser评分结合有助于诊断BI-RADS 4A类病变,可以避免75.8%~82.1%不必要的良性乳腺病变活检。王珊等[21]的研究表明,Kaiser评分对BI-RADS 4类非肿块样强化病变具有较高的敏感性和准确性,与本研究结果一致。对于BI-RADS 3-5类病变中性质不明确的病灶,Kaiser评分也可以辅助诊断,提高诊断准确性,避免45.2%~60.8%的活检[22]。
本研究结果显示,Kaiser评分对于BI-RADS 4类病变的诊断效能高于ADC值,而且Kaiser评分不受BPE影响,在每个亚组均表现出良好的鉴别能力。研究证实[23],中重度BPE的女性患者DCE-MRI的敏感度低于轻微及轻度BPE的女性,高BPE可能会导致假阳性或假阴性[24],且高BPE可能是乳腺癌的独立危险因素[25]。Kaiser评分与ADC值两者的结合较单独Kaiser评分诊断效能并未见显著提高。当Kaiser评分<3时,对BI-RADS 4类病变的诊断未出现假阴性结果;当Kaiser评分>9时,对BI-RADS 4类病变的诊断未出现假阳性结果。当评分取截断值4时,敏感度、特异度、阳性预测值、阴性预测值分别为97.0%、60.2%、62.5%、96.7%。对于肿块、非肿块强化病变,Kaiser评分诊断效能均高于ADC值,但诊断非强化病变的特异性较其他研究低[26],这可能是由于本研究中非肿块病变较少,且多数为良性。Kaiser评分诊断的2例假阴性均为非肿块强化,均为导管原位癌,在评估Kaiser评分时TIC为流出型,被评价为4分,这是因为导管原位癌病灶区域基底膜周围有多少不等的新生血管,所以TIC形式多样,其中平台型最常见,且在导管原位癌诊断中TIC类型差异无统计学意义[27]。
本研究有一定的局限性:第一,由于乳腺病变早期筛查的普及,Kaiser评分为10、11分的病变较少,且由于选择偏倚导致本研究BI-RADS 4类病变恶性率(40.6%)高于文献报道[28],阳性预测值会偏高,后续研究中将严格掌握研究对象的纳入与排除标准,增加样本量。第二,在测量ADC值时没有评估病灶的大小,病灶较小会导致ADC值测量不准确,最近的研究证实Kaiser评分可以用来评估小于5 mm的病灶[29],这可能影响结果,后续研究可以将病灶按照大小进行分层分析。第三,在二维图像上勾画ROI忽略了病变异质性的影响,这可以通过使用ITK-SNAP软件进一步勾画三维容积ROI尽量避免。
综上所述,Kaiser评分对于BI-RADS 4类病变的诊断效能高于ADC值,有望降低不必要的穿刺活检率。与单纯的Kaiser评分相比,联合应用Kaiser评分和ADC值不能显著提高BI-RADS 4类病变的诊断效能。
Hebei Province Talent Training Project (No. A201901017).
全体作者均声明无利益冲突。



























