
探讨7.0 T MRI的信号强度比(signal intensity ratio, SIR)联合扩散张量成像(diffusion tensor imaging, DTI)对缺血性脑卒中大鼠的白质髓鞘损伤的诊断价值。
SD大鼠18只随机分成A、B、C三组,每组6只,A组进行大脑中动脉闭塞(middle cerebral artery occlusion, MCAO)假手术,暴露颈部血管而不结扎;B组为MCAO术后24 h组;C组为MCAO术后72 h组。相同条件下进行T1WI、T2WI、DTI扫描,后处理得到SIR、各向异性分数(fractional anisotropy, FA)、表观扩散系数(apparent diffusion coefficient, ADC)、垂直扩散张量(radial diffusivity, D⊥)图像,勾画胼胝体和外囊区域进行计算SIR值、FA值、ADC值和D⊥值,并进行三组间单因素方差分析。扫描结束后取材进行劳克坚牢蓝(luxol fast blue, LFB)-焦油紫病理染色,测量平均灰度值(mean grayscale value, MGSV)后进行3组间单因素方差分析。将差异具有统计学意义的影像学数据和病理学平均灰度值进行两两相关性分析。
与A组相比,B组外囊区域的SIR值(P=0.044)、FA值(P=0.001)、ADC值(P=0.001)、D⊥值(P=0.001)降低;C组外囊区域SIR值(P<0.001)、FA值(P=0.002)降低;胼胝体区域SIR值(P=0.031)、FA值(P=0.015)降低。LFB-焦油紫病理染色在脑卒中受损区域髓鞘着色较差,MGSV降低(P<0.05)。在外囊区域,MGSV与SIR值(P<0.0001)、FA值(P≤0.0001)、ADC值(P=0.0127)、D⊥值(P=0.0180)呈负相关。在胼胝体区域,MGSV与SIR值(P=0.0018)呈负相关。
SIR和DTI的联合使用作为一种评估缺血性脑卒中多阶段髓鞘损伤的无创影像学方法,在大鼠实验中得到有效验证,为临床诊治提供影像学思路。

本刊刊出的所有论文不代表本刊编委会的观点,除非特别声明
缺血性脑卒中是指脑供血动脉狭窄或闭塞、脑供血不足导致脑组织坏死[1]。据统计,脑卒中是全球第二大死亡疾病[2, 3],缺血性卒中占全国卒中病例的79.1%[3],幸存的卒中患者中四分之三都存在不同程度的神经功能丧失[3]。研究发现,脑白质对缺血影响更加敏感[4, 5]。白质中的髓鞘结构在缺血30 min后即可发生破坏,并进一步发展直至胶质瘢痕或组织坏死,导致不可逆的神经功能障碍[6, 7, 8]。因此,白质髓鞘的损伤是影响预后的关键因素之一,急需有效的手段对髓鞘改变进行检测。目前评估缺血性脑卒中髓鞘变化的影像学方法大多处于动物前临床研究阶段,本研究旨在使用影像学方法对缺血性脑卒中大鼠的早期髓鞘结构变化进行定量评估。
在相关的缺血性脑卒中髓鞘变化的基础实验研究中[6],提出了多种无创序列进行检测,他们存在图像微观结构能力较差、或图像太过耗时、或灰质髓鞘受水肿影响较大无法直观反映早期髓鞘变化等问题。因此,早期白质髓鞘急需有效的检测方法。近年来,有学者提出信号强度比(signal intensity ratio, SIR)对髓鞘微观结构的检测更敏感[9, 10],且SIR能够消除MRI图像强度偏差并增强髓鞘的信号对比度与信噪比。这一方法提出后相继应用在多发性硬化(multiple sclerosis, MS)患者尸检中的髓鞘定量评估[11, 12]和探究糖尿病患者脑深部髓鞘结构改变[13]等方面。扩散张量成像(diffusion tensor imaging, DTI)在评估脑卒中髓鞘变化方面被广泛应用[14],能敏感监测脑组织灰、白质微观结构的完整性,评估组织髓鞘及轴突等受损改变[15, 16, 17]。在当前的研究中,使用单一无创MRI成像技术检测髓鞘的改变情况仍存在争议。
本研究使用的是与人类缺血性脑卒中机制近似的大鼠大脑中动脉缺血闭塞脑模型(middle cerebral artery occlusion, MCAO)[18],应用SIR联合DTI多参数定量评估大鼠MCAO术后24 h和术后72 h白质髓鞘结构的变化值,与病理学指标进行线性拟合及相关性分析,为临床研究脑卒中早期髓鞘的损伤变化提供影像学和病理学依据。
所有实验程序均按照国家研究委员会实验室实验动物护理和使用指南进行,并经滨州医学院伦理委员会批准[(2022-204)号]。实验动物使用济南朋悦实验动物中心提供的18只无特定病原体级(SPF)6~8周龄(235~250 g)SD(Sprague Dawley)雄性大鼠。所有大鼠均饲养于滨州医学院实验动物中心清洁级动物房,维持12 h昼夜循环及(23±2)℃室温,湿度(50±5)%,大鼠适应环境至少3 d后开始实验。
18只SD大鼠随机分成A、B、C 3组,每组6只。A组进行MCAO假手术,B组为MCAO术后24 h组,C组为MCAO术后72 h组。MCAO手术方法如下:将SD大鼠用异氟烷麻醉后,经颈正中开口,暴露左侧颈总动脉(common carotid artery, CCA)和颈外动脉(external carotid artery, ECA)、颈内动脉(internal carotid artery, ICA),使用动脉夹夹闭CCA和ICA,结扎ECA,将24 mm线栓(深圳华阳实验室)沿着ECA、ICA到达大脑中动脉。假手术组大鼠只暴露左侧CCA、ICA、ECA,不做手术结扎。
MRI扫描采用滨州医学院医药研究中心Bruker 7.0 T小动物MR仪(Bruker BioSpec USR 70/20,Paravision 6.0.1,德国)。将大鼠用3%异氟烷气体麻醉后,采用四通道头部线圈进行头部定位扫描。T1WI(RARE序列)扫描参数:TR 1500 ms,TE 8 ms,翻转角90°,FOV 32 mm×32 mm,矩阵256×256,层厚 0.8 mm,层数 32;T2WI(TurboRARE 序列)扫描参数:TR 3500 ms,TE 33 ms,翻转角90°;DTI(EPI序列)扫描参数:TR 2000 ms,TE 21.5 ms,矩阵96×96,b值=1000 s/mm2,取30个不同方向。3组扫描方法及扫描参数一致。
处理SIR的过程中,使用MRIcroN软件对同一只大鼠提取T1WI、T2WI图像的脑组织区域,经过图像不均匀性校正和图像强度标准化处理后,计算T1WI和T2WI两者比值得到SIR图像[公式(1)]。DTI的处理方法为使用FSL软件进行头动校正及扩散梯度方向校正,获得b0相及基于b0相的脑组织掩模,并使用FSL Diffusion Toolkit程序提取,根据公式(2)、公式(3)、公式(4)得到表观扩散系数(apparent diffusion coefficient, ADC)、垂直扩散张量(radial diffusivity, D⊥)、各向异性分数(fractional anisotropy, FA)图像[19]。
在公式(1)中, 代表髓鞘,和分别表示T1WI和T2WI图像的敏感度,和表示比例因子。SIR的图像强度依赖、和、的简化(β),通过对和进行不均匀性校正,对和进行标准化,使SIR在不同大鼠之间具有可比性。
参照大鼠标准立体定位解剖图谱在bregma-0.4~1.20 mm(±0.1 mm)层面确定胼胝体、外囊的感兴趣区(regions of interest,ROI)。胼胝体和外囊的勾画由2名5年以上MRI研究经验的医师独立进行,并由1名10年以上MRI研究经验的医师进行复核。
大鼠扫描后用异氟烷麻醉,经心脏灌注固定PBS和4%多聚甲醛各1 h,取材后4%多聚甲醛浸泡24 h,流水冲洗24 h,酒精梯度脱水、石蜡包埋及在bregma-0.4~1.20 mm(±0.1 mm)位置制作8 μm切片,进行65 ℃劳克坚牢蓝(luxol fast blue, LFB)髓鞘染色1 h,焦油紫染液复染40 s。酒精梯度脱水,二甲苯透明,中性树脂封片。用Axioscope5显微镜(Carl Zeiss公司,德国)对大鼠切片以相同光学参数进行×400倍拍摄观察微观结构,使用体式显微镜(Olympus sz61,日本)对大鼠切片进行1.5倍全脑拍摄。使用Fiji软件对照大鼠脑组织病理学图谱,对9张1.5倍大鼠脑切片的胼胝体和外囊ROI区域逐张勾画,并使用软件内置算法计算每只大鼠LFB-焦油紫染色灰度图中ROI的平均灰度值(mean grayscale value, MGSV)。
数据统计学分析使用 GraphPad Prism 8.0.1和SPSS 26.0统计软件。数据采用Shapiro-Wilk方法进行正态性检验。计量资料以±s表示,ABC三组的影像学数据与病理学数据的比较采用单因素方差分析,对有统计学意义的数据进行两两比较,满足方差齐性的数据进行Bonferroni检验,不满足方差齐性的数据使用Tamhane T2检验(采用单尾检验)。使用Pearson相关系数对各影像指标及MGSV 进行两两相关性分析及线性拟合。P<0.05表示差异有统计学意义。0.4<R<0.69表示中度相关,0.7<R<0.89表示高度相关,0.9<R<1表示极高相关。
不同组别MCAO大鼠脑中具有代表性的T1WI、T2WI、SIR和DTI衍生的参数图像如图1所示,随着脑卒中的时间延长,各组别均可见外囊的显著信号变化,胼胝体变化不显著。
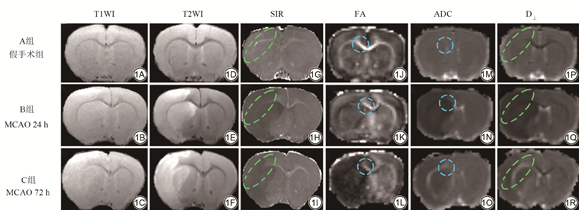

SIR值、FA值、ADC值和D⊥值定量结果使用单因素方差分析(表1)。SIR值与A组相比,B组的外囊的SIR值降低(P=0.044),C组外囊的SIR值降低(P<0.01),胼胝体值降低(P=0.031)。FA图像中,与A组相比,B组各ROI值差异无统计学意义,C组外囊的FA值降低(P=0.002),胼胝体的FA降低(P=0.015)。ADC图像中,与A组相比,B组外囊的ADC值降低(P=0.001),C组差异无统计学意义。D⊥图中,与A组相比,B组外囊的D⊥值降低(P=0.001),C组差异无统计学意义。
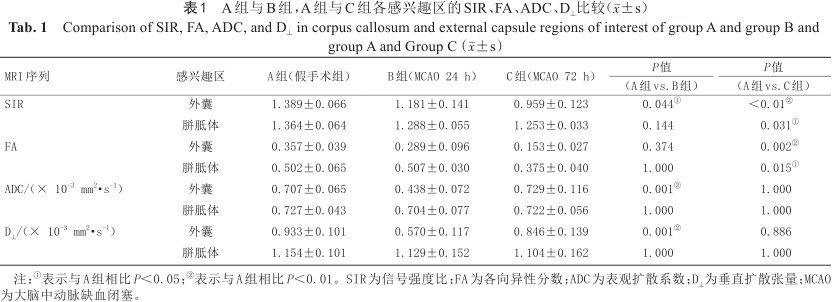
A组与B组,A组与C组各感兴趣区的SIR、FA、ADC、D⊥比较(±s)
Comparison of SIR, FA, ADC, and D⊥ in corpus callosum and external capsule regions of interest of group A and group B and group A and Group C(x¯±s)
A组与B组,A组与C组各感兴趣区的SIR、FA、ADC、D⊥比较(±s)
Comparison of SIR, FA, ADC, and D⊥ in corpus callosum and external capsule regions of interest of group A and group B and group A and Group C(x¯±s)
| MRI序列 | 感兴趣区 | A组(假手术组) | B组(MCAO 24 h) | C组(MCAO 72 h) | P值 | P值 |
|---|---|---|---|---|---|---|
| (A组vs.B组) | (A组vs.C组) | |||||
| SIR | 外囊 | 1.389±0.066 | 1.181±0.141 | 0.959±0.123 | 0.044① | <0.01② |
| 胼胝体 | 1.364±0.064 | 1.288±0.055 | 1.253±0.033 | 0.144 | 0.031① | |
| FA | 外囊 | 0.357±0.039 | 0.289±0.096 | 0.153±0.027 | 0.374 | 0.002② |
| 胼胝体 | 0.502±0.065 | 0.507±0.030 | 0.375±0.040 | 1.000 | 0.015① | |
| ADC/(× 10-3 mm2·s-1) | 外囊 | 0.707±0.065 | 0.438±0.072 | 0.729±0.116 | 0.001② | 1.000 |
| 胼胝体 | 0.727±0.043 | 0.704±0.077 | 0.722±0.056 | 1.000 | 1.000 | |
| D⊥/(× 10-3 mm2·s-1) | 外囊 | 0.933±0.101 | 0.570±0.117 | 0.846±0.139 | 0.001② | 0.886 |
| 胼胝体 | 1.154±0.101 | 1.129±0.152 | 1.104±0.162 | 1.000 | 1.000 |
注:①表示与A组相比P<0.05;②表示与A组相比P<0.01。SIR为信号强度比;FA为各向异性分数;ADC为表观扩散系数;D⊥为垂直扩散张量;MCAO为大脑中动脉缺血闭塞。
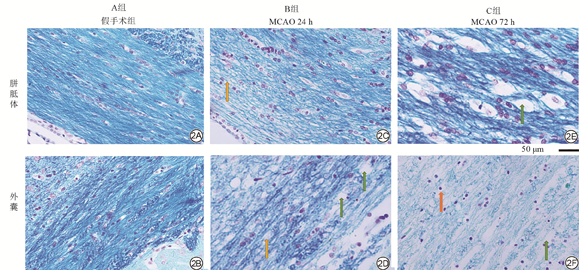
病理学染色结果如图2所示,与A组(图2A~2B)相比,胼胝体在B组(图2C)见髓鞘轻度紊乱,C组(图2E)可见髓鞘纤维走行紊乱,出现大量髓鞘空泡;外囊在B组(图2D)可见蓝色较浅,髓鞘纤维紊乱,出现髓鞘空泡,C组(图2F)见大片蓝染的髓鞘纤维丢失,尚可见部分髓鞘碎裂,可见紫色神经元大面积死亡。对LFB-焦油紫的病理学染色进行MGSV定量分析(表2),与A组相比,B组胼胝体的MGSV值升高(0.011),外囊的MGSV值升高(P<0.01);C组胼胝体的MGSV值升高(P<0.01),外囊的MGSC显著升高(P<0.01)。

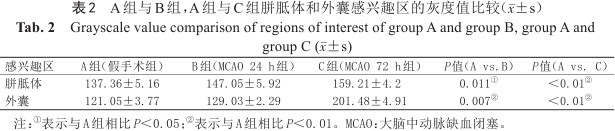
A组与B组,A组与C组胼胝体和外囊感兴趣区的灰度值比较(±s)
Grayscale value comparison of regions of interest of group A and group B, group A and group C (x¯±s)
A组与B组,A组与C组胼胝体和外囊感兴趣区的灰度值比较(±s)
Grayscale value comparison of regions of interest of group A and group B, group A and group C (x¯±s)
| 感兴趣区 | A组(假手术组) | B组(MCAO 24 h组) | C组(MCAO 72 h组) | P值(A vs.B) | P值(A vs. C) |
|---|---|---|---|---|---|
| 胼胝体 | 137.36±5.16 | 147.05±5.92 | 159.21±4.2 | 0.011① | <0.01② |
| 外囊 | 121.05±3.77 | 129.03±2.29 | 201.48±4.91 | 0.007② | <0.01② |
注:①表示与A组相比P<0.05;②表示与A组相比P<0.01。MCAO:大脑中动脉缺血闭塞。
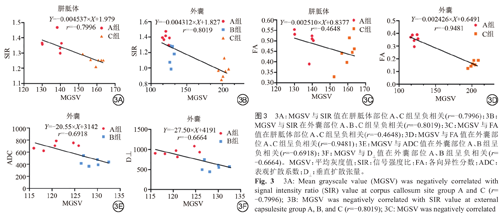
通过Pearson相关分析表明(图3),在外囊区域,MGSV与SIR值(P<0.0001)、FA值(P≤0.0001)、ADC值(P=0.0127)、D⊥值(P=0.0180)的差异具有统计学意义。且与SIR值的A、B、C三组均具有相关性,呈高度负相关。在A、C组与FA值极高相关,与ADC值和D⊥值中度相关。在胼胝体区域,MGSV与SIR值差异具有统计学意义(P=0.0018),而与FA值差异不具有统计学意义(P=0.1279),MGSV与SIR呈高度相关。

缺血性脑卒中的疾病发展过程中,多数患者预后较差、进而发展为不可逆的神经功能障碍[8]。研究发现[2],这可能是忽略了髓鞘较神经元更易发生缺血缺氧,白质髓鞘的损伤为影响预后的关键因素之一。这一理论提出后,数位学者[6,16, 17, 18, 19, 20]使用了各种无创影像手段检测髓鞘变化。Khodanovich等[20, 21]使用大分子质子分数技术,定量评估MCAO脱髓鞘改变,提供了无创监测MCAO灰质髓鞘损伤的技术可行性,但脑卒中24 h时脑水肿变化是无法避免的混杂因素[22]。Park等[23]使用髓磷脂水成像评估脑卒中患者康复过程中髓鞘的变化,但它反映微观结构能力较差,且相对耗时[24]。Sibon等[25]使用磁化转移评估脑卒中患者梗死区细微结构变化,髓鞘和轴突丢失可使磁化转移率降低,但是这种方法要满足髓鞘是中枢神经系统中大分子物质含量最多的假设条件,具有一定的局限性。Glasser等[9]提出的SIR在数学上消除了大多数与扫描相关的强度偏差,增强了对比度,节约时间且微观结构分辨清晰,在多发性硬化方向应用较为广泛,但分析结果时也要考虑水肿、炎症因素的干扰[22]。目前,使用何种序列对髓鞘评估较为准确仍存在争议。
本研究使用的是大鼠永久性大脑中动脉闭塞模型,该模型是STAIR组织[15]认可的相对更接近人类缺血脑卒中机制的模型。SIR的意义是在MRI中,T1WI的信号强度与髓鞘含量成正比,T2WI的信号强度与髓鞘成反比,因此SIR可突出正常髓鞘成分的信号,使其在SIR图中呈现高信号。当髓鞘受到炎症、水肿等破坏后会改变T1WI和T2WI的强度,因此在SIR中表现为低信号[9, 10],FA值通过信号减低检测到白质损伤[26],ADC值通过信号降低检测到组织尚未完全坏死[15,27],D⊥值通过信号升高检测到髓鞘损伤[28]。本研究在缺血性脑卒中后24 h,外囊部位SIR值降低,FA值虽降低但差异无统计学意义,ADC值降低,表明外囊部位发生髓鞘破坏,但白质结构存在,尚有活性。胼胝体部位SIR值降低,其他序列差异无统计学意义,表明胼胝体部位仅有轻度髓鞘变化,未发生结构改变,SIR在此部位检测较DTI的衍生参数灵敏。缺血性脑卒中后72 h,外囊部位SIR值降低,FA值降低,且ADC值和D⊥值较24 h升高,但与假手术组相比差异无统计学意义。表明随着疾病的进程发展,外囊部位的髓鞘和白质结构均发生坏死,活性大幅度降低。胼胝体部位SIR值降低,FA值降低但与病理学相关性差异无统计学意义,ADC值和D⊥值变化不显著,表明此部位髓鞘发生破坏,白质结构轻度破坏但仍有活性。
LFB髓鞘染色剂是一种油溶性染料,属于铜-酞菁染料,该染色剂能将髓鞘染成亮蓝色,其余背景染成无色或浅蓝色。在本实验中观察到,随着缺血性脑卒中病情的发展,胼胝体部位和外囊部位的蓝色着色降低。采用平均灰度法对彩色图像进行灰度转化,在灰度图中,MGSV取值范围为0~255,MGSV越接近255则灰度越浅,越接近0则灰度越深,即脱髓鞘组织表现为更浅的灰度,而正常髓鞘组织表现为更深的灰度。本实验中可见,髓鞘发生损伤的部位MGSV值高于对照组。
髓鞘损伤后,SIR值降低,FA值降低,MGSV值升高,表明SIR值与MGSV呈负相关,FA值与MGSV值呈负相关。从上述表格中可见,外囊处的MGSV值与SIR在A、B、C三组差异均具有统计学意义,且呈高度负相关,在胼胝体处,SIR的相关性高于FA。表明SIR可能在评价髓鞘改变方面优于FA。
本研究也存在局限性,首先本实验使用的是小样本量永久性的MCAO模型,该模型梗死范围大(约35%~45%),且未经过治疗,脑组织各部位损伤严重,在MRI及病理学上差异显著。而在临床中,大面积的梗死发病率低,且患者均经过治疗。因此本实验为较为理想的结果。其次SIR受外在影响因素较大,扫描序列的先后顺序会对图像的结果产生偏差,需要进行图像不均匀性校正和强度标准化处理。最后,本文主要进行的是早期髓鞘改变的研究,未进行长时程的髓鞘监测,将在后续监测大鼠用药后的再髓鞘的改变以完善实验。
本研究首次通过动物实验使用7.0 T MRI SIR联合DTI评估大鼠MCAO模型的脱髓鞘表现,能够无创可视化地早期检测缺血部位的髓鞘变化,提供了评估缺血性脑卒中多阶段髓鞘损伤的无创影像学方法,也为临床诊治缺血性脑卒中髓鞘损伤提供新的影像学思路。同时SIR技术不增加新序列的检测时间,减轻了患者的时间成本和经济负担。后续可在临床对缺血性脑卒中患者进行回顾性分析,也可联合DTI技术进行前瞻性分析,期望SIR髓鞘无创检测技术能够在指导脑卒中患者的临床用药、改善患者预后中发挥更大的作用。
National Natural Science Foundation of China (No. 81771828).
全部作者均声明无利益冲突。



























