
探究地方性氟骨症的全脊柱MRI表现,从整体角度评估其MRI特点。
回顾性分析35例地方性氟骨症患者的临床及全脊柱MRI影像学表现,对椎体骨质信号改变、后纵韧带及黄韧带骨化增厚、椎管狭窄、脊髓信号改变进行评估。
35例患者椎体T1WI及T2WI信号均匀或不均匀减低,均伴有不同程度的骨质增生(100.00%)。后纵韧带厚度为4~9(6.89±2.23)mm,以颈椎最明显。后纵韧带骨化增厚的脊椎节段共216个,其中C2~T1有158个脊椎节段(73.15%),T1~L1有42个(19.44%),L1~S1有16个(7.41%)。黄韧带厚度为4~8(5.25±1.44)mm。35个病例中,黄韧带单发病变7例,多发病变21例,共计108个病变分布于C4~L5水平,其中59个病变分布于T8~T12平面,占总数的54.63%。胸段及腰段黄韧带骨化增厚的发生率明显高于颈段。椎管狭窄30例(85.71%),脊髓受压27例(77.14%),脊髓受压伴T2WI高信号16例(45.71%),脊髓受压伴T1WI低信号8例(22.86%)。
地方性氟骨症病变累及范围广,全脊柱MRI可全面评估其脊柱骨质及周围韧带改变,从整体角度判断椎管狭窄、脊髓及神经受压情况等,为临床提供更准确、全面的影像学依据。

本刊刊出的所有论文不代表本刊编委会的观点,除非特别声明
氟骨症是由于人长期在高氟环境中生活而引起慢性氟中毒所形成的一系列骨关节损害性疾病,包括工业性氟骨症和地方性氟骨症。地方性氟骨症分为水型、茶型和燃煤污染型。内蒙古自治区部分地区是地方性氟骨症的高发病区,以饮水型和饮茶型为主,可能与饮用水中氟含量过高以及蒙古族喜饮砖茶密切相关[1]。研究表明,砖茶含氟量高,茶型氟骨症可能与血清中可溶性sK1otho成分变化有关[2]。氟骨症最易累及脊柱,通常以脊椎的骨质硬化、疏松、软化为特征,由于氟化物对脊柱中轴骨及周围软组织的损害,椎管内韧带出现钙化或骨化[3],致使椎管及椎间孔狭窄,并导致脊髓及神经不同程度地受压。既往研究多是关于氟骨症的发病机制、X线及CT表现,或是围绕颈椎、胸椎等单一部位[4, 5]。氟骨症病变累及范围广,常呈弥漫性或多节段性分布。本研究通过全脊柱MRI从整体角度探究地方性氟骨症患者的脊柱骨质信号改变、韧带骨化增厚的分布规律以及脊髓信号改变等特点,为临床诊治提供全面的影像学支持。
本回顾性研究遵照《赫尔辛基宣言》,经内蒙古自治区国际蒙医医院伦理委员会批准,免除受试者知情同意,批准文号:B2022-024。收集2018年1月至2021年12月在本院诊治经临床确诊的地方性氟骨症患者35例,其中蒙古族30例,汉族5例。男∶女比例为23∶12。年龄41~72(53.64±10.13)岁。纳入标准:(1)所有患者均来自内蒙古自治区地方性氟中毒高发病地区,在饮用高氟水的地区生活20年以上或长期饮用砖茶;(2)所有患者的X线或CT检查均显示脊柱有特异性影像改变;(3)尿氟化物含量均>1.6 mg/L(正常成人尿氟化物≤1.6 mg/L)。全部病例均按照《中华人民共和国卫生行业标准》中的《地方性氟骨症诊断标准》(WS/T192-2021)确诊。排除标准:(1)脊柱手术史、放化疗史或外伤史;(2)强直性脊柱炎、代谢性骨病等脊柱病变;(3)脊柱及椎管内占位性病变;(4)脊柱感染性病变或其他疾病可能累及脊柱者。
一般症状包括肢体无力、感觉异常、麻木、疼痛,且进行性加重,间歇性跛行甚至不同程度瘫痪,氟斑牙,括约肌功能障碍等。
应用全脊柱标准化扫描方案进行MRI检查。采用德国SIEMENS MAGNE ToE Avanto 1.5 T磁共振扫描仪,受试者仰卧于扫描床上,扫描中使用脊柱线圈。使用自动移床跟踪扫描技术将全脊柱分为颈部、胸部及腰部三段扫描,常规扫描序列包括T1WI序列、T2WI序列、短时翻转恢复(short time inversion recovery, STIR)序列。T1WI序列扫描参数:颈椎,TR 531 ms,TE 11 ms,FOV 240 mm×240 mm;胸椎,TR 607 ms,TE 11 ms,FOV 320 mm×320 mm;腰椎,TR 590 ms,TE 11 ms,FOV 280 mm×280 mm。T2WI序列扫描参数:颈椎,TR 3000 ms,TE 85 ms,FOV 240 mm×240 mm;胸椎,TR 3000 ms,TE 81 ms,FOV 320 mm×320 mm;腰椎,TR 3000 ms,TE 78 ms,FOV 300 mm×300 mm。STIR序列扫描参数:颈椎,TR 4000 ms,TE 82 ms,FOV 300 mm×300 mm;胸椎,TR 4000 ms,TE 82 ms,FOV 300 mm×300 mm;腰椎,TR 4000 ms,TE 82 ms,FOV 300 mm× 300 mm。颈椎、胸椎扫描层厚3 mm,层间距0.3 mm;腰椎扫描层厚3.5 mm,层间距0.35 mm。图像后处理使用Composing软件,分别拼接后自动生成全脊柱T1、T2、STIR图像。
由2名具有10年以上工作经验的影像医师分析图像,有争议处通过讨论达成一致。对于每位患者共评估23个椎体节段(从第二颈椎至第一骶椎),具体观察指标包括:(1)椎体信号有无均匀或不均匀减低;(2)椎体骨质增生;(3)后纵韧带骨化(ossification of the posterior longitudinal ligament, OPLL)增厚(厚度>2 mm);(4)黄韧带骨化(ossification of the ligamentum flavum, OLF)增厚(厚度>4 mm);(5)椎间盘突出;(6)椎管狭窄(硬膜囊前后径<10 mm);(7)脊髓信号改变(受压脊髓内是否出现T2WI高信号/T1WI低信号)。
应用SPSS 24.0对纳入对象的临床特征以及MRI影像特征进行统计分析。连续变量符合正态分布,用均数±标准差(±s)表示,计数资料用χ2检验。P<0.05为差异有统计学意义。
本研究纳入氟骨症患者35例,其中不同程度的肢体无力30例(85.71%)、间歇性跛行23例(65.71%)、括约肌功能障碍17例(48.57%)、四肢不全性瘫痪14例(40.00%),双下肢完全瘫痪5例(14.29%),氟斑牙29例(82.86%)。所有患者均进行全脊柱MRI扫描。
35例患者椎体内脂肪含量均减少,T1WI及T2WI信号强度表现为均匀或不均匀的不同程度减低,均伴有不同程度的骨质增生,其中颈椎间盘突出28例(80.00%)、胸椎间盘突出18例(51.43%)、腰椎间盘突出29例(82.86%)。硬膜囊前后径小于10 mm认为是椎管的绝对狭窄。椎管狭窄30例(85.71%),脊髓受压27例(77.14%),脊髓受压伴有T2WI高信号16例(45.71%),脊髓受压伴有T1WI低信号8例(22.86%)(图1A~1D)。
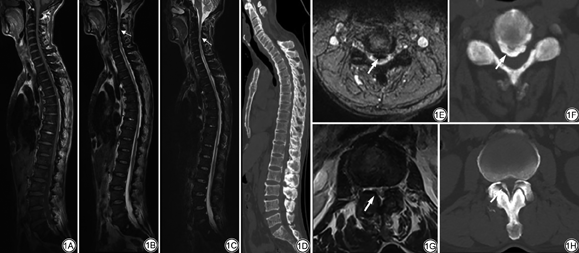

OPLL、OLF增厚表现为压迫硬膜囊或脊髓的不规则条状影,T1WI呈低或中等信号,T2WI呈低信号(图1E~1H)。后纵韧带正常表现为椎体后方线状稍低信号影,边缘光滑,厚度小于2 mm。OPLL分为两型:(1)连续型,OPLL连续2个椎体以上,即骨化的后纵韧带跨越椎间盘平面;(2)节段型,仅限于单个椎体后缘[6]。骨化增厚的后纵韧带厚度为4~9(6.89±2.23)mm,以颈椎最明显,均表现为连续型增厚,胸椎及腰椎后纵韧带多为节段性增厚。OPLL增厚的脊椎节段共216个,其中C2~T1有158个脊椎节段(73.15%),T1~L1有42个(19.44%),L1~S1有16个(7.41%)。颈段OPLL增厚的发生率明显高于胸段及腰段(表1)。颈段OPLL增厚以C4~C6平面最多见,C2~C7平面OPLL增厚均伴有相应层面椎管狭窄,且脊髓T2WI信号增高的发生率高于T1WI低信号(表2)。
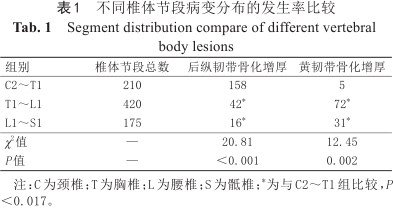
不同椎体节段病变分布的发生率比较
Segment distribution compare of different vertebral body lesions
不同椎体节段病变分布的发生率比较
Segment distribution compare of different vertebral body lesions
| 组别 | 椎体节段总数 | 后纵韧带骨化增厚 | 黄韧带骨化增厚 |
|---|---|---|---|
| C2~T1 | 210 | 158 | 5 |
| T1~L1 | 420 | 42* | 72* |
| L1~S1 | 175 | 16* | 31* |
| χ2值 | — | 20.81 | 12.45 |
| P值 | — | <0.001 | 0.002 |
注:C为颈椎;T为胸椎;L为腰椎;S为骶椎;*为与C2~T1组比较,P<0.017。
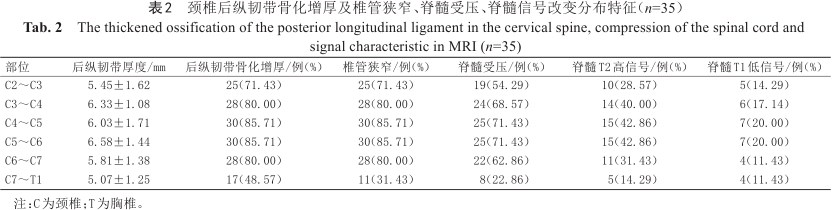
颈椎后纵韧带骨化增厚及椎管狭窄、脊髓受压、脊髓信号改变分布特征(n=35)
The thickened ossification of the posterior longitudinal ligament in the cervical spine, compression of the spinal cord and signal characteristic in MRI (n=35)
颈椎后纵韧带骨化增厚及椎管狭窄、脊髓受压、脊髓信号改变分布特征(n=35)
The thickened ossification of the posterior longitudinal ligament in the cervical spine, compression of the spinal cord and signal characteristic in MRI (n=35)
| 部位 | 后纵韧带厚度/mm | 后纵韧带骨化增厚/例(%) | 椎管狭窄/例(%) | 脊髓受压/例(%) | 脊髓T2高信号/例(%) | 脊髓T1低信号/例(%) |
|---|---|---|---|---|---|---|
| C2~C3 | 5.45±1.62 | 25(71.43) | 25(71.43) | 19(54.29) | 10(28.57) | 5(14.29) |
| C3~C4 | 6.33±1.08 | 28(80.00) | 28(80.00) | 24(68.57) | 14(40.00) | 6(17.14) |
| C4~C5 | 6.03±1.71 | 30(85.71) | 30(85.71) | 25(71.43) | 15(42.86) | 7(20.00) |
| C5~C6 | 6.58±1.44 | 30(85.71) | 30(85.71) | 25(71.43) | 15(42.86) | 7(20.00) |
| C6~C7 | 5.81±1.38 | 28(80.00) | 28(80.00) | 22(62.86) | 11(31.43) | 4(11.43) |
| C7~T1 | 5.07±1.25 | 17(48.57) | 11(31.43) | 8(22.86) | 5(14.29) | 4(11.43) |
注:C为颈椎;T为胸椎。
黄韧带正常厚度为2~4 mm。骨化增厚的黄韧带厚度为4~8(5.25±1.44)mm。35个病例中,单发病变7例,多发病变21例,共计108个病变分布于C4~L5平面,其中59个病变分布于T8~T12平面,占总数的54.63%。胸段及腰段OLF增厚的发生率明显高于颈段(表1)。
氟骨症最常累及脊柱,病变范围广,多为弥漫性或多节段性改变。临床表现为脊髓和神经压迫症状,包括肢体麻木、疼痛、活动受限,病变平面以下感觉减退,肢体肌力减退,腱反射活跃,病理征阳性,大小便困难,严重者出现瘫痪[7]。常规颈、胸、腰椎MRI受扫描范围限制,不能全面反映氟骨症病变的累及范围。本研究采用全脊柱MRI对氟骨症脊柱受累者进行研究,全面、直观地显示其椎体信号改变、韧带骨化增厚、椎间盘突出、椎管狭窄、脊髓受压并信号异常等影像改变,有助于病变的准确定位,避免遗漏病灶,为临床提供重要的影像信息。
本研究所有病例椎体脂肪含量均减少,T1WI及T2WI信号强度表现为均匀或不均匀减低,均伴有不同程度的骨质增生。研究发现,氟化物可激活并刺激成骨细胞增殖,使其生长速度加快、数量增加、功能增强[8, 9]。氟骨症患者骨组织内成骨活动增强,大量不含氢质子的矿物质沉积,导致椎体脂肪含量减少,椎体MRI信号减低,纵向弛豫相比横向弛豫更易受氢质子数目影响,因此椎体T1WI信号减低更早出现。椎体信号不均匀减低常表现为“三明治”征,因氟化物刺激甲状旁腺继发甲状旁腺激素分泌增多,骨中的钙离子通过椎体中央的静脉向外转运,因此椎体终板的钙盐沉积相对椎体中部较多,T1WI、T2WI表现为较椎体中央明显低信号[10]。
氟骨症患者易出现脊柱韧带骨化(ossification of the spinal ligament, OSL),是由于在氟化物的刺激下,从椎体中动员出的钙离子增多,体液中增多的钙离子被转运至邻近韧带,导致韧带骨化增厚[10]。主要包括OPLL和OLF,是临床上引起椎管狭窄及脊髓压迫的重要原因[11]。
后纵韧带位于椎管前部,起自枢椎,向上移行为覆膜,向下止于骶骨。OPLL进展缓慢,患者病程较长,早期可无任何临床症状,当骨化发展到一定程度引起脊髓或神经受压,产生颈肩部疼痛、躯体运动感觉障碍及直肠膀胱功能障碍等神经症状。OPLL最常发生于颈椎,胸椎及腰椎较少,常合并骨质增生[12, 13],最常累及的节段依次是C4、C5、C3,其次是上胸椎和上腰椎[14],本组病例OPLL是引起颈椎椎管狭窄的主要原因,与既往研究结果基本一致。本组患者颈椎后纵韧带多为连续性增厚,胸椎后纵韧带节段性增厚。在脊柱各个节段发病率不同可能是由于脊柱不同部位所受应力不同。文献报道在脊柱承受的屈伸、侧屈与旋转应力中旋转应力大小与OPLL发生情况呈正相关[15]。
黄韧带是椎管内维持脊柱稳定性的重要结构,连接邻近椎板并直接参与椎管侧后壁的组成。黄韧带由内侧的层间部分和侧面的包膜组成[16]。OLF起自包膜,逐步进展到层间区域,然后向腹侧进展压迫脊髓。在横断面,骨化从后侧开始,向硬膜侧进展[17]。OLF是慢性氟中毒的病理改变之一,胸椎OLF被认为是导致胸椎椎管狭窄的主要原因,导致脊髓及神经受压。OLF早期无明显症状,压迫脊髓表现为双下肢僵硬无力、间歇性跛行、腰背部及下肢疼痛,起病隐匿,一旦出现脊髓压迫导致其运动神经功能严重损害时,致瘫率极高[18]。颈椎、胸椎和腰椎均可发生,其中最常发生在胸椎[19, 20, 21],好发部位依次为下胸段(T9~T12)、上胸段(T1~T4)和中胸段(T5~T8),最好发于T10和T11之间[22, 23]。本组病例OLF增厚以多发性病变为主,胸段及腰段OLF增厚的发生率明显高于颈段,多发生在T8~12平面,与既往研究结果基本一致,推测此处位于胸腰交界处,小关节旋转活动度较大,机械应力增加,在长期反复的应力作用下黄韧带易发生退变及损伤。
有研究认为由于氟骨症OPLL使椎间盘不易突出[13]。但严重者由于氟化物沉积过多,胶原纤维疏松,椎间盘纤维环易发生变性和破裂,表现为椎间盘向侧后方突出,压迫椎间孔及侧隐窝,产生相应的神经压迫症状[17]。本组患者椎间盘突出发生率较高,推测可能与患者随着年龄增长,合并脊柱退变及氟化物沉积过多有关。
氟骨症患者常伴有椎管狭窄及不同程度的脊髓受压,严重者出现脊髓信号改变。氟骨症患者脊髓早期出现T2WI稍高信号,以脊髓水肿为主,此时T1WI信号无异常。中期以神经细胞变性坏死为主,晚期以空洞或囊性坏死为主,T2WI信号增高,T1WI信号逐渐减低。研究表明,早期水肿改变具有可逆性,中晚期病变是不可逆损伤[24, 25]。本研究由于入组病例脊髓受压程度不同,T2WI脊髓局部信号增高包括了脊髓早、中、晚三期损伤,而T1WI低信号出现在脊髓损伤较严重的患者,因此脊髓T2WI信号增高的发生率高于T1WI低信号。脊髓出现T1WI低信号提示脊髓神经坏死、囊性改变,T1WI低信号提示治疗效果不佳[26, 27]。另有研究者认为脊髓T2WI稍高信号具有一定的可逆性,不一定预示疗效欠佳,但T2WI出现长节段的高信号时,预示治疗效果不佳[28, 29]。
椎体MRI信号减低可见于多种疾病,如骨髓纤维化、肾性骨病、硬化性骨病等[30],但如果患者来自高氟地区,伴有OPLL及OLF增厚,要优先考虑氟骨症可能。全脊柱MRI可同时显示多部位病灶,对于多发性或弥漫性脊柱、韧带及脊髓病变的诊断作用尤为突出[31, 32, 33]。
本研究存在以下局限性:(1)仅从整体角度研究氟骨症患者的全脊柱MRI特点,缺乏对照研究;(2)对于椎体脂肪含量改变缺乏定量评估;(3)对于椎管狭窄的分度以及脊髓信号变化缺乏深入研究。未来将针对以上局限性进一步研究,并采用全脊柱MRI对氟骨症患者临床治疗方案的选择、疗效及预后评估等方面展开研究。
综上,本研究采用全脊柱MRI从整体角度评价地方性氟骨症患者椎体信号特点、韧带骨化增厚的分布规律以及脊髓信号变化等,为临床诊治提供充分的影像学依据,对于提高地方性氟骨症患者的生存质量具有重要意义。
Inner Mongolia Health Science and Technology Plan Project (No. 202202061).
李正然, 李斯琴, 李帆, 等. 地方性氟骨症的全脊柱MRI影像学特征分析[J]. 磁共振成像, 2023, 14(2): 87-91.
LI Z R, LI S Q, LI F, et al. Whole spine MRI findings in endemic fluorosis[J]. Chin J Magn Reson Imaging, 2023, 14(2): 87-91.
全体作者均声明无利益冲突。



























