
探讨单独及联合应用酰胺质子转移(amide proton transfer, APT)成像和扩散峰度成像(diffusion kurtosis imaging, DKI)对乳腺良恶性病变的鉴别诊断价值,并分析瘤周参数与乳腺癌病理因素的相关性。
回顾性分析56例乳腺病变患者病例资料,术前均行扩散加权成像(diffusion-weighted imaging, DWI)、APT、DKI及动态对比增强(dynamic contrast-enhanced, DCE)MRI,测量瘤体、瘤周及对侧正常腺体的非对称磁化转移率(magnetization transfer ratio asymmetry, MTRasym)、平均扩散峰度(mean kurtosis, MK)、平均扩散率(mean diffusivity, MD),并记录病灶的表观扩散系数(apparent diffusion coefficient, ADC)值及乳腺影像报告和数据系统(Breast Imaging Reporting and Data System, BI-RADS)分类。对比分析良恶性组间各参数的差异,采用logistic回归分析建立联合诊断模型,采用受试者工作特征(receive operating characteristic, ROC)曲线分析不同参数及联合模型对乳腺良恶性病变的诊断效能。分别计算瘤周与瘤体MTRasymp/t、MKp/t、MDp/t及与对侧正常腺体MTRasymp/n、MKp/n、MDp/n的比值,并比较其在不同病理因素组间的差异性。
恶性组MK值高于良性组,ADC、MD、MTRasym值低于良性组,差异均有统计学意义(P均<0.05)。ADC、MK、MD、MTRasym、DCE、DCE+ADC、DCE+ADC+DKI+APT诊断乳腺良恶性病变的曲线下面积(area under the curve, AUC)分别为0.819、0.914、0.895、0.752、0.744、0.886、0.985,MK、MD的AUC显著高于DCE,MK的AUC高于MTRasym,DCE+ADC+DKI+APT联合模型的AUC显著高于其他任何参数(P均<0.05)。瘤周参数分析结果显示:MKp/t与HER-2状态呈弱负相关(r=-0.365,P=0.043);MKp/t与Ki-67表达呈中度负相关(r=-0.404,P=0.024),MDp/t与Ki-67呈中度正相关(r=0.420,P=0.019);MKp/n与淋巴血管侵犯(lymphovascular invasion, LVI)呈弱正相关(r=0.382,P=0.034),MDp/n与LVI呈弱负相关(r=-0.373,P=0.039);MKp/n与组织学分级呈弱正相关(r=0.376,P=0.043)。
APT和DKI技术在鉴别乳腺良恶性病变时均表现出较高的诊断效能,且多参数联合应用的诊断效能显著提高。DKI参数可提示不同病理因素的乳腺癌对瘤周区域的影响。因此,APT及DKI技术可为乳腺癌的诊断、肿瘤侵袭性的评估以及治疗方案的制订提供帮助。

本刊刊出的所有论文不代表本刊编委会的观点,除非特别声明
根据2020年全球癌症统计数据,女性乳腺癌发病率为11.7%,成为全球发病率最高的癌症,死亡率为6.9%,位居第五位[1]。乳腺癌的分子亚型和肿瘤的异质性是目前公认的影响治疗和预后的重要因素[2, 3]。不同分子亚型乳腺癌的治疗方案和预后有所不同,如Luminal型的乳腺癌对于内分泌治疗敏感,通常预后较好;人表皮生长因子受体2(human epidermal growth factor receptor 2, HER-2)过表达型的乳腺癌则对靶向治疗较为敏感,但易发生早期复发,预后不佳;而三阴性乳腺癌对于化疗效果不佳,具有较高的复发和转移风险,预后最差。除分子亚型外,肿瘤异质性也影响着治疗和预后,不同的肿瘤成分、肿瘤细胞的分化程度以及细胞状态的差异造成了肿瘤生物学行为上的不同[4]。OSHIRO等[5]的研究表明高级别肿瘤的五年无复发生存率低于低级别肿瘤。KIM等[6]研究发现高异质性的肿瘤可介导治疗耐药。此外,肿瘤环境的作用也很重要,它是肿瘤组织与周围微环境之间相互作用的结果,不仅影响肿瘤的演化和发展,而且可以在一定程度上反映病理预后因素[7]。目前对于分子亚型和肿瘤异质性诊断的金标准仍是病理学检验,但既往有许多运用影像学方法诊断乳腺癌的分子亚型和肿瘤异质性的研究,例如,乳腺超声将形态学特征与分子亚型进行对照[8],并可反映病变血流情况,检查操作方便、快捷;乳腺X线摄影同样是通过形态学反映病变信息,其对于病变内钙化更为敏感。但这两种影像方法“同病异影”“异病同影”的情况普遍,缺乏定量参数,其科学性有待提高。MRI作为一种无创、无辐射、具有高软组织分辨率的检查方法,已被广泛用于对乳腺癌及其分子亚型和预后因素的诊断中。MRI可进行多序列成像,能从多角度反映病变信息。常规平扫序列可以对病变的形态学特征、周围组织结构关系等进行评估,也可以反映病变内部的出血、坏死等,但不能评估血供及细胞密度等微观信息;扩散加权成像(diffusion-weight imaging, DWI)虽可以通过量化水分子的扩散运动来反映肿瘤细胞密度和微结构复杂程度,并可通过计算得到表观扩散系数(apparent diffusion coefficient, ADC)进行定量测量,但因其基于高斯扩散模型,无法真实地反映水分子在组织中的实际运动;动态对比增强(dynamic contrast-enhanced, DCE)MRI具有较高的敏感性,可以对病变的形态学特征进行更好地评估,还可以提供血流动力学信息,然而钆喷酸葡胺(gadopentetate dimeglumine, Gd-DTPA)作为外源性对比剂可能会引起过敏反应,同时,由于良性和恶性病变的时间-信号强度曲线(time intensity curve, TIC)的部分重叠及较多假阳性结果的存在,DCE-MRI对于乳腺癌诊断的特异性有待提高[9]。扩散峰度成像(diffusion kurtosis imaging, DKI)和酰胺质子转移(amide protontransfer, APT)成像是新兴的功能MRI技术。DKI是JENSON等[10]于2005年提出的一种扩散成像技术,其基于非高斯扩散模型,与传统的DWI相比,DKI充分考虑了水分子在组织内部的真实扩散运动,并在其模型框架中引入了四阶三维张量,从而能够准确地评估组织的微观结构复杂性。APT是ZHOU等[11]于2003年提出的一种由化学交换饱和转移(chemical exchange saturation transfer, CEST)成像技术发展而来的MRI方法,无需外源性对比剂即可测量组织内游离蛋白质和多肽含量。国内外已有多篇文献报道了APT及DKI用于乳腺良恶性病变的鉴别诊断、分子亚型的鉴别、病理分级差异以及预测新辅助化疗(neoadjuvant chemotherapy, NAC)疗效等方面的研究。MENG等[12]和KANG等[13]的研究显示了APT及DKI参数在乳腺良恶性病变、不同病理分级、淋巴结转移及分子亚型间存在差异,同时,也有研究证实了APT和DKI可用于评估和预测NAC疗效[14, 15]。然而,既往研究多是对于瘤体进行研究,缺乏瘤周区域的研究,无法反映肿瘤对于瘤周区域的影响,从而导致治疗和预后的差别。例如,瘤周间质纤维化程度的增加与肿瘤较高的侵袭性有关[16],而瘤周淋巴血管侵犯(lymphovascular invasion, LVI)的存在与较高的远处转移率及死亡率有关[17],BRAMAN等[18]发现瘤周区域特征的差异可用于预测NAC后病理完全缓解(pathologic complete response, pCR)。本研究旨在探讨单独及联合应用APT及DKI对乳腺良恶性病变的鉴别诊断价值,并研究乳腺癌瘤周区域相关参数与病理因素之间的关系,为乳腺癌的诊断和预后评估提供新的思路。
本研究遵守《赫尔辛基宣言》,并经新乡医学院第一附属医院伦理委员会批准,免除受试者知情同意,批准文号:2020034。回顾性分析新乡医学院第一附属医院2019年5月至2021年6月接受MRI检查的乳腺病变患者病例资料。纳入标准:(1)临床怀疑乳腺病变,行MRI检查;(2)MRI检查后1周内行手术治疗。排除标准:(1)MRI检查前接受过穿刺活检或放化疗;(2)MRI图像质量不佳,达不到诊断分析标准;(3)双侧乳腺病变;(4)瘤周腺体稀疏,无法测量瘤周参数;(5)非肿块样病变;(6)病理资料缺失。
使用3.0 T MRI扫描仪(Discovery MR 750, GE Healthcare, 美国),乳腺专用8通道相控阵线圈。患者取俯卧位,双乳自然悬垂在线圈内。扫描序列及参数包括:(1)横轴位T1WI使用快速自旋回波(fast spin echo, FSE)序列,FOV 32 cm×32 cm,层厚4 mm,层间距1 mm,TR/TE 453.0/5.9 ms;(2)横轴位非对称回波的最小二程估算法迭代水脂分离(iterative decomposition of water and fat with echo asymmetric and leastsquares estimation, IDEAL)T2WI使用FSE序列,FOV 32 cm×32 cm,层厚4 mm,层间距1 mm,TR/TE 4914.0/85.0 ms;(3)DWI使用单次激发回波平面成像(single-shot echo-planar imaging, SS-EPI)序列,b值0、1000 s/mm2,FOV 32 cm×32 cm,层厚4 mm,层间距1 mm,TR/TE 2743.0/56.6 ms;(4)DKI使用SS-EPI序列,b值0、500、1000、1500、2000 s/mm2,FOV 32 cm×32 cm,层厚4 mm,层间距1 mm,TR/TE 2500.0/68.7 ms;(5)APT使用EPI序列,FOV 32 cm×32 cm,层厚4 mm,TR/TE 2500.0/10.0 ms,射频脉冲2.0 μT,饱和时间500 ms,饱和频率52个,分别为3个5000 Hz,之后为+600~-600 Hz(间隔25 Hz)和0 Hz;(6)横轴位3D-Vibrant DCE序列,FOV 32 cm×32 cm,TR/TE 4.2/2.1 ms,对比剂为Gd-DTPA(马根维显,Bayer Schering Pharma AG,德国),采用高压注射器经肘静脉以2.0 mL/s的流速快速团注,剂量为0.1 mmol/kg,注药前扫描一期蒙片,若无异常,则进行扫描,连续扫描7期。
将APT、DKI图像传输至GE AW 4.6工作站(Advantage Vorkstation 4.6,GE Healthcare,美国),采用Functool工具包中的APT、DKI软件对图像进行后处理。由2名分别具有5年和15年乳腺MRI影像诊断经验的主治医师及副主任医师采用盲法测量MTRasym、MK、MD值。(1)瘤体感兴趣区(region of interest, ROI)选取:选择肿瘤最大层面,在肿瘤实质中勾画三个面积相近的ROI,尽量避开囊变、出血、坏死的区域;(2)瘤周ROI选取[19]:选择肿瘤最大层面,在靠近肿瘤边缘5 mm范围内的腺体组织中放置三个ROI,每个ROI>20 mm2,ROI尽可能放置在病变前、后、左、右四个方向,若某一方向无腺体组织,则放置在腺体组织较丰富的区域;(3)对侧腺体ROI选取:在病变对侧正常腺体放置三个面积约100 mm2的ROI,每个ROI尽可能放置在腺体组织较丰富的区域,尽量避免脂肪组织及异常强化区(图1)。
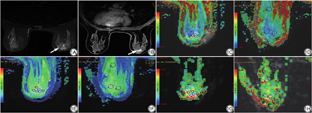

分别测量瘤体、瘤周及对侧腺体平均扩散峰度(mean kurtosis, MK)、平均扩散率(mean diffusivity, MD)和非对称磁化转移率(magnetization transfer ratio asymmetry, MTRasym);为了减少不同个体腺体异质性的影响,将瘤周各参数分别与瘤体及对侧腺体作比值,来反映瘤周区域的微环境变化,瘤周与瘤体的比值记为MTRasymp/t、MKp/t、MDp/t,瘤周与对侧正常腺体的比值记为MTRasymp/n、MKp/n、MDp/n(p=peritumoral、t=tumour、n=normal)。根据乳腺影像报告和数据系统(breast imaging-reporting and data system, BI-RADS)记录病变的大小(最大直径)、形态、TIC类型及BI-RADS分类(3类认为是阴性,4类和5类认为是阳性)[20]。在DWI图像上测量肿瘤的ADC值。
所有乳腺浸润性癌病例检测雌激素受体(estrogen receptor, ER)、孕激素受体(progesterone receptor, PR)、HER-2及Ki-67状态。细胞核ER/PR染色≥1%定义为阳性[21];HER-2“-”或“+”定义为阴性,“3+”定义为阳性,对“2+”的病例进一步行原位杂交检测,显示基因扩增的样本被定义为阳性,否则为阴性[22];Ki-67表达≥14%定义为高表达,<14%定义为低表达[23];若瘤周淋巴管或小血管内存在癌栓,定义为LVI阳性,否则为阴性[24];采用Nottingham组织学分级系统[25]对浸润性乳腺癌进行组织学分级;淋巴结转移结果由淋巴结标本的病理结果确定。
采用SPSS 25.0(IBM,美国)及Medcalc 20.0.0(MedCalc Software Ltd,比利时)软件进行统计学分析。组内相关系数(intra-class correlation coefficient, ICC)用于评估观察者间的一致性。采用Shapiro-Wilk检验数据正态性。符合正态分布的计量资料以均数±标准差(±s)表示,不符合正态分布的计量资料以中位数(上下四分位数)表示,分类变量以频数表示。采用独立样本t检验、Mann-Whitney U检验和χ²检验比较良恶性组及病理因素组间各参数的差异。将单因素差异有统计学意义的变量纳入logistic回归分析,建立联合诊断模型。采用受试者工作特征(receive operating characteristic, ROC)曲线评估各参数对于良恶性病变的诊断效能。DeLong检验用于比较不同参数曲线下面积(area under the curve, AUC)差异是否有统计学意义。采用Spearman相关性分析探讨瘤周参数与病理因素之间的相关性。P<0.05为差异具有统计学意义。
共收集89例患者病例资料,其中33例被排除:(1)扫描序列不完整或图像质量不佳(n=5);(2)无病理结果(n=5);(3)接受过新辅助化疗(n=1);(4)双侧乳腺病变(n=6);(5)非肿块样病变(n=7);(6)无法测量瘤周参数(n=9)。共纳入56例患者病例资料,共56个病灶。良性组25例,其中:纤维腺瘤11例、腺病5例、腺病伴纤维腺瘤4例、导管上皮增生2例、导管内乳头状瘤1例、导管囊性扩张1例、囊肿1例;恶性组31例,其中:非特殊浸润性癌27例、浸润性小叶癌2例、导管原位癌1例、髓样癌1例。良性组与恶性组间年龄、最大径、形态、TIC曲线及BI-RADS分类的差异有统计学意义(P均<0.05)。详见表1。
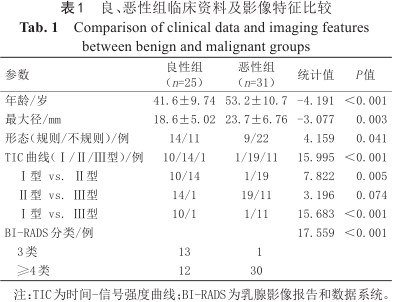
良、恶性组临床资料及影像特征比较
Comparison of clinical data and imaging features between benign and malignant groups
良、恶性组临床资料及影像特征比较
Comparison of clinical data and imaging features between benign and malignant groups
| 参数 | 良性组(n=25) | 恶性组(n=31) | 统计值 | P值 |
|---|---|---|---|---|
| 年龄/岁 | 41.6±9.74 | 53.2±10.7 | -4.191 | <0.001 |
| 最大径/mm | 18.6±5.02 | 23.7±6.76 | -3.077 | 0.003 |
| 形态(规则/不规则)/例 | 14/11 | 9/22 | 4.159 | 0.041 |
| TIC曲线(Ⅰ/Ⅱ/Ⅲ型)/例 | 10/14/1 | 1/19/11 | 15.995 | <0.001 |
| Ⅰ型 vs. Ⅱ型 | 10/14 | 1/19 | 7.822 | 0.005 |
| Ⅱ型 vs. Ⅲ型 | 14/1 | 19/11 | 3.196 | 0.074 |
| Ⅰ型 vs. Ⅲ型 | 10/1 | 1/11 | 15.683 | <0.001 |
| BI-RADS分类/例 | 17.559 | <0.001 | ||
| 3类 | 13 | 1 | ||
| ≥4类 | 12 | 30 |
注:TIC为时间-信号强度曲线;BI-RADS为乳腺影像报告和数据系统。
2名医师所测得的瘤体、瘤周及对侧正常腺体的MTRasym、MK、MD及ADC值一致性均较高(ICC均>0.75),取两者平均值进行统计分析。独立样本t检验结果显示,恶性组的ADC、MD和MTRasym值显著低于良性组,MK值显著高于良性组(P均<0.05)。详见表2。
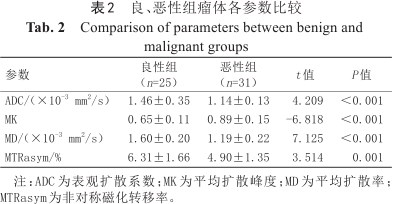
良、恶性组瘤体各参数比较
Comparison of parameters between benign and malignant groups
良、恶性组瘤体各参数比较
Comparison of parameters between benign and malignant groups
| 参数 | 良性组(n=25) | 恶性组(n=31) | t值 | P值 |
|---|---|---|---|---|
| ADC/(×10-3 mm2/s) | 1.46±0.35 | 1.14±0.13 | 4.209 | <0.001 |
| MK | 0.65±0.11 | 0.89±0.15 | -6.818 | <0.001 |
| MD/(×10-3 mm2/s) | 1.60±0.20 | 1.19±0.22 | 7.125 | <0.001 |
| MTRasym/% | 6.31±1.66 | 4.90±1.35 | 3.514 | 0.001 |
注:ADC为表观扩散系数;MK为平均扩散峰度;MD为平均扩散率;MTRasym为非对称磁化转移率。
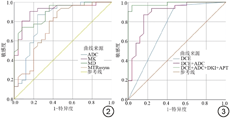
Logistic回归分析显示,BI-RADS、ADC、MK、MD和MTRasym诊断乳腺良恶性病变的优势比分别为:11.904、0.274、8.249、0.133和0.311。ROC曲线分析结果显示:ADC、MK、MD、MTRasym、DCE、DCE+ADC、DCE+ADC+DKI+APT诊断乳腺良恶性病变的AUC分别为0.819、0.914、0.895、0.752、0.744、0.886、0.985;MK、MD的AUC显著高于DCE,MK的AUC显著高于MTRasym(P均<0.05),MK、MD、MTRasym的AUC与ADC的差异无统计学意义(P均>0.05);DCE+ADC联合模型的AUC显著高于DCE(P<0.05),DCE+ADC+DKI+APT联合模型的AUC显著高于其他任何参数及DCE+ADC联合模型(P均<0.05)。详见表3、4及图2、3。
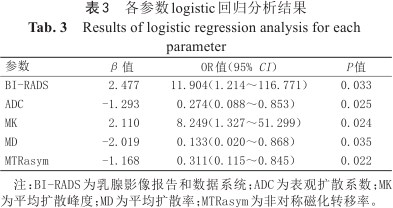
各参数logistic回归分析结果
Results of logistic regression analysis for each parameter
各参数logistic回归分析结果
Results of logistic regression analysis for each parameter
| 参数 | β值 | OR值(95% CI) | P值 |
|---|---|---|---|
| BI-RADS | 2.477 | 11.904(1.214~116.771) | 0.033 |
| ADC | -1.293 | 0.274(0.088~0.853) | 0.025 |
| MK | 2.110 | 8.249(1.327~51.299) | 0.024 |
| MD | -2.019 | 0.133(0.020~0.868) | 0.035 |
| MTRasym | -1.168 | 0.311(0.115~0.845) | 0.022 |
注:BI-RADS为乳腺影像报告和数据系统;ADC为表观扩散系数;MK为平均扩散峰度;MD为平均扩散率;MTRasym为非对称磁化转移率。
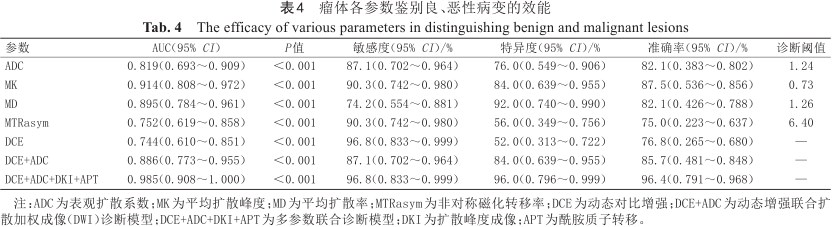
瘤体各参数鉴别良、恶性病变的效能
The efficacy of various parameters in distinguishing benign and malignant lesions
瘤体各参数鉴别良、恶性病变的效能
The efficacy of various parameters in distinguishing benign and malignant lesions
| 参数 | AUC(95% CI) | P值 | 敏感度(95% CI)/% | 特异度(95% CI)/% | 准确率(95% CI)/% | 诊断阈值 |
|---|---|---|---|---|---|---|
| ADC | 0.819(0.693~0.909) | <0.001 | 87.1(0.702~0.964) | 76.0(0.549~0.906) | 82.1(0.383~0.802) | 1.24 |
| MK | 0.914(0.808~0.972) | <0.001 | 90.3(0.742~0.980) | 84.0(0.639~0.955) | 87.5(0.536~0.856) | 0.73 |
| MD | 0.895(0.784~0.961) | <0.001 | 74.2(0.554~0.881) | 92.0(0.740~0.990) | 82.1(0.426~0.788) | 1.26 |
| MTRasym | 0.752(0.619~0.858) | <0.001 | 90.3(0.742~0.980) | 56.0(0.349~0.756) | 75.0(0.223~0.637) | 6.40 |
| DCE | 0.744(0.610~0.851) | <0.001 | 96.8(0.833~0.999) | 52.0(0.313~0.722) | 76.8(0.265~0.680) | — |
| DCE+ADC | 0.886(0.773~0.955) | <0.001 | 87.1(0.702~0.964) | 84.0(0.639~0.955) | 85.7(0.481~0.848) | — |
| DCE+ADC+DKI+APT | 0.985(0.908~1.000) | <0.001 | 96.8(0.833~0.999) | 96.0(0.796~0.999) | 96.4(0.791~0.968) | — |
注:ADC为表观扩散系数;MK为平均扩散峰度;MD为平均扩散率;MTRasym为非对称磁化转移率;DCE为动态对比增强;DCE+ADC为动态增强联合扩散加权成像(DWI)诊断模型;DCE+ADC+DKI+APT为多参数联合诊断模型;DKI为扩散峰度成像;APT为酰胺质子转移。

瘤周参数对乳腺癌病理因素的分析结果显示:HER-2阳性组的MKp/t值低于阴性组;Ki-67高表达组的MKp/t值低于低表达组,MDp/t值高于低表达组;LVI阳性组的MKp/n值高于阴性组,MDp/n值低于阴性组;组织学分级Ⅲ级组的MKp/n值高于Ⅱ级组(P均<0.05);ER、PR、淋巴结转移组间瘤周DKI各参数的差异无统计学意义,各病理因素组间瘤周APT参数的差异无统计学意义(P均>0.05)。详见表5。

乳腺癌病理因素组间DKI、APT参数比较
Comparison of DKI and APT parameters among groups of pathological factors of breast cancer
乳腺癌病理因素组间DKI、APT参数比较
Comparison of DKI and APT parameters among groups of pathological factors of breast cancer
| 参数 | DKI参数 | APT参数 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| MKp/t | P值 | MKp/n | P值 | MDp/t | P值 | MDp/n | P值 | MTRasymp/t | P值 | MTRasymp/n | P值 | ||
| ER | 0.568 | 0.873 | 0.548 | 0.567 | 0.522 | 0.447 | |||||||
| 阳性组(n=18) | 0.72±0.13 | 1.10(1.03,1.24) | 1.56(1.45,1.65) | 0.93(0.86,0.97) | 0.82(0.72,1.17) | 0.98(0.82,1.15) | |||||||
| 阴性组(n=13) | 0.75±0.07 | 1.11(1.01,1.26) | 1.54(1.34,1.61) | 0.96(0.80,1.02) | 0.89(0.74,1.18) | 1.01(0.90,1.22) | |||||||
| PR | 0.690 | 0.779 | 0.471 | 0.150 | 0.280 | 0.660 | |||||||
| 阳性组(n=14) | 0.74±0.12 | 1.11(1.02,1.27) | 1.53(1.34,1.63) | 0.92(0.84,0.97) | 0.82(0.65,1.16) | 1.01(0.83,1.08) | |||||||
| 阴性组(n=17) | 0.73±0.11 | 1.10(1.04,1.25) | 1.57(1.46,1.65) | 0.95(0.90,1.05) | 0.89(0.78,1.21) | 0.99(0.88,1.21) | |||||||
| HER-2 | 0.045 | 0.459 | 0.542 | 0.695 | 0.107 | 0.486 | |||||||
| 阳性组(n=12) | 0.66±0.11 | 1.11(1.05,1.30) | 1.57(1.45,1.65) | 0.93(0.89,0.99) | 1.14±0.43 | 1.07(0.90,1.25) | |||||||
| 阴性组(n=19) | 0.76±0.12 | 1.08(1.03,1.25) | 1.52(1.36,1.64) | 0.92(0.85,1.00) | 0.84±0.22 | 0.99(0.66,1.05) | |||||||
| Ki-67 | 0.020 | 0.542 | 0.024 | 0.761 | 0.197 | 0.433 | |||||||
| 高表达(n=22) | 0.66±0.11 | 1.08(1.03,1.23) | 1.60(1.49,1.70) | 0.95(0.81,1.00) | 0.90±0.24 | 1.21(0.88,1.15) | |||||||
| 低表达(n=9) | 0.78±0.13 | 1.11(1.01,1.29) | 1.42(1.37,1.52) | 0.92(0.87,0.98) | 1.06±0.44 | 0.91(0.83,1.15) | |||||||
| LVI | 0.431 | 0.040 | 0.485 | 0.036 | 0.707 | 0.420 | |||||||
| 阳性组(n=5) | 0.65±0.16 | 1.27±0.14 | 1.44(1.37,1.63) | 0.82(0.61,0.91) | 0.83(0.62,1.20) | 0.89(0.82,1.13) | |||||||
| 阴性组(n=26) | 0.70±0.12 | 1.11±0.16 | 1.56(1.37,1.65) | 0.95(0.87,1.00) | 0.87(0.76,1.18) | 1.05(0.87,1.16) | |||||||
| 淋巴结转移 | 0.373 | 0.231 | 0.386 | 0.201 | 0.302 | 0.680 | |||||||
| 阳性组(n=11) | 0.70±0.15 | 1.13(1.05,1.37) | 1.60(1.42,1.66) | 0.91(0.82,0.96) | 0.83(0.67,1.04) | 0.98(0.88,1.13) | |||||||
| 阴性组(n=20) | 0.74±0.12 | 1.09(1.03,1.19) | 1.50(1.37,1.62) | 0.95(0.86,1.02) | 0.88(0.77,1.26) | 1.04(0.86,1.21) | |||||||
| 组织学分级 | 0.113 | 0.030 | 0.118 | 0.190 | 0.526 | 0.331 | |||||||
| Ⅱ级(n=21) | 0.72±0.14 | 1.10±0.14 | 1.61(1.49,1.67) | 0.99(0.84,0.96) | 0.87(0.63,1.20) | 1.02(0.91,1.19) | |||||||
| Ⅲ级(n=10) | 0.64±0.09 | 1.23±0.18 | 1.51(1.37,1.61) | 0.92(0.83,1.04) | 0.86(0.77,1.17) | 1.00(0.83,1.16) | |||||||
注:符合正态分布的计量资料以均数±标准差(±s)表示,不符合正态分布的计量资料以中位数(上下四分位数)表示。DKI为扩散峰度成像;APT为酰胺质子转移;MKp/t为平均扩散峰度瘤周与瘤体的比值;MKp/n为平均扩散峰度瘤周与对侧腺体的比值;MDp/t为平均扩散率瘤周与瘤体的比值;MDp/n为平均扩散率瘤周与对侧腺体的比值;MTRasymp/t为非对称磁化转移率瘤周与瘤体的比值;MTRasymp/n为非对称磁化转移率瘤周与对侧腺体比值;ER为雌激素受体;PR为孕激素受体;HER-2为人表皮生长因子受体2;LVI为淋巴血管侵犯。
瘤周各参数与病理因素相关性分析结果显示:MKp/t与HER-2状态呈弱负相关(r=-0.365),AUC为0.73;MKp/t与Ki-67表达呈中度负相关(r=-0.404),MDp/t与Ki-67表达呈中度正相关(r=0.420),AUC分别为0.76、0.77;MKp/n与LVI呈弱正相关(r=0.382),MDp/n与LVI呈弱负相关(r=-0.373),AUC分别为0.77、0.79;MKp/n与组织学分级呈弱正相关(r=0.376),AUC为0.72;瘤周参数与其余病理因素之间未发现相关性(P均>0.05)。详见表6、7。
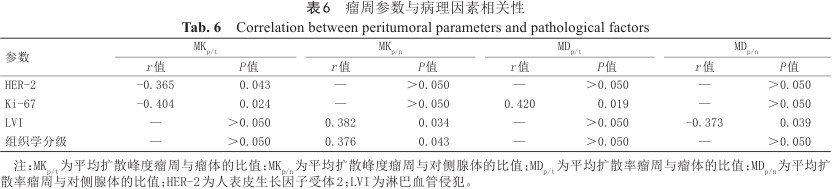
瘤周参数与病理因素相关性
Correlation between peritumoral parameters and pathological factors
瘤周参数与病理因素相关性
Correlation between peritumoral parameters and pathological factors
| 参数 | MKp/t | MKp/n | MDp/t | MDp/n | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| r值 | P值 | r值 | P值 | r值 | P值 | r值 | P值 | ||||
| HER-2 | -0.365 | 0.043 | — | >0.050 | — | >0.050 | — | >0.050 | |||
| Ki-67 | -0.404 | 0.024 | — | >0.050 | 0.420 | 0.019 | — | >0.050 | |||
| LVI | — | >0.050 | 0.382 | 0.034 | — | >0.050 | -0.373 | 0.039 | |||
| 组织学分级 | — | >0.050 | 0.376 | 0.043 | — | >0.050 | — | >0.050 | |||
注:MKp/t为平均扩散峰度瘤周与瘤体的比值;MKp/n为平均扩散峰度瘤周与对侧腺体的比值;MDp/t为平均扩散率瘤周与瘤体的比值;MDp/n为平均扩散率瘤周与对侧腺体的比值;HER-2为人表皮生长因子受体2;LVI为淋巴血管侵犯。
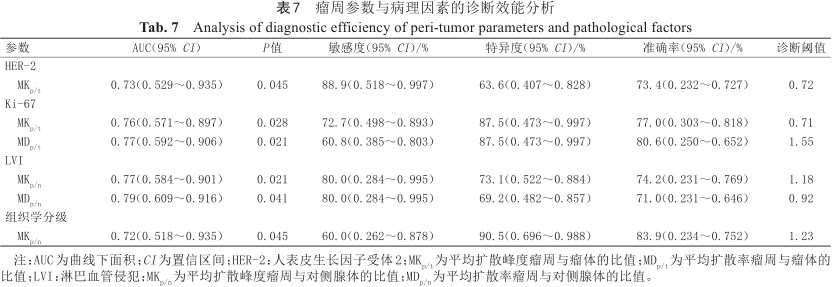
瘤周参数与病理因素的诊断效能分析
Analysis of diagnostic efficiency of peri-tumor parameters and pathological factors
瘤周参数与病理因素的诊断效能分析
Analysis of diagnostic efficiency of peri-tumor parameters and pathological factors
| 参数 | AUC(95% CI) | P值 | 敏感度(95% CI)/% | 特异度(95% CI)/% | 准确率(95% CI)/% | 诊断阈值 |
|---|---|---|---|---|---|---|
| HER-2 | ||||||
| MKp/t | 0.73(0.529~0.935) | 0.045 | 88.9(0.518~0.997) | 63.6(0.407~0.828) | 73.4(0.232~0.727) | 0.72 |
| Ki-67 | ||||||
| MKp/t | 0.76(0.571~0.897) | 0.028 | 72.7(0.498~0.893) | 87.5(0.473~0.997) | 77.0(0.303~0.818) | 0.71 |
| MDp/t | 0.77(0.592~0.906) | 0.021 | 60.8(0.385~0.803) | 87.5(0.473~0.997) | 80.6(0.250~0.652) | 1.55 |
| LVI | ||||||
| MKp/n | 0.77(0.584~0.901) | 0.021 | 80.0(0.284~0.995) | 73.1(0.522~0.884) | 74.2(0.231~0.769) | 1.18 |
| MDp/n | 0.79(0.609~0.916) | 0.041 | 80.0(0.284~0.995) | 69.2(0.482~0.857) | 71.0(0.231~0.646) | 0.92 |
| 组织学分级 | ||||||
| MKp/n | 0.72(0.518~0.935) | 0.045 | 60.0(0.262~0.878) | 90.5(0.696~0.988) | 83.9(0.234~0.752) | 1.23 |
注:AUC为曲线下面积;CI为置信区间;HER-2:人表皮生长因子受体2;MKp/t为平均扩散峰度瘤周与瘤体的比值;MDp/t为平均扩散率瘤周与瘤体的比值;LVI:淋巴血管侵犯;MKp/n为平均扩散峰度瘤周与对侧腺体的比值;MDp/n为平均扩散率瘤周与对侧腺体的比值。
本研究探讨了DKI、APT两种MRI技术对于乳腺良恶性病变的鉴别诊断效能,并联合常规DCE-MRI及ADC值建立了多参数联合诊断模型。结果显示DKI和APT参数均可用于鉴别乳腺良恶性病变,恶性病变的ADC、MD和MTRasym值显著低于良性病变,MK值显著高于良性病变,且多参数联合模型的诊断效能明显优于任何单一参数以及临床常规DCE+ADC模型,说明DKI和APT有潜力作为无创、可靠的影像学指标用于乳腺疾病的诊断。此外,本研究创新性地提出将DKI和APT用于乳腺癌瘤周区域进行研究,用于发现乳腺癌对于瘤周区域的影响。结果显示DKI参数与乳腺癌的部分病理因素间具有相关性,提示不同病理因素的乳腺癌对于瘤周区域的影响程度不同,这将为临床术前评估肿瘤的侵袭性以及制订治疗方案提供一定的参考和帮助。
DKI是DWI的一种进阶模型,与传统DWI相比DKI能更真实地反映生物组织内水分子非高斯分布的特性,其中,MK和MD是其主要参数,MK是表观峰度系数在若干个扩散敏感梯度场方向上的平均值[26],MD与ADC值类似,可用于反映组织中水分子扩散状况。但MD所反映的并非为理想状态下水分子扩散的速率,而是水分子在各个方向发生非高斯运动。MK值与组织结构复杂程度有关,结构越复杂,水分子扩散运动越偏离高斯分布,MK值也就越大。MD值主要与细胞密集程度有关,细胞越密集,细胞间隙越小,水分子扩散运动受阻程度越显著,MD值越小[27]。本研究发现,恶性病变的MK值较高,MD值较低,这与既往研究的结果一致[28, 29, 30],表明与良性病变相比,恶性病变中水分子的扩散更受限制。由于大多数恶性病变分化程度低,细胞增殖率及组织结构复杂程度更高,导致了细胞外间隙减小,使得水分子扩散受限。相比之下,良性病变内部细胞排列松散,水分子扩散更容易。
APT是基于内源性游离蛋白的氨基质子和水的氢质子之间存在的化学交换,通过施加射频脉冲,使氨基质子浓度改变转化为可以被识别的水信号变化,从而量化生物组织内游离蛋白质和多肽含量,其参数为MTRasym。本研究中恶性组的MTRasym值低于良性组,这一发现与MENG等[31]、王如华等[32]的研究结果相一致,但既往研究中对于良恶性病变MTRasym值的结果并不统一[33, 34, 35],这种差异可能是研究对象的不同所造成的。ZHANG等[36]的研究结果显示乳腺恶性病变的MTRasym值高于良性病变,可能由于其研究中良性病变只纳入了纤维腺瘤,而纤维腺瘤中上皮及纤维结缔组织成分较多[37],分泌能力下降明显。本研究中良性病变包含较多的腺病及其他良性病变。正常情况下,乳腺有很强的分泌能力,分泌物质富含蛋白质/多肽。由于腺病及导管扩张症等良性病变与正常乳腺组织的结构差异较小,因此分泌能力所受影响较小,局部微环境中的蛋白质和多肽含量可以维持在一个较高的水平。与良性病变相比,恶性病变的结构与正常组织结构明显不同,其分泌能力受到明显影响,虽然恶性病变组织坏死会导致游离蛋白质/多肽含量增加,但增加量无法补偿降低的分泌量,导致恶性组的MTRasym值低于良性组。此外,影响APT信号的因素有很多,比如温度、pH值、核奥氏效应(nuclear overhauser effect, NOE)等,有研究表明肿瘤APT信号值约34%受到pH值的影响[38]。目前,临床定量APT成像一般采用非对称性分析法,而脂质等化合物中的氢核普遍存在NOE,由此得到的对比度信息并非单纯的APT效应[39]。可能由于多种因素作用的结果,导致了APT对乳腺良恶性病变研究结果的不一致性。
ROC曲线分析结果显示MK、MD及MTRasym值对于鉴别良恶性病变的效能均较高,DCE+ADC+DKI+APT联合模型的AUC高于任一单一参数,并高于临床常用的DCE+DWI模型,这与其他的研究结果相似[12,36],说明多参数联合应用能更全面反映肿瘤细胞的代谢及生理信息,可以为临床诊断提供新思路。但本研究结果显示,DKI参数对于乳腺良恶性病变的鉴别诊断比APT参数更具优势,原因可能是:(1)良恶性组间水分子扩散的差异比蛋白质和多肽含量的差异更显著;(2)引起微环境中蛋白质和多肽含量变化的因素较复杂;(3)APT图像质量有待提高。
关于瘤周区域相关参数,本研究发现,MKp/n与组织学分级呈弱正相关,MKp/n与LVI呈弱正相关,MDp/n与LVI呈弱负相关,且组间参数的差异均有统计学意义。分析其原因,可能与肿瘤较高的侵袭性有关,组织学分级越高,肿瘤分化程度越低,生长越迅速,侵袭性也越高[40],也有研究证实了LVI的存在与肿瘤的侵袭性有关[41]。因此,此类高侵袭性的肿瘤对于瘤周组织的侵犯也更明显,促进瘤周间质纤维化及脉管的生成,导致组织结构的复杂程度增加[42, 43],同时,高侵袭性的肿瘤更容易促进肿瘤炎症微环境的形成,造成瘤周组织高压[44],这些因素的作用限制了水分子的扩散。但既往有研究[19, 45]发现LVI阳性的乳腺癌瘤周区域水分子扩散受限不显著,与本研究结果不一致,分析其原因:(1)本研究中LVI病例较少;(2)ROI勾画方法不同,本研究尽量在固定方向及腺体组织较丰富的区域勾画ROI,而既往研究则是选择ADC图上信号较高处勾画ROI。
本研究还发现MKp/t与HER-2状态呈弱负相关,两组间参数差异有统计学意义,这可能因为HER-2高表达的病灶细胞密度高有关[46],但对于瘤周组织的影响较小,使得MKp/t值降低。此外,MKp/t与Ki-67表达呈中度负相关,MDp/t与Ki-67表达呈中度正相关,两组间参数差异有统计学意义。既往研究显示Ki-67高表达的肿瘤MK值较高而MD值较低[47]。Ki-67高表达的病灶通常细胞密度更高,组织结构更复杂[48, 49],不利于水分子的扩散。此外,有研究证实Ki-67高表达的病灶更容易发生瘤周水肿[50],但本研究并未发现MKp/n和MDp/n值在Ki-67不同表达组中差异有统计学意义,可能由于本研究中病例数较少,瘤周水肿的发生率较低导致。
本研究并未发现APT瘤周参数与不同病理因素组间的差异有统计学意义,可能是由于肿瘤在侵犯瘤周组织时首先改变的是瘤周组织结构的复杂性、细胞密度及微血管的生成[51],而对于瘤周组织的分泌功能影响较小,此外,瘤周组织并未出现像恶性肿瘤一样的坏死,因此,游离蛋白质/多肽的含量变化不明显。
本研究主要存在以下局限性:(1)样本量较小,需要进一步扩大样本量进行研究验证;(2)乳腺组织成分复杂,而APT的分辨率和信噪比较差,易受气体、脂肪及运动伪影影响,可能会影响成像的质量;(3)APT为2D成像模式,无法对于肿瘤上、下层面瘤周区域进行研究。
综上所述,APT、DKI均可用于乳腺良恶性病变的鉴别诊断,相比于临床常规的DCE+DWI诊断模型,DCE、ADC、DKI、APT多参数联合使用可显著提高诊断效能,说明了APT、DKI新型成像技术应用于临床的可行性。此外,部分瘤周区域相关参数与乳腺癌的病理因素存在一定的相关性,提示不同病理因素的乳腺癌对瘤周区域影响程度不同。因此,APT及DKI的应用可为乳腺癌的诊断、评估肿瘤的侵袭性以及制订治疗方案提供更多帮助。
周仕豪, 王雪佳, 程思佳, 等. 瘤体及瘤周多参数MRI对于乳腺癌及病理因素的诊断价值研究[J]. 磁共振成像, 2023, 14(3): 72-80.
ZHOU S H, WANG X J, CHENG S J, et al. Study on the correlation between multi-parameter MRI and pathology in the tumor body and peritumoral area of breast cancer[J]. Chin J Magn Reson Imaging, 2023, 14(3): 72-80.
Medical Science and Technological Project of Henan Province (No. 2018020367); Medical Research Development Fund Project of Beijing Kangmeng Charity Foundation (No. B21145AN).
全体作者均声明无利益冲突。



























