
探讨扩散张量成像(diffusion tensor imaging, DTI)和动脉自旋标记(arterial spin labelling, ASL)联合成像在定量评价不同Fazekas评分脑白质高信号(white matter hyperintensities, WMHs)患者的脑白质隐匿性损伤中的应用价值。
对80例WMHs患者和30例健康志愿者行常规MRI、DTI及ASL成像,比较不同Fazekas评分WMHs患者的额叶皮层下、颞叶皮层下、侧脑室前角及三角区、放射冠区及半卵圆中心正常脑白质(normal appearing white matter, NAWM)的成像参数差异。WMHs患者按照Fazekas评分分为三组:A组(0分)、B组(1~3分)和C组(4~6分)。
C组较A、B两组双侧侧脑室前角、三角区及放射冠区周围的表观扩散系数(apparent diffusion coefficient, ADC)升高,双侧侧脑室前角及右侧侧脑室三角区周围的各向异性分数(fractional anisotropy, FA)降低,双侧侧脑室三角区及放射冠区周围脑血流量(cerebral blood flow, CBF)降低(P<0.05)。左侧额叶皮层下、右侧放射冠区、右侧半卵圆中心及双侧侧脑室前角、三角区周围NAWM ADC与CBF呈负相关(r=-0.326,-0.21,-0.282,-0.443,-0.429,-0.357,-0.383)。双侧侧脑室前角周围白质FA与CBF呈正相关(r=0.477,0.268)。
WMHs评分上升至4~6分时,DTI联合ASL成像可以敏感地反映正常脑白质区域的隐匿性损伤,最敏感区域位于脑室周围的白质区域。

本刊刊出的所有论文不代表本刊编委会的观点,除非特别声明
脑白质高信号(white matter hyperintensities, WMHs)又称“脑白质疏松”,作为脑小血管病的影像标志物之一,在中老年人群中非常常见,65岁以上人群的患病率达60%~80%,其中深部白质高信号(deep white matter hyperintensity, DWMH)占87%,室周白质高信号(periventricular white matter hyperintensity, PWMH)占68%[1, 2, 3],WMHs形成的病理生理学基础为微血管破裂、血脑屏障破坏和内皮功能紊乱、白质小梗死、胶质细胞激活、少突胶质细胞丢失、慢性弥漫性低灌注或脑血流量(cerebral blood flow, CBF)减少等引起的脱髓鞘或轴突损伤,其中PWMH主要由淋巴通路功能障碍引起的静脉损伤所致,而DWMH则受缺血低灌注和淋巴通路功能障碍的共同影响[4, 5, 6]。WMHs可以诱发中风、抑郁、进展性认知障碍及痴呆[7, 8],WMHs通过断开连接大脑皮层的白质纤维影响认知,不同位置的WMHs影响认知的不同方面,PWMH导致信息处理速度下降和认知障碍,DWMH导致视觉空间功能变差[9, 10]。量化评估脑白质的微循环灌注异常或微结构损伤情况可敏感地监测脑白质早期的隐匿性损伤,可以用于患者的早期个体化治疗方案设计,以提高患者的预后。
WMHs患者外观正常脑白质(normal appearing white matter, NAWM)有可能出现早期隐匿性损伤,病变进一步发展则会导致认知功能下降或认知功能障碍,甚至会出现痴呆,早期检出白质隐匿性损伤对尽早采取临床干预以控制病情发展以及逆转病情至关重要[11]。前期研究发现WMHs分级越高,患者出现认知障碍的风险越高[12, 13],但利用扩散张量成像(diffusion tensor imaging, DTI)和动脉自旋标记(arterial spin labelling, ASL)联合成像量化评价不同严重程度WMHs患者的正常脑白质区域隐匿性损伤尚未见报道。鉴于此,本研究拟纳入不同Fazekas评分的WMHs患者,利用DTI和ASL联合成像量化评价不同严重程度WMHs患者的NAWM微结构的异常变化,旨在早期检出WMHs患者NAWM的隐匿性损伤,为临床干预提供关键的理论依据。
纳入2020年5月至2021年12月期间在中国人民解放军空军特色医学中心就诊的无主观认知障碍WMHs患者82例和健康对照者30例。WMHs患者纳入标准:(1)年龄在40~80岁;(2)头颅MRI检查证实有WMHs [WMHs在T2WI和液体衰减反转恢复(fluid attenuated inversion recovery, FLAIR)序列呈高信号,T1WI呈等或低信号];(3)患者在检查前没有接受影响参数测量的相关治疗。排除标准:(1)脑部肿瘤、大面积脑出血或脑梗死患者;(2)酒精中毒、一氧化碳中毒、免疫系统疾病等其他非血管性疾病引起的WMHs;(3)运动伪影比较严重,导致图像模糊,无法满足图像分析要求。排除2例运动伪影较重者,最终共纳入无主观认知障碍WMHs患者80例。所有被检者均被告知注意事项及签署书面知情同意书。本研究为前瞻性病例对照性研究,遵守《赫尔辛基宣言》,经空军特色医学中心医学伦理委员会批准(批准文号:KT202003-45)。
MRI检查采用Discovery MR750 3.0 T超导型MRI系统和颅脑8通道相控阵表面线圈,所有病例接受常规MRI、ASL和DTI序列扫描。T1WI序列扫描参数:TR 2041.7 ms,TE 24 ms,层厚5 mm,层间距1 mm,FOV 24 cm×24 cm,矩阵352×192;T2WI序列扫描参数:TR 6000 ms,TE 90 ms,层厚5 mm,层间距1.5 mm,FOV 24 cm×24 cm;FLAIR序列扫描参数:TR 8600 ms,TE 155 ms,TI 2100 ms,层厚5 mm,层间距1.5 mm,FOV 24 cm×24 cm,矩阵256×224;ASL序列扫描参数:TR 4844 ms,TE 10.5 ms,层厚4 mm,标记后延迟时间2025 ms,采集次数2次;DTI序列扫描参数:TR 6000 ms,TE 61 ms,FOV 25.6 cm×25.6 cm,矩阵128×128,层厚3 mm,层间距0,使用64个采集方向,b=0、1000 s/mm2,采集次数1次。
将常规MRI、DTI及ASL成像的原始图像传输至GE AW 4.5工作站,使用Functool软件进行后处理,由两名年资相近的影像专业医师(均有8年以上的脑部MRI诊断经验),在后处理图像前经过统一培训,进行双盲法分析,以电子阅片方式读片以评价不同观察者间的一致性,如果两名观察者的分析结果存在不一致,由第三名专业医师参与讨论,将讨论达成的一致意见作为最终结果进行分析。
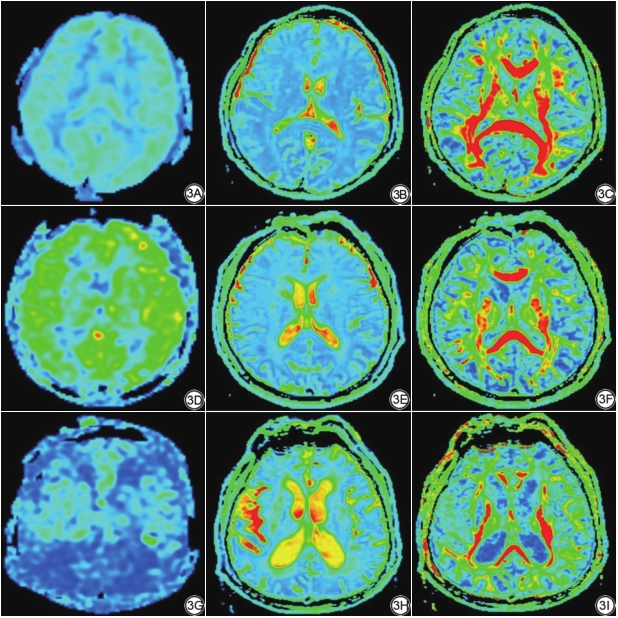
分析流程如下:首先对常规MRI图像(主要根据T2WI和FLAIR图像)采用Fazekas量表[14]进行WMHs视觉评分,根据评分标准分为A组(0分)30例、B组(1~3分)50例与C组(4~6分)30例(图1)。然后,依据T2WI和FLAIR图像选择感兴趣区(region of interest, ROI),测量选择区域包括:双侧额叶及颞叶皮层下、侧脑室前后角、放射冠区、半卵圆中心等部位的NAWM,ROI大小约20~40 mm2(图2),测量时将ASL与DTI图像进行融合,从而确保ROI在CBF图、各向异性分数(fractional anisotropy, FA)图和表观扩散系数(apparent diffusion coefficient, ADC)图的相同位置。
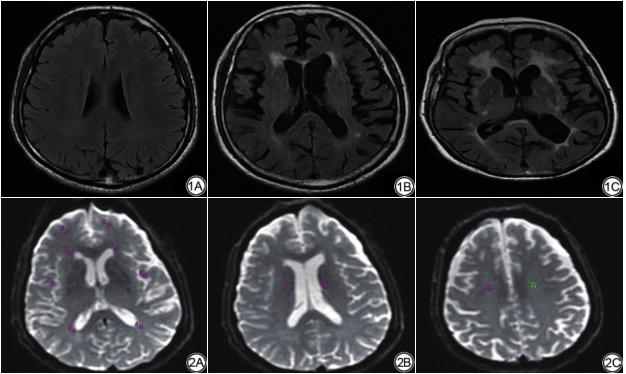

评价指标:(1)CBF反映大脑葡萄糖利用、耗氧、有氧糖酵解等功能代谢情况[15];(2)FA反映神经纤维的直径、密度、排列的一致性和髓鞘的完整性;(3)ADC反映水分子的扩散速度与范围(图3)。

采用统计学软件SPSS 22.0进行统计学分析。使用Bland-Altman方法检验两名观察者对DTI、ASL成像参数测量的一致性。计数资料使用χ2检验分析。计量资料采用Kolmogorov-Smirnov检验、方差齐性检验确定数据资料的分布情况,如果资料服从正态分布且方差齐,采用单因素方差分析并行两两比较;如果资料呈偏态分布或方差不齐,采用非参数秩和检验比较,多组间进行两两比较采用Bonferroni法进行校正处理;ASL参数和DTI参数之间的相关性符合双变量正态分布采用Pearson分析,否则采用Spearman秩相关进行分析,P<0.05认为差异具有统计学意义。
对影响WMHs的Fazekas评分的临床危险因素进行分析(表1),发现不同组的年龄、血压及血糖情况差异有统计学意义(P=0.001,0.001,0.046),心血管病事件、吸烟史、性别及血脂情况差异无统计学意义(P均>0.05)。
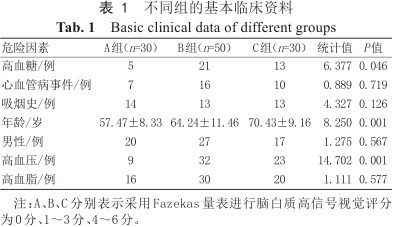
不同组的基本临床资料
Basic clinical data of different groups
不同组的基本临床资料
Basic clinical data of different groups
| 危险因素 | A组(n=30) | B组(n=50) | C组(n=30) | 统计值 | P值 |
|---|---|---|---|---|---|
| 高血糖/例 | 5 | 21 | 13 | 6.377 | 0.046 |
| 心血管病事件/例 | 7 | 16 | 10 | 0.889 | 0.719 |
| 吸烟史/例 | 14 | 13 | 13 | 4.327 | 0.126 |
| 年龄/岁 | 57.47±8.33 | 64.24±11.46 | 70.43±9.16 | 8.250 | 0.001 |
| 男性/例 | 20 | 27 | 17 | 1.275 | 0.567 |
| 高血压/例 | 9 | 32 | 23 | 14.702 | 0.001 |
| 高血脂/例 | 16 | 30 | 20 | 1.111 | 0.577 |
注:A、B、C分别表示采用Fazekas量表进行脑白质高信号视觉评分为0分、1~3分、4~6分。
两名观察者测量的ADC、CBF、FA值具有较好的一致性,组内相关系数(intra-class correlation coefficient, ICC)分别为0.9088、0.9137和0.9048,提示ADC、CBF和FA值的测量可重复性较高。
A、B、C三组不同部位的ADC值、FA值与CBF值见表2, 3, 4。C组与A、B两组相比,双侧侧脑室前角、三角区及放射冠区周围NAWM的ADC值升高(P均<0.05),双侧侧脑室前角及右侧侧脑室三角区周围NAWM的FA值降低(P均≤0.01),双侧侧脑室三角区及放射冠区周围NAWM的CBF值降低(P均<0.05),以上检验进一步两两比较,A、B组之间无显著差异。B、C两组较A组右侧半卵圆中心的ADC值升高(P=0.006),进一步两两比较,B、C组之间无显著差异。
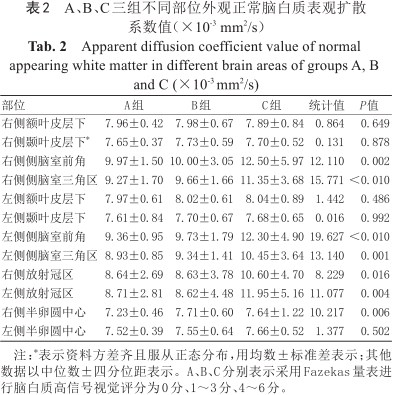
A、B、C三组不同部位外观正常脑白质表观扩散系数值(×10-3 mm2/s)
Apparent diffusion coefficient value of normal appearing white matter in different brain areas of groups A, B and C (×10-3 mm2/s)
A、B、C三组不同部位外观正常脑白质表观扩散系数值(×10-3 mm2/s)
Apparent diffusion coefficient value of normal appearing white matter in different brain areas of groups A, B and C (×10-3 mm2/s)
| 部位 | A组 | B组 | C组 | 统计值 | P值 |
|---|---|---|---|---|---|
| 右侧额叶皮层下 | 7.96±0.42 | 7.98±0.67 | 7.89±0.84 | 0.864 | 0.649 |
| 右侧颞叶皮层下* | 7.65±0.37 | 7.73±0.59 | 7.70±0.52 | 0.131 | 0.878 |
| 右侧侧脑室前角 | 9.97±1.50 | 10.00±3.05 | 12.50±5.97 | 12.110 | 0.002 |
| 右侧侧脑室三角区 | 9.27±1.70 | 9.66±1.66 | 11.35±3.68 | 15.771 | <0.010 |
| 左侧额叶皮层下 | 7.97±0.61 | 8.02±0.61 | 8.04±0.89 | 1.442 | 0.486 |
| 左侧颞叶皮层下 | 7.61±0.84 | 7.70±0.67 | 7.68±0.65 | 0.016 | 0.992 |
| 左侧侧脑室前角 | 9.36±0.95 | 9.73±1.79 | 12.30±4.90 | 19.627 | <0.010 |
| 左侧侧脑室三角区 | 8.93±0.85 | 9.34±1.41 | 10.45±3.64 | 13.140 | 0.001 |
| 右侧放射冠区 | 8.64±2.69 | 8.63±3.78 | 10.60±4.70 | 8.229 | 0.016 |
| 左侧放射冠区 | 8.71±2.81 | 8.62±4.48 | 11.95±5.16 | 11.077 | 0.004 |
| 右侧半卵圆中心 | 7.23±0.46 | 7.71±0.60 | 7.64±1.22 | 10.217 | 0.006 |
| 左侧半卵圆中心 | 7.52±0.39 | 7.55±0.64 | 7.66±0.52 | 1.377 | 0.502 |
注:*表示资料方差齐且服从正态分布,用均数±标准差表示;其他数据以中位数±四分位距表示。A、B、C分别表示采用Fazekas量表进行脑白质高信号视觉评分为0分、1~3分、4~6分。
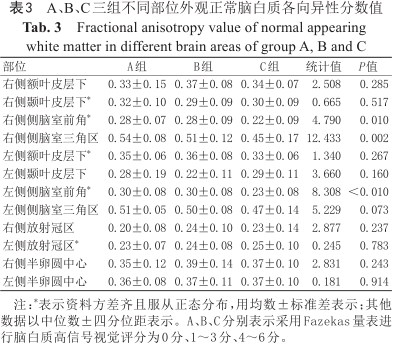
A、B、C三组不同部位外观正常脑白质各向异性分数值
Fractional anisotropy value of normal appearing white matter in different brain areas of group A, B and C
A、B、C三组不同部位外观正常脑白质各向异性分数值
Fractional anisotropy value of normal appearing white matter in different brain areas of group A, B and C
| 部位 | A组 | B组 | C组 | 统计值 | P值 |
|---|---|---|---|---|---|
| 右侧额叶皮层下 | 0.33±0.15 | 0.37±0.08 | 0.34±0.07 | 2.508 | 0.285 |
| 右侧颞叶皮层下* | 0.32±0.10 | 0.29±0.09 | 0.30±0.09 | 0.665 | 0.517 |
| 右侧侧脑室前角* | 0.28±0.07 | 0.28±0.09 | 0.22±0.09 | 4.790 | 0.010 |
| 右侧侧脑室三角区 | 0.54±0.08 | 0.51±0.12 | 0.45±0.17 | 12.433 | 0.002 |
| 左侧额叶皮层下* | 0.35±0.06 | 0.36±0.08 | 0.33±0.06 | 1.340 | 0.267 |
| 左侧颞叶皮层下 | 0.28±0.19 | 0.22±0.11 | 0.29±0.11 | 3.660 | 0.160 |
| 左侧侧脑室前角* | 0.30±0.08 | 0.30±0.08 | 0.23±0.08 | 8.308 | <0.010 |
| 左侧侧脑室三角区 | 0.51±0.05 | 0.50±0.08 | 0.47±0.14 | 5.229 | 0.073 |
| 右侧放射冠区 | 0.20±0.08 | 0.24±0.10 | 0.23±0.14 | 2.877 | 0.237 |
| 左侧放射冠区* | 0.23±0.07 | 0.24±0.08 | 0.25±0.10 | 0.245 | 0.783 |
| 右侧半卵圆中心 | 0.35±0.12 | 0.39±0.14 | 0.37±0.10 | 2.831 | 0.243 |
| 左侧半卵圆中心 | 0.36±0.08 | 0.37±0.11 | 0.37±0.10 | 0.181 | 0.914 |
注:*表示资料方差齐且服从正态分布,用均数±标准差表示;其他数据以中位数±四分位距表示。A、B、C分别表示采用Fazekas量表进行脑白质高信号视觉评分为0分、1~3分、4~6分。
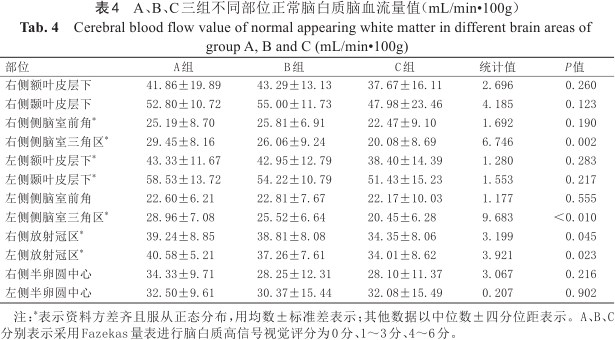
A、B、C三组不同部位正常脑白质脑血流量值(mL/min•100g)
Cerebral blood flow value of normal appearing white matter in different brain areas of group A, B and C (mL/min•100g)
A、B、C三组不同部位正常脑白质脑血流量值(mL/min•100g)
Cerebral blood flow value of normal appearing white matter in different brain areas of group A, B and C (mL/min•100g)
| 部位 | A组 | B组 | C组 | 统计值 | P值 |
|---|---|---|---|---|---|
| 右侧额叶皮层下 | 41.86±19.89 | 43.29±13.13 | 37.67±16.11 | 2.696 | 0.260 |
| 右侧颞叶皮层下 | 52.80±10.72 | 55.00±11.73 | 47.98±23.46 | 4.185 | 0.123 |
| 右侧侧脑室前角* | 25.19±8.70 | 25.81±6.91 | 22.47±9.10 | 1.692 | 0.190 |
| 右侧侧脑室三角区* | 29.45±8.16 | 26.06±9.24 | 20.08±8.69 | 6.746 | 0.002 |
| 左侧额叶皮层下* | 43.33±11.67 | 42.95±12.79 | 38.40±14.39 | 1.280 | 0.283 |
| 左侧颞叶皮层下* | 58.53±13.72 | 54.22±10.79 | 51.43±15.23 | 1.553 | 0.217 |
| 左侧侧脑室前角 | 22.60±6.21 | 22.81±7.67 | 22.17±10.03 | 1.177 | 0.555 |
| 左侧侧脑室三角区* | 28.96±7.08 | 25.52±6.64 | 20.45±6.28 | 9.683 | <0.010 |
| 右侧放射冠区* | 39.24±8.85 | 38.81±8.08 | 34.35±8.06 | 3.199 | 0.045 |
| 左侧放射冠区* | 40.58±5.21 | 37.26±7.61 | 34.01±8.62 | 3.921 | 0.023 |
| 右侧半卵圆中心 | 34.33±9.71 | 28.25±12.31 | 28.10±11.37 | 3.067 | 0.216 |
| 左侧半卵圆中心 | 32.50±9.61 | 30.37±15.44 | 32.08±15.49 | 0.207 | 0.902 |
注:*表示资料方差齐且服从正态分布,用均数±标准差表示;其他数据以中位数±四分位距表示。A、B、C分别表示采用Fazekas量表进行脑白质高信号视觉评分为0分、1~3分、4~6分。
相关性分析显示(图4),左侧额叶皮层下、右侧放射冠区、右侧半卵圆中心及双侧侧脑室前角、三角区周围正常脑白质区域的ADC值和CBF值呈负相关(r=-0.326,-0.21,-0.282,-0.443,-0.429,-0.357,-0.383),相关性最强的白质区域位于双侧侧脑室前角。双侧侧脑室前角周围NAWM区域的FA值与CBF值呈正相关(r=0.477,0.268),相关性最强的白质区域位于右侧侧脑室前角。
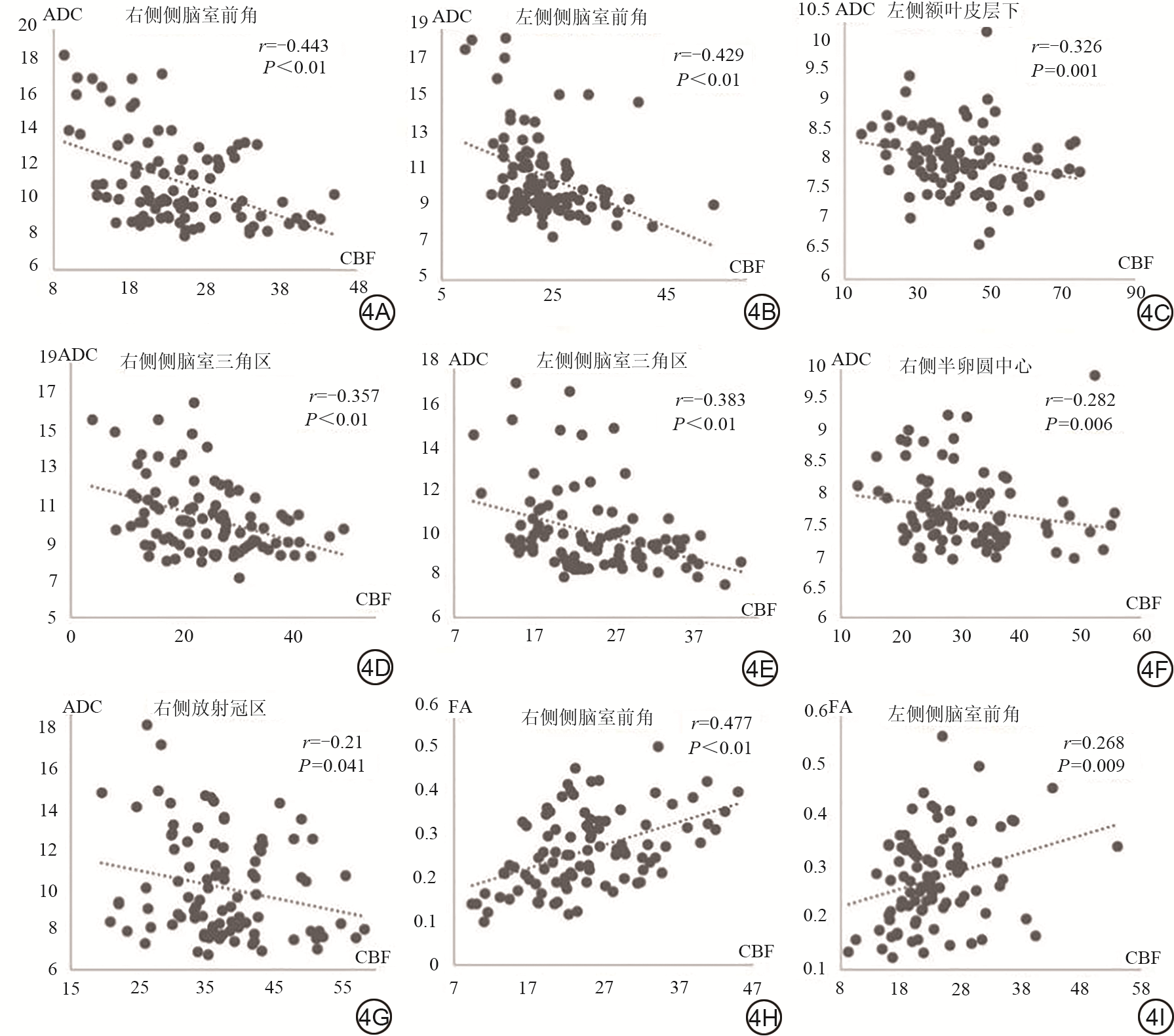

本研究利用DTI和ASL联合成像量化评价不同Fazekas评分WMHs患者皮层下及室周NAWM的功能成像参数变化。研究发现,Fazekas评分达4~6分时,室周NAWM的ADC、FA、CBF出现异常改变,另外,ADC较FA更早出现异常,敏感性更高。此研究结果可以用于确定不同Fazekas评分的WMHs患者的NAWM是否出现隐匿性损伤,目前国内很少有类似报道。本研究可以定量监测WMHs患者NAWM的微结构损伤情况,为血管源性认知障碍形成机制提供重要理论基础,对个体化治疗方案设计和疗效预测具有指导意义。
DTI是在体无创评价脑白质完整性的最常用的MR功能成像技术,较其他MRI技术,与WMHs临床转归的相关性更好,DTI量化评价指标主要包括FA与ADC值[16, 17]。轴突或神经元受到损伤时,FA值会降低;当自由水含量增加和细胞完整性破坏时,ADC值会升高[18, 19]。本研究发现,当WMHs的评分上升至4~6分时,双侧侧脑室前角及右侧侧脑室三角区NAWM微结构已经发生异常,出现隐匿性损伤,可能的原因为WMHs邻近白质区域出现灌注减低和纤维束完整性破坏[20, 21],左侧侧脑室三角区周围NAWM的FA值虽未表现出差异,但也呈现出下降的趋势,这可能是该区域正处于早期间质积液阶段,尚未出现影响FA值的脱髓鞘或轴突损伤等,也可能是纳入被检者左侧侧脑室三角区WMHs严重程度较右侧稍轻所致。与之前结果[22]不同,本研究发现不同Fazekas评分WMHs患者双侧放射冠及右侧半卵圆中心区域ADC值存在差异,FA值无显著差异,两项研究结果不一致的可能原因包括:(1)这些部位含有较高的髓磷脂,有助于维持轴突髓鞘形成,因此FA水平未表现出差异[23];(2)研究对象不一致,他们的研究纳入了全部脑小血管病患者,而本研究仅纳入WMHs患者;(3)本研究的关注点为不同严重程度WMHs患者正常脑白质区域的脑白质微结构变化,他们的研究主要分析病例组较健康对照组的变化。本研究主要关注脑白质微结构和血管灌注的异常变化,为早期诊断脑白质区域功能异常提供重要依据。
值得注意的是,不同成像参数对检出脑白质隐匿性损伤的敏感性存在一定的差异,本研究发现,ADC对于监测NAWM的功能异常变化可能比FA更敏感;另外,这些成像参数的诊断效能也会受脑白质区域的影响,双侧侧脑室周围NAWM较深部NAWM更易受到影响,这可能与距WMHs远近有关[21];再次,脑室周围白质仅由直径小于100 μm血管供应[24]。与之类似,国内外其他研究也支持本研究的结果,WMHs病变的部位与神经病理和临床有明显的联系[25],与DWMH相比,PWMH与认知功能较差有关,这是因为PWMH位于高密度白质束区域,这些白质束连接支持多种认知功能的广泛分布的皮层区域[26]。
ASL使用动脉血作为内源性对比剂,反映单位时间内通过一定体积脑组织血管内的CBF,可以无创地评价脑局部的CBF,甚至PWMH周围半影区低CBF可以预测WMHs的进展[27, 28]。脑白质微结构的损伤与脑局部血流灌注不足密切相关,当脑灌注量减低引起慢性缺血缺氧时,局部脑白质可能发生脱髓鞘改变,造成轴突不可逆损害,导致局部脑白质微结构的隐匿性损伤[6]。本研究发现WMHs患者随着Fazekas评分的增加,局部NAWM的CBF降低,之前研究也表明这些部位更容易出现新发病灶或WMHs病变范围的扩大[29]。脑白质区域CBF异常部分可逆[30, 31],如果在此时间窗内及时采取相关干预措施,可以改善CBF,在一定程度上挽救部分WMHs,缓解临床症状,逆转病情发展。因此,利用ASL成像技术早期检出WMHs的正常脑白质区的CBF异常对改善治疗效果具有重要临床意义。
但是,对于DTI或ASL成像,单个成像技术仅仅反映单个脑白质组织病理学特点,而脑白质区域出现功能异常往往与多个病理生理学特点有关,目前在临床实践中单个成像技术的诊断效能尚不足以作为一个敏感手段来准确量化监测脑白质隐匿性损伤。
隐匿性损伤是指依据常规MRI检查阴性,而通过功能成像技术发现局部脑白质已出现CBF异常或脑白质微结构的异常变化。本试验ASL和DTI序列所采用的层厚存在细微差别,经预实验分析,层厚细微差别并未对研究结果造成显著影响。本研究发现,DTI和ASL联合成像可以更敏感、更准确地量化检出白质隐匿性损伤,原因在于:(1)DTI和ASL可以从不同角度反映局部脑白质的异常变化,DTI可以反映局部神经纤维结构的完整性以及局部水分子扩散受限情况,ASL可以无创性反映局部CBF异常,二者联合可以更敏感地捕捉脑白质的整体功能异常信息,做到早期检出和量化评价;(2)本研究结果显示,两种功能成像参数具有一定相关性,DTI和ASL联合成像可以互相印证局部脑白质的损伤情况,并且可以充分反映两种成像参数的相互影响机制。此外,本研究发现ADC较FA与CBF的关联更为紧密,脑灌注量减少时,组织出现缺血性缺氧,继而出现细胞毒性水肿,早期的间质积液可能是可逆的,进展趋势通常是不可逆转的脱髓鞘和神经元损伤[32, 33]。
脑白质纤维断裂是WMHs负荷增加的基础,患者病史和相关临床特点也与WMHs的Fazekas评分具有一定相关性,老年、女性和高血压与WMHs的进展相关,其中高血压和年龄对WMHs的进展有一定影响,也会导致脑白质微结构的损伤加重[34]。
本研究尚存在一些局限性:(1)本研究的样本量相对较小,虽然能满足统计学分析的要求,这可能会使研究结果存在轻度偏倚;(2)对于脑白质微结构损伤金标准的依据,本研究使用与正常人群组的脑白质进行对照性分析,并结合双侧脑白质的自身对照来确定;(3)由于功能成像参数的测量值在脑内不同部位呈不均匀分布,本研究在侧脑室周围放置了多个ROI以保证可比性,但是手动放置ROI存在一定的主观性,可能对研究结果造成一定影响。
本研究显示,基于DTI和ASL联合成像,Fazekas评分上升至4~6分时,WMHs患者NAWM存在一定的隐匿性损伤,其中侧脑室周围NAWM最为敏感,这对尽早进行临床干预或个体化治疗具有指导意义。
常晓霞, 李相生, 蒋瑞静, 等. 基于DTI和ASL联合成像量化监测不同Fazekas评分的脑白质高信号患者正常脑白质区域的隐匿性损伤[J]. 磁共振成像, 2023, 14(4): 22-28.
CHANG X X, LI X S, JIANG R J, et al. Study on quantitative monitoring of occult injury in normal white matter regions of WMHs with different Fazekas based on DTI combined with ASL technique[J]. Chin J Magn Reson Imaging, 2023, 14(4): 22-28.
Major Problems in Aeromedicine Science and Technology Project (No. 2020ZTB07).
全体作者均声明无利益冲突。



























