
探讨动态对比增强MRI(dynamic contrast-enhanced MRI, DCE-MRI)图像特征联合定量参数对乳腺癌激素受体、人表皮生长因子受体2(human epidermal growth factor receptor-2, HER-2)及三阴性乳腺癌(triple-negative breast cancer, TNBC)的预测价值。
回顾性分析316例行乳腺MRI检查的乳腺癌患者的临床资料、DCE-MRI图像及定量参数,其中242例为训练组,74例为验证组。根据激素受体表达情况分为激素受体阳性组和阴性组;按照HER-2表达情况分为HER-2阳性组和HER-2阴性组;根据激素受体及HER-2表达状态分为TNBC和非三阴性乳腺癌组(non-triple-negative breast cancer, NTNBC)。比较训练组中不同类型乳腺癌MRI图像特征及定量参数的差异,运用logistic回归联合部分影像征象及定量参数预测激素受体阳性、HER-2阳性与TNBC,构建出相应的列线图,利用验证组进行验证,采用受试者工作特征(receiver operator characteristic, ROC)曲线、校正曲线、决策曲线分析(decision curve analysis, DCA)评估预测模型效能。
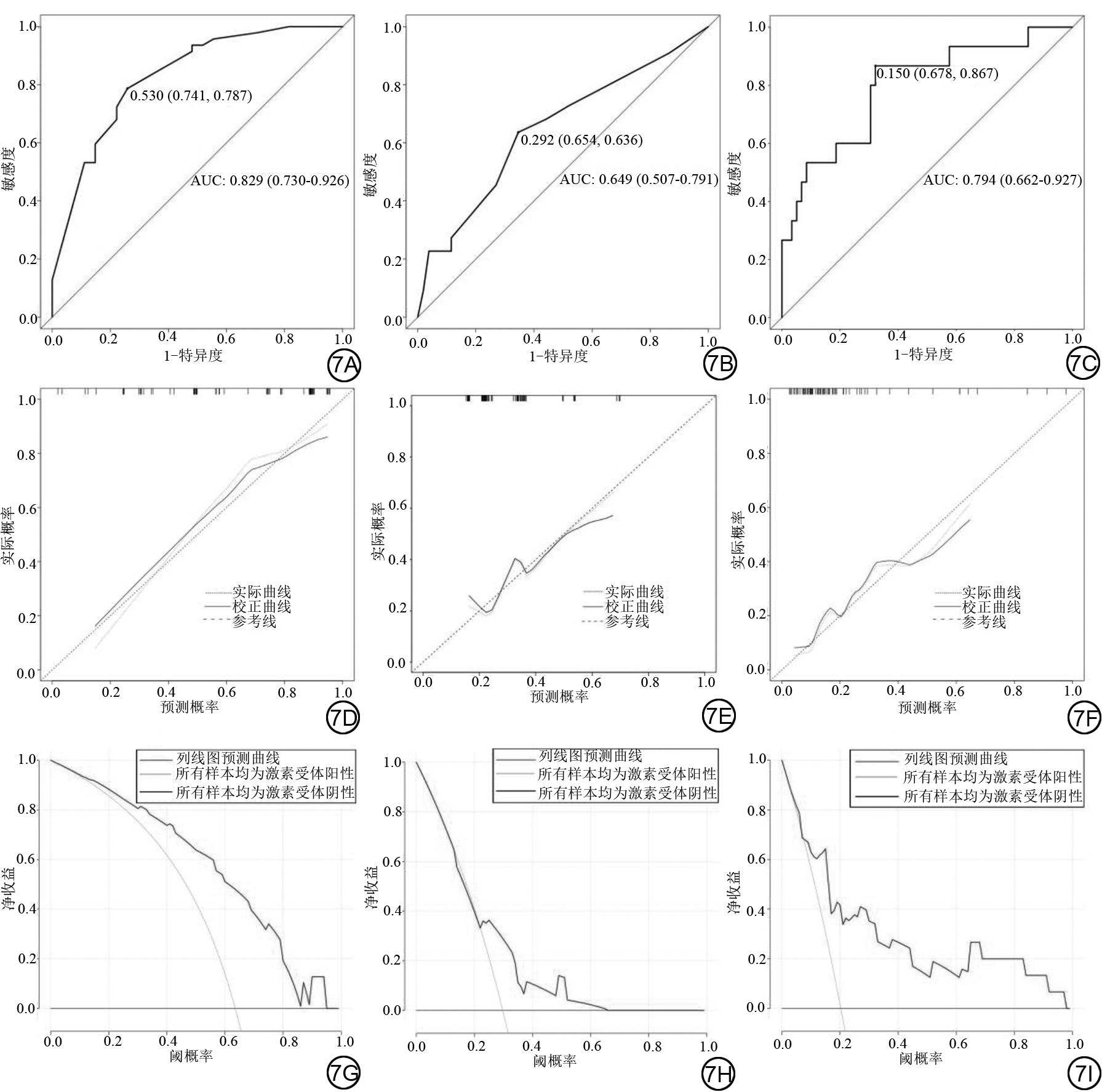
训练组中病灶大小、形状、毛刺、内部强化特征(internal enhancement characteristics, IEC)、非肿块样强化(non-mass enhancement, NME)、子灶、周围血管增多、腋窝淋巴结肿大、乳头改变等乳腺DCE-MRI图像特征在乳腺癌不同免疫组化结果及分子亚型组间存在显著差异(P均<0.05),定量参数中血管外细胞外间隙容积比(volume fraction of extravascular extra vascular space, Ve)则是激素受体阳性组大于阴性组(P<0.001),而TNBC的Ve小于NTNBC(P<0.001)。毛刺(P<0.001)、IEC(P=0.041)、NME(P=0.006)以及腋窝淋巴结肿大(P=0.029)可以鉴别激素受体阳性和阴性乳腺癌。训练组的曲线下面积(area under the curve, AUC)为0.746(95% CI:0.681~0.811),敏感度、特异度及准确度分别为82.8%、52.9%及72.3%。验证组的AUC为0.829(95% CI:0.730~0.926),敏感度、特异度及准确度分别为78.7%、74.1%及77.0%。肿块形状(P=0.050)、毛刺(P=0.016)、NME(P=0.013)及腋窝淋巴结肿大(P<0.001)与HER-2阳性乳腺癌显著相关,结合上述特征构建HER-2阳性乳腺癌预测模型的AUC为0.733(95% CI:0.665~0.800),敏感度、特异度及准确度分别为55.6%、82.0%及73.1%。验证组的AUC为0.649(95% CI:0.507~0.791),敏感度、特异度及准确度分别为63.6%、65.4%及64.9%。联合病灶大小(P=0.010)、乳头改变(P=0.016)及Ve(P=0.007)构建的TNBC预测模型,训练组的AUC为0.689(95% CI:0.600~0.779),敏感性、特异度及准确度分别为80.0%、52.5%及57.0%,验证组的预测模型AUC为0.794(95% CI:0.662~0.927),敏感度、特异度及准确度分别为86.7%、67.8%及71.6%。训练组及验证组中激素受体阳性、HER-2阳性及TNBC预测模型的校正曲线均表明模型的一致性较高。DCA曲线显示,在较大阈值范围内,使用该模型具有的净收益更高。
乳腺癌DCE-MRI的影像特征及定量参数与激素受体及HER-2表达状态相关,具备无创预测激素受体阳性、HER-2阳性及TNBC的潜力。

本刊刊出的所有论文不代表本刊编委会的观点,除非特别声明
乳腺癌已经成为世界上大多数国家和地区最常见的恶性肿瘤,占所有恶性肿瘤的24.5% [1]。不同类型乳腺癌的临床治疗方案、治疗反应和总体生存期差异较大。乳腺癌的治疗方案主要参考雌激素受体(estrogen receptor, ER)、孕激素受体(progesterone receptor, PR)、人表皮生长因子受体2(human epidermal growth factor receptor-2, HER-2)以及Ki-67的表达状态[2]。目前主要通过术前穿刺获得免疫组织化学结果,但病理学穿刺仅能获取少量组织的免疫组化结果,难以全面评估乳腺癌的异质性[3]。同时,乳腺肿瘤的异质性特点不仅存在于原发病灶,有研究发现乳腺癌发生转移后,转移病灶的受体表达也出现了变化,对精准治疗及患者预后产生较大影响[4, 5]。动态对比增强MRI(dynamic contrast-enhanced MRI, DCE-MRI)能够无创提供乳腺肿瘤多方面信息,包括与血管通透性和血管外容积相关的定性、定量及半定量参数。其中容积转移常数(volume transfer constant, Ktrans)与肿瘤灌注、血管通透性以及对比剂分布容积显著相关;速率常数(flux rate constant, Kep)能够反映灌注和血管通透性;而血管外细胞外间隙容积比(volume fraction of extravascular extra vascular space, Ve)则能反映细胞密度及细胞膜完整性[6]。由于DCE-MRI能获得病灶的整体信息,基于MRI特征建立的预测体系,具备更全面表现病灶特征的能力[3]。既往研究表明DCE-MRI不仅能鉴别乳腺病变的良恶性[7, 8, 9, 10, 11],还可评估病灶对新辅助化疗的反应[12, 13, 14, 15, 16, 17],尽管目前有部分研究聚焦于预测乳腺癌分子亚型[6,18, 19, 20, 21, 22, 23, 24],但关于MRI影像学特征与乳腺癌分子分型相关性的研究结果差异较大。本研究拟联合乳腺癌DCE-MRI图像特征及定量参数,构建预测激素受体阳性、HER-2阳性及三阴性乳腺癌(triple-negative breast cancer, TNBC)的列线图模型,评估该模型的预测能力,以期为临床制订乳腺癌患者个性化治疗方案提供参考。
本研究遵守《赫尔辛基宣言》,并且通过了重庆医科大学附属第一医院伦理委员会的批准(批准文号:2022-K312),免除受试者知情同意。回顾性分析2021年1~8月于重庆医科大学附属第一医院接受乳腺DCE-MRI检查并经病理确诊为乳腺癌的患者病例。纳入标准:(1)术前行3.0 T乳腺MRI检查(包括DCE-MRI序列);(2)术后病理确诊为乳腺癌。排除标准:(1)扫描前接受过放疗、化疗、穿刺活检或手术切除等乳腺癌相关治疗;(2)多中心乳腺癌;(3)仅表现为非肿块样强化病灶;(4)图像质量不合格,影响影像诊断及分析等;(5)临床资料不完整或未取得明确病理结果。共316例患者病例纳入本研究,患者均为女性;将2021年1~5月的242例划分为训练组,2021年6~8月的74例为验证组。
使用Siemens Skyra 3.0 T或GE Singa HDx 3.0 T超导磁共振仪及8通道乳腺专用相控阵表面线圈完成双侧乳腺扫描。受检者俯卧于检查床上,双乳自然下垂,并放置于扫描范围内。先扫描T1WI、T2WI、扩散加权成像(diffusion weighted imaging, DWI)等多个序列以及DCE-MRI序列第一期,随后以2 mL/s的速度依次注入钆喷酸葡胺(0.1~0.2 mmol/kg)和生理盐水(20 mL),并连续扫描获取DCE-MRI图像,共获得7期图像。DCE-MRI序列扫描参数如下:(1)Siemens Skyra 3.0 T磁共振仪扫描参数为TR 4.7 ms,TE 1.77 ms,矩阵345×416,层厚1.2 mm,共扫描784层,单期扫描时间为1 min 23 s;(2)GE Singa HDx 3.0 T磁共振仪扫描参数为TR 4.2 ms,TE 2.1 ms,矩阵320×320,层厚0.8 mm,共扫描1652层,单期扫描时间为1 min 5 s。
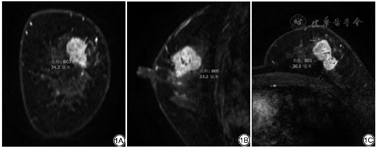
形态学特征参考美国放射学会(American College of Radiology, ACR)制定的乳腺影像报告和数据系统图谱(breast imaging reporting and data system, BI-RADS)2013年版,包括:(1)肿块本身征象,如形状及毛刺;(2)内部强化特征(internal enhancement characteristics, IEC)及非肿块样强化(non-mass enhancement, NME);(3)肿块周围征象,如子灶、周围血管增多、腋窝淋巴结肿大、皮肤改变和乳头改变。由一名从事乳腺影像诊断20余年的高年资医师及另一名书写乳腺相关报告2年余的低年资医师在不知晓乳腺癌免疫组化结果的情况下分别阅片,意见有分歧时需共同再次评估达成一致。同时在DCE-MRI序列中的增强后第二期测量病灶大小,分别测量冠状位、矢状位及轴位上病灶的最大径,取最大值为病灶大小(图1),最终病灶大小取两名医师测量数据的平均值。

DCE-MRI定量参数采用Olea Sphere V3.0 SP28(Olea Medical, La Ciotat, France)商用软件分析。使用Extended Tofts模型进行计算,获得整个病灶的定量参数信息,对应DCE-MRI增强后第二期图像在病灶强化最明显的区域勾画感兴趣区(region of interest, ROI),共勾画3层并记录平均值[5],勾画方法如图2所示,获得定量参数Ktrans、Kep、Ve以及病灶时间-信号强度曲线(time intensity curve, TIC);根据病灶强化早期和延迟期的特征将TIC曲线划分为1型(流入型)、2型(平台型)以及3型(流出型)。


HER-2受体表达状态采用免疫组化(immunohistochemistry, IHC)或原位杂交(fluorescence in situ hybridization, FISH)检测确定,HER-2阳性的标准是IHC结果为2+(FISH检测为基因扩增)或3+;其余则为HER-2阴性[25]。激素受体阳性标准为ER或PR表达率≥1%[26]。
由于乳腺癌治疗方案的不同,本研究将乳腺癌分为激素受体阳性与激素受体阴性、HER-2阳性与HER-2阴性、TNBC与非三阴性乳腺癌(non-triple-negative breast cancer, NTNBC)。其中激素受体阳性为ER和(或)PR表达为阳性,激素受体阴性则需满足ER及PR均阴性。TNBC的免疫组化结果则为ER、PR及HER-2均为阴性[2]。
采用统计学分析软件SPSS 26.0以及R软件(版本4.2.0)对训练组及验证组进行数据分析。采用均数±标准差(±s)描述符合正态分布的计量资料,中位数(四分位距)[M(IQR)]描述不符合正态分布的计量资料,所有的计数资料均使用频数(频率)表达。采用独立样本t检验及曼惠特尼U检验分别分析符合及不符合正态分布的计量资料在乳腺癌不同组别间的差异,采用卡方检验或Fisher精确检验分析分类变量在不同组别间的差异。使用二元logistic回归检验联合影像特征及定量参数区分不同免疫组化结果及分子分型的能力,并进一步结合多个特征构建相应列线图模型。使用受试者工作特征(receiver operator characteristic, ROC)曲线、校正曲线及决策曲线分析法(decision curve analysis, DCA)分别判断预测模型的准确性、分析预测概率与观测概率的一致性以及评估预测模型的净收益。P<0.05表示差异有统计学意义。
共316例患者病例纳入本研究,其中训练组242例,年龄25~82(52.82±10.34)岁,包括激素受体阳性乳腺癌157例、阴性85例;HER-2阳性乳腺癌81例、阴性161例;TNBC 40例、NTNBC 202例。验证组74例,年龄26~81(54.51±11.38)岁,包括激素受体阳性47例、阴性27例;HER-2阳性22例、阴性52例;TNBC 15例、NTNBC 59例。在训练组及验证组,不同组别乳腺癌间患者患病年龄差异均无统计学意义(P>0.05),如表1所示。
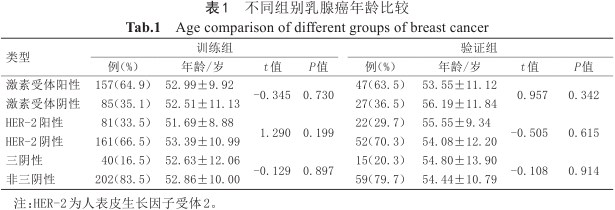
不同组别乳腺癌年龄比较
Age comparison of different groups of breast cancer
不同组别乳腺癌年龄比较
Age comparison of different groups of breast cancer
| 类型 | 训练组 | 验证组 | |||||||
|---|---|---|---|---|---|---|---|---|---|
| 例(%) | 年龄/岁 | t值 | P值 | 例(%) | 年龄/岁 | t值 | P值 | ||
| 激素受体阳性 | 157(64.9) | 52.99±9.92 | -0.345 | 0.730 | 47(63.5) | 53.55±11.12 | 0.957 | 0.342 | |
| 激素受体阴性 | 85(35.1) | 52.51±11.13 | 27(36.5) | 56.19±11.84 | |||||
| HER-2阳性 | 81(33.5) | 51.69±8.88 | 1.290 | 0.199 | 22(29.7) | 55.55±9.34 | -0.505 | 0.615 | |
| HER-2阴性 | 161(66.5) | 53.39±10.99 | 52(70.3) | 54.08±12.20 | |||||
| 三阴性 | 40(16.5) | 52.63±12.06 | -0.129 | 0.897 | 15(20.3) | 54.80±13.90 | -0.108 | 0.914 | |
| 非三阴性 | 202(83.5) | 52.86±10.00 | 59(79.7) | 54.44±10.79 | |||||
注:HER-2为人表皮生长因子受体2。
形态学特征方面如表2、表3及表4所示。激素受体阳性乳腺癌病灶更小(P=0.018),多出现毛刺(P<0.001)。激素受体阳性与阴性乳腺癌都以不均质强化为主,但均匀强化在受体阳性乳腺癌中占比较受体阴性乳腺癌大(12.7% vs. 2.3%),而受体阴性乳腺癌则以环形强化占比更大(36.5%),差异有统计学意义(P=0.004)。激素受体阳性乳腺癌更少出现子灶(P=0.035)、NME(P=0.002)、周围血管增多(P=0.019)以及腋窝淋巴结肿大(P<0.001)。
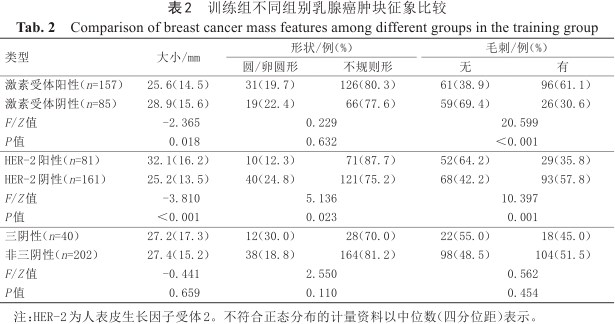
训练组不同组别乳腺癌肿块征象比较
Comparison of breast cancer mass features among different groups in the training group
训练组不同组别乳腺癌肿块征象比较
Comparison of breast cancer mass features among different groups in the training group
| 类型 | 大小/mm | 形状/例(%) | 毛刺/例(%) | ||
|---|---|---|---|---|---|
| 圆/卵圆形 | 不规则形 | 无 | 有 | ||
| 激素受体阳性(n=157) | 25.6(14.5) | 31(19.7) | 126(80.3) | 61(38.9) | 96(61.1) |
| 激素受体阴性(n=85) | 28.9(15.6) | 19(22.4) | 66(77.6) | 59(69.4) | 26(30.6) |
| F/Z值 | -2.365 | 0.229 | 20.599 | ||
| P值 | 0.018 | 0.632 | <0.001 | ||
| HER-2阳性(n=81) | 32.1(16.2) | 10(12.3) | 71(87.7) | 52(64.2) | 29(35.8) |
| HER-2阴性(n=161) | 25.2(13.5) | 40(24.8) | 121(75.2) | 68(42.2) | 93(57.8) |
| F/Z值 | -3.810 | 5.136 | 10.397 | ||
| P值 | <0.001 | 0.023 | 0.001 | ||
| 三阴性(n=40) | 27.2(17.3) | 12(30.0) | 28(70.0) | 22(55.0) | 18(45.0) |
| 非三阴性(n=202) | 27.4(15.2) | 38(18.8) | 164(81.2) | 98(48.5) | 104(51.5) |
| F/Z值 | -0.441 | 2.550 | 0.562 | ||
| P值 | 0.659 | 0.110 | 0.454 | ||
注:HER-2为人表皮生长因子受体2。不符合正态分布的计量资料以中位数(四分位距)表示。
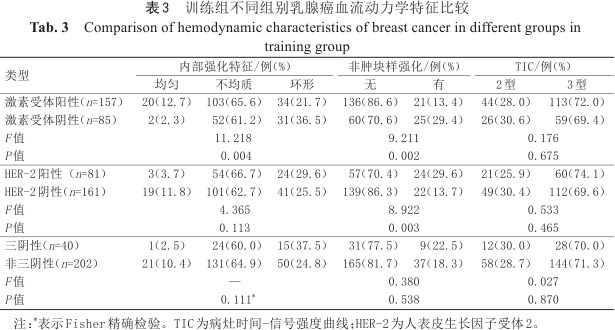
训练组不同组别乳腺癌血流动力学特征比较
Comparison of hemodynamic characteristics of breast cancer in different groups in training group
训练组不同组别乳腺癌血流动力学特征比较
Comparison of hemodynamic characteristics of breast cancer in different groups in training group
| 类型 | 内部强化特征/例(%) | 非肿块样强化/例(%) | TIC/例(%) | ||||
|---|---|---|---|---|---|---|---|
| 均匀 | 不均质 | 环形 | 无 | 有 | 2型 | 3型 | |
| 激素受体阳性(n=157) | 20(12.7) | 103(65.6) | 34(21.7) | 136(86.6) | 21(13.4) | 44(28.0) | 113(72.0) |
| 激素受体阴性(n=85) | 2(2.3) | 52(61.2) | 31(36.5) | 60(70.6) | 25(29.4) | 26(30.6) | 59(69.4) |
| F值 | 11.218 | 9.211 | 0.176 | ||||
| P值 | 0.004 | 0.002 | 0.675 | ||||
| HER-2阳性(n=81) | 3(3.7) | 54(66.7) | 24(29.6) | 57(70.4) | 24(29.6) | 21(25.9) | 60(74.1) |
| HER-2阴性(n=161) | 19(11.8) | 101(62.7) | 41(25.5) | 139(86.3) | 22(13.7) | 49(30.4) | 112(69.6) |
| F值 | 4.365 | 8.922 | 0.533 | ||||
| P值 | 0.113 | 0.003 | 0.465 | ||||
| 三阴性(n=40) | 1(2.5) | 24(60.0) | 15(37.5) | 31(77.5) | 9(22.5) | 12(30.0) | 28(70.0) |
| 非三阴性(n=202) | 21(10.4) | 131(64.9) | 50(24.8) | 165(81.7) | 37(18.3) | 58(28.7) | 144(71.3) |
| F值 | — | 0.380 | 0.027 | ||||
| P值 | 0.111* | 0.538 | 0.870 | ||||
注:*表示Fisher精确检验。TIC为病灶时间-信号强度曲线;HER-2为人表皮生长因子受体2。
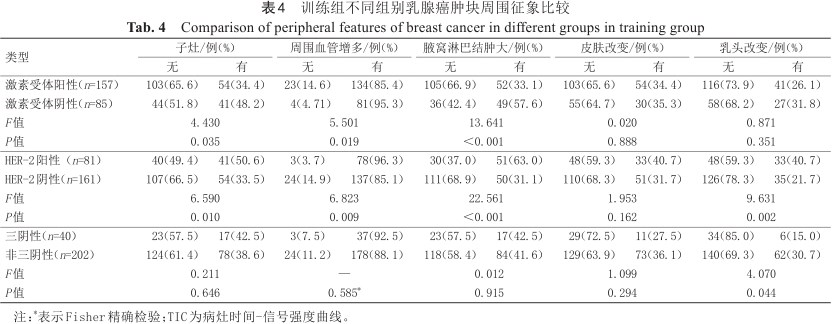
训练组不同组别乳腺癌肿块周围征象比较
Comparison of peripheral features of breast cancer in different groups in training group
训练组不同组别乳腺癌肿块周围征象比较
Comparison of peripheral features of breast cancer in different groups in training group
| 类型 | 子灶/例(%) | 周围血管增多/例(%) | 腋窝淋巴结肿大/例(%) | 皮肤改变/例(%) | 乳头改变/例(%) | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| 无 | 有 | 无 | 有 | 无 | 有 | 无 | 有 | 无 | 有 | |
| 激素受体阳性(n=157) | 103(65.6) | 54(34.4) | 23(14.6) | 134(85.4) | 105(66.9) | 52(33.1) | 103(65.6) | 54(34.4) | 116(73.9) | 41(26.1) |
| 激素受体阴性(n=85) | 44(51.8) | 41(48.2) | 4(4.71) | 81(95.3) | 36(42.4) | 49(57.6) | 55(64.7) | 30(35.3) | 58(68.2) | 27(31.8) |
| F值 | 4.430 | 5.501 | 13.641 | 0.020 | 0.871 | |||||
| P值 | 0.035 | 0.019 | <0.001 | 0.888 | 0.351 | |||||
| HER-2阳性(n=81) | 40(49.4) | 41(50.6) | 3(3.7) | 78(96.3) | 30(37.0) | 51(63.0) | 48(59.3) | 33(40.7) | 48(59.3) | 33(40.7) |
| HER-2阴性(n=161) | 107(66.5) | 54(33.5) | 24(14.9) | 137(85.1) | 111(68.9) | 50(31.1) | 110(68.3) | 51(31.7) | 126(78.3) | 35(21.7) |
| F值 | 6.590 | 6.823 | 22.561 | 1.953 | 9.631 | |||||
| P值 | 0.010 | 0.009 | <0.001 | 0.162 | 0.002 | |||||
| 三阴性(n=40) | 23(57.5) | 17(42.5) | 3(7.5) | 37(92.5) | 23(57.5) | 17(42.5) | 29(72.5) | 11(27.5) | 34(85.0) | 6(15.0) |
| 非三阴性(n=202) | 124(61.4) | 78(38.6) | 24(11.2) | 178(88.1) | 118(58.4) | 84(41.6) | 129(63.9) | 73(36.1) | 140(69.3) | 62(30.7) |
| F值 | 0.211 | — | 0.012 | 1.099 | 4.070 | |||||
| P值 | 0.646 | 0.585* | 0.915 | 0.294 | 0.044 | |||||
注:*表示Fisher精确检验;TIC为病灶时间-信号强度曲线。
定量参数方面,激素受体阳性乳腺癌Ve大于受体阴性,差异有统计学意义(P<0.001)。Ktrans及Kep在激素受体阳性及阴性组间差异均无统计学意义,见表5。
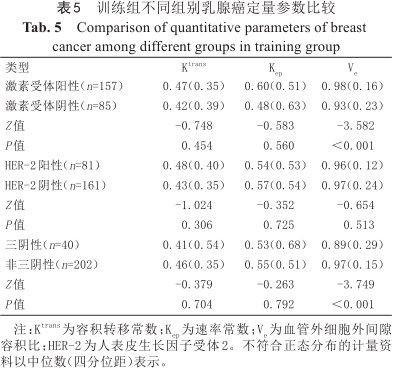
训练组不同组别乳腺癌定量参数比较
Comparison of quantitative parameters of breast cancer among different groups in training group
训练组不同组别乳腺癌定量参数比较
Comparison of quantitative parameters of breast cancer among different groups in training group
| 类型 | Ktrans | Kep | Ve |
|---|---|---|---|
| 激素受体阳性(n=157) | 0.47(0.35) | 0.60(0.51) | 0.98(0.16) |
| 激素受体阴性(n=85) | 0.42(0.39) | 0.48(0.63) | 0.93(0.23) |
| Z值 | -0.748 | -0.583 | -3.582 |
| P值 | 0.454 | 0.560 | <0.001 |
| HER-2阳性(n=81) | 0.48(0.40) | 0.54(0.53) | 0.96(0.12) |
| HER-2阴性(n=161) | 0.43(0.35) | 0.57(0.54) | 0.97(0.24) |
| Z值 | -1.024 | -0.352 | -0.654 |
| P值 | 0.306 | 0.725 | 0.513 |
| 三阴性(n=40) | 0.41(0.54) | 0.53(0.68) | 0.89(0.29) |
| 非三阴性(n=202) | 0.46(0.35) | 0.55(0.51) | 0.97(0.15) |
| Z值 | -0.379 | -0.263 | -3.749 |
| P值 | 0.704 | 0.792 | <0.001 |
注:Ktrans为容积转移常数;Kep为速率常数;Ve为血管外细胞外间隙容积比;HER-2为人表皮生长因子受体2。不符合正态分布的计量资料以中位数(四分位距)表示。
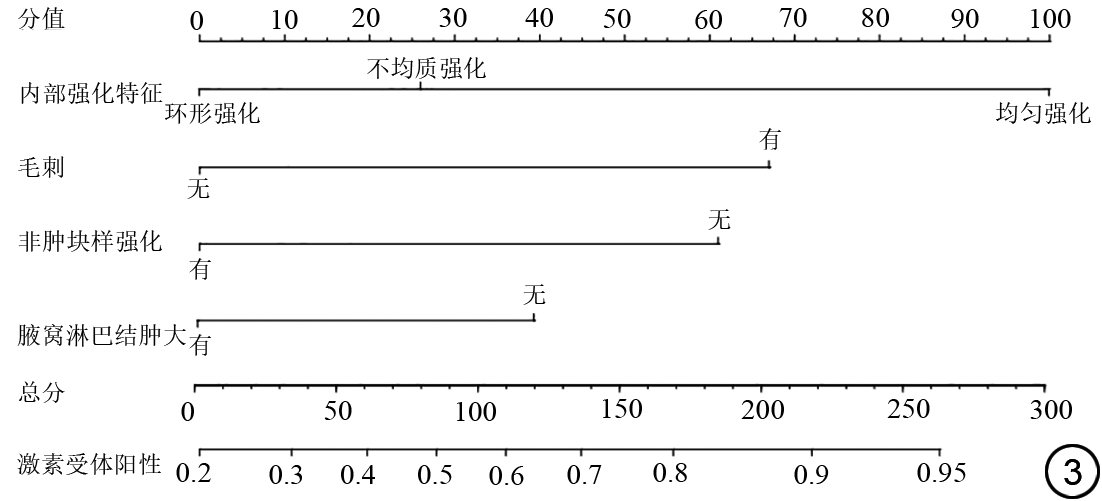
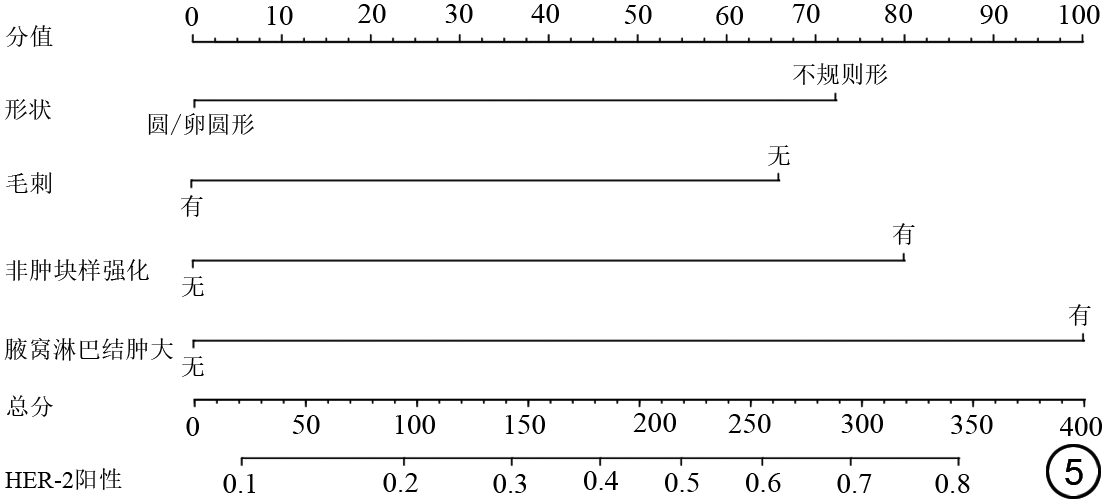
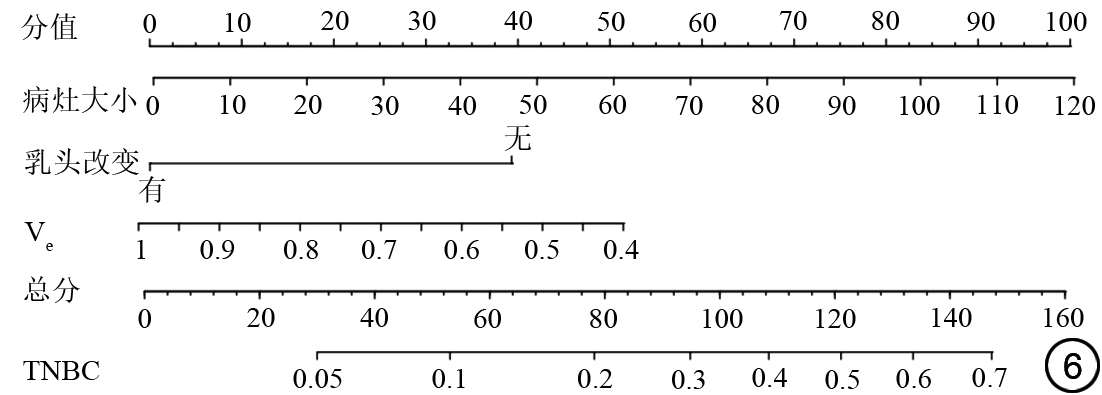
通过二元logistic回归筛选出毛刺、IEC、NME以及腋窝淋巴结肿大可以鉴别激素受体阳性及激素受体阴性乳腺癌,综合以上因素建立的激素受体阳性乳腺癌预测模型如表6所示,曲线下面积(area under the curve, AUC)为0.746(95% CI:0.681~0.811),敏感度、特异度及准确度分别为82.8%、52.9%及72.3%。列线图如图3所示,图4示激素受体阳性乳腺癌预测模型的校正曲线与理想曲线校准良好,DCA曲线显示阈值概率在30%~81%时使用该模型预测激素受体阳性乳腺癌的净收益更高。形状、毛刺、NME及腋窝淋巴结肿大与HER-2阳性乳腺癌显著相关,结合上述特征构建的HER-2阳性乳腺癌预测模型如表6所示,AUC为0.733(95% CI:0.665~0.800),敏感度、特异度及准确度分别为55.6%、82.0%及73.1%。列线图如图5所示,图4中校正曲线显示出较好的拟合度,DCA曲线显示阈值概率在15%~75%时使用该模型预测HER-2阳性乳腺癌的净收益更高。TNBC与病灶大小、乳头改变及Ve显著相关,TNBC的预测模型如表6所示,AUC为0.689(95% CI:0.600~0.779),敏感度、特异度及准确度分别为80.0%、52.5%及57.0%,列线图如图6所示。图4中TNBC预测模型的校正曲线显示模型一致性较高,DCA曲线显示阈值概率在17%~64%时使用该模型预测TNBC的净收益更高。
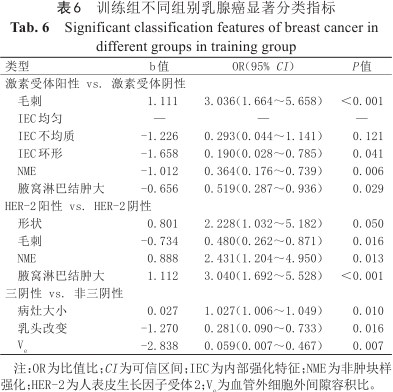
训练组不同组别乳腺癌显著分类指标
Significant classification features of breast cancer in different groups in training group
训练组不同组别乳腺癌显著分类指标
Significant classification features of breast cancer in different groups in training group
| 类型 | b值 | OR(95% CI) | P值 |
|---|---|---|---|
| 激素受体阳性 vs. 激素受体阴性 | |||
| 毛刺 | 1.111 | 3.036(1.664~5.658) | <0.001 |
| IEC均匀 | — | — | — |
| IEC不均质 | -1.226 | 0.293(0.044~1.141) | 0.121 |
| IEC环形 | -1.658 | 0.190(0.028~0.785) | 0.041 |
| NME | -1.012 | 0.364(0.176~0.739) | 0.006 |
| 腋窝淋巴结肿大 | -0.656 | 0.519(0.287~0.936) | 0.029 |
| HER-2阳性 vs. HER-2阴性 | |||
| 形状 | 0.801 | 2.228(1.032~5.182) | 0.050 |
| 毛刺 | -0.734 | 0.480(0.262~0.871) | 0.016 |
| NME | 0.888 | 2.431(1.204~4.950) | 0.013 |
| 腋窝淋巴结肿大 | 1.112 | 3.040(1.692~5.528) | <0.001 |
| 三阴性 vs. 非三阴性 | |||
| 病灶大小 | 0.027 | 1.027(1.006~1.049) | 0.010 |
| 乳头改变 | -1.270 | 0.281(0.090~0.733) | 0.016 |
| Ve | -2.838 | 0.059(0.007~0.467) | 0.007 |
注:OR为比值比;CI为可信区间;IEC为内部强化特征;NME为非肿块样强化;HER-2为人表皮生长因子受体2;Ve为血管外细胞外间隙容积比。

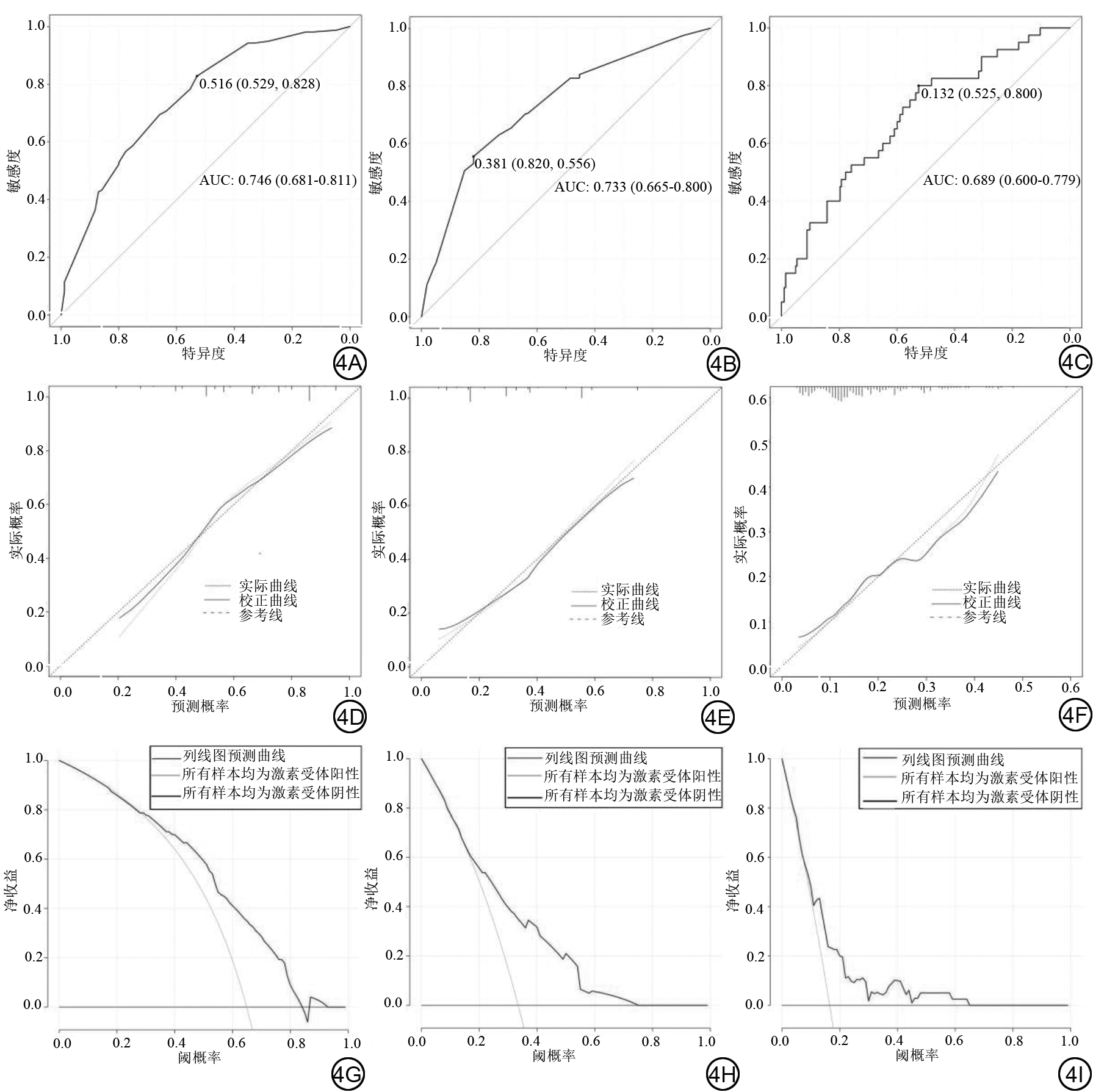



验证组中激素受体阳性、HER-2阳性及TNBC的DCE-MRI图像特征及定量参数如表7所示。利用验证组数据进行不同类型乳腺癌预测模型验证,其ROC曲线、校正曲线及DCA曲线如图7所示。其中激素受体阳性预测模型的AUC为0.829(95% CI:0.730~0.926),敏感度、特异度及准确度分别为78.7%、74.1%及77.0%。激素受体阳性乳腺癌预测模型的校正曲线与理想曲线校准良好,DCA曲线显示阈值概率在0%~94%时使用该模型预测激素受体阳性乳腺癌的净收益更高;HER-2阳性预测模型AUC为0.649(95% CI:0.507~0.791),敏感度、特异度及准确度分别为63.6%、65.4%及64.9%。HER-2阳性乳腺癌预测模型的校正曲线显示出较好的拟合度,DCA曲线显示阈值概率在0%~65%时使用该模型预测HER-2阳性乳腺癌的净收益更高;TNBC预测模型AUC为0.794(95% CI:0.662~0.927),敏感度、特异度及准确度分别为86.7%、67.8%及71.6%。TNBC的校正曲线显示模型的一致性较高,DCA曲线显示显示阈值概率在0%~97%时使用该模型预测TNBC的净收益更高。
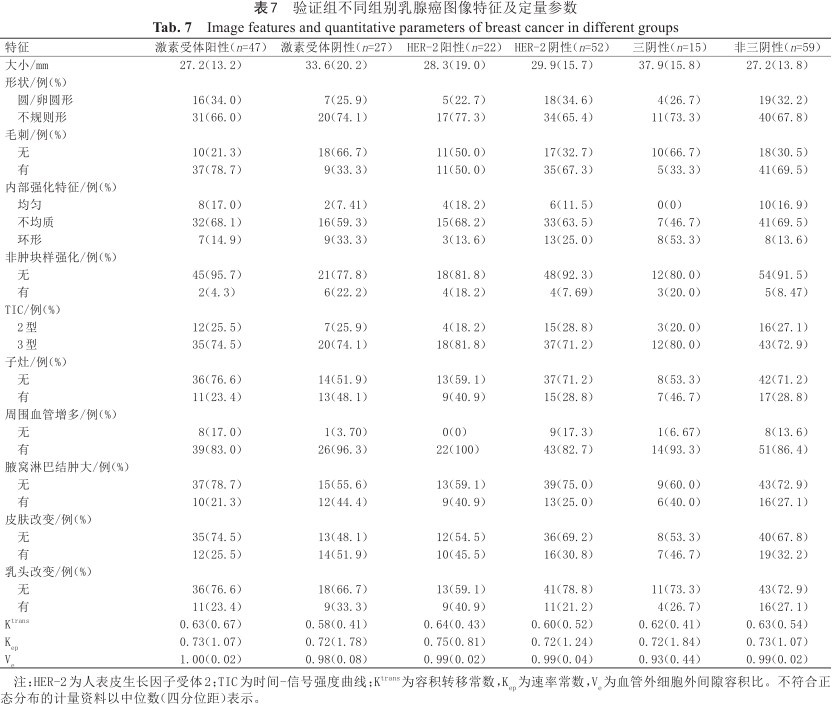
验证组不同组别乳腺癌图像特征及定量参数
Image features and quantitative parameters of breast cancer in different groups
验证组不同组别乳腺癌图像特征及定量参数
Image features and quantitative parameters of breast cancer in different groups
| 特征 | 激素受体阳性(n=47) | 激素受体阴性(n=27) | HER-2阳性(n=22) | HER-2阴性(n=52) | 三阴性(n=15) | 非三阴性(n=59) | |
|---|---|---|---|---|---|---|---|
| 大小/mm | 27.2(13.2) | 33.6(20.2) | 28.3(19.0) | 29.9(15.7) | 37.9(15.8) | 27.2(13.8) | |
| 形状/例(%) | |||||||
| 圆/卵圆形 | 16(34.0) | 7(25.9) | 5(22.7) | 18(34.6) | 4(26.7) | 19(32.2) | |
| 不规则形 | 31(66.0) | 20(74.1) | 17(77.3) | 34(65.4) | 11(73.3) | 40(67.8) | |
| 毛刺/例(%) | |||||||
| 无 | 10(21.3) | 18(66.7) | 11(50.0) | 17(32.7) | 10(66.7) | 18(30.5) | |
| 有 | 37(78.7) | 9(33.3) | 11(50.0) | 35(67.3) | 5(33.3) | 41(69.5) | |
| 内部强化特征/例(%) | |||||||
| 均匀 | 8(17.0) | 2(7.41) | 4(18.2) | 6(11.5) | 0(0) | 10(16.9) | |
| 不均质 | 32(68.1) | 16(59.3) | 15(68.2) | 33(63.5) | 7(46.7) | 41(69.5) | |
| 环形 | 7(14.9) | 9(33.3) | 3(13.6) | 13(25.0) | 8(53.3) | 8(13.6) | |
| 非肿块样强化/例(%) | |||||||
| 无 | 45(95.7) | 21(77.8) | 18(81.8) | 48(92.3) | 12(80.0) | 54(91.5) | |
| 有 | 2(4.3) | 6(22.2) | 4(18.2) | 4(7.69) | 3(20.0) | 5(8.47) | |
| TIC/例(%) | |||||||
| 2型 | 12(25.5) | 7(25.9) | 4(18.2) | 15(28.8) | 3(20.0) | 16(27.1) | |
| 3型 | 35(74.5) | 20(74.1) | 18(81.8) | 37(71.2) | 12(80.0) | 43(72.9) | |
| 子灶/例(%) | |||||||
| 无 | 36(76.6) | 14(51.9) | 13(59.1) | 37(71.2) | 8(53.3) | 42(71.2) | |
| 有 | 11(23.4) | 13(48.1) | 9(40.9) | 15(28.8) | 7(46.7) | 17(28.8) | |
| 周围血管增多/例(%) | |||||||
| 无 | 8(17.0) | 1(3.70) | 0(0) | 9(17.3) | 1(6.67) | 8(13.6) | |
| 有 | 39(83.0) | 26(96.3) | 22(100) | 43(82.7) | 14(93.3) | 51(86.4) | |
| 腋窝淋巴结肿大/例(%) | |||||||
| 无 | 37(78.7) | 15(55.6) | 13(59.1) | 39(75.0) | 9(60.0) | 43(72.9) | |
| 有 | 10(21.3) | 12(44.4) | 9(40.9) | 13(25.0) | 6(40.0) | 16(27.1) | |
| 皮肤改变/例(%) | |||||||
| 无 | 35(74.5) | 13(48.1) | 12(54.5) | 36(69.2) | 8(53.3) | 40(67.8) | |
| 有 | 12(25.5) | 14(51.9) | 10(45.5) | 16(30.8) | 7(46.7) | 19(32.2) | |
| 乳头改变/例(%) | |||||||
| 无 | 36(76.6) | 18(66.7) | 13(59.1) | 41(78.8) | 11(73.3) | 43(72.9) | |
| 有 | 11(23.4) | 9(33.3) | 9(40.9) | 11(21.2) | 4(26.7) | 16(27.1) | |
| Ktrans | 0.63(0.67) | 0.58(0.41) | 0.64(0.43) | 0.60(0.52) | 0.62(0.41) | 0.63(0.54) | |
| Kep | 0.73(1.07) | 0.72(1.78) | 0.75(0.81) | 0.72(1.24) | 0.72(1.84) | 0.73(1.07) | |
| Ve | 1.00(0.02) | 0.98(0.08) | 0.99(0.02) | 0.99(0.04) | 0.93(0.44) | 0.99(0.02) | |
注:HER-2为人表皮生长因子受体2;TIC为时间-信号强度曲线;Ktrans为容积转移常数,Kep为速率常数,Ve为血管外细胞外间隙容积比。不符合正态分布的计量资料以中位数(四分位距)表示。

临床上乳腺癌治疗方案的选择主要基于激素受体及HER-2表达状态,其中激素受体阳性乳腺癌患者可选择内分泌治疗[21,27],HER-2阳性则选择抗HER-2靶向治疗[28, 29, 30],而TNBC治疗方法相对单一,预后较差[31, 32]。多数研究聚焦于DCE-MRI图像特征或定量参数与分子分型的相关性,但管腔B型包括HER-2阳性及HER-2阴性。即使预测为管腔B型,仍然不能选择是否行抗HER-2靶向治疗。本研究通过分析DCE-MRI影像特征及定量参数与激素受体、HER-2表达状态的相关性,发现病灶大小、形状、毛刺、IEC、NME、子灶、周围血管增多、腋窝淋巴结肿大、乳头改变以及Ve等与激素受体、HER-2表达状态相关。进一步构建激素受体阳性、HER-2阳性及TNBC的预测模型,训练组及验证组结果均表明三种预测模型的预测效能较高。本研究揭示DCE-MRI能够为无创预测乳腺癌免疫组化结果提供一定参考价值,有助于乳腺癌治疗方案的合理选择。
毛刺是癌细胞生长并渗透到周围组织区域,引起过度间质反应和纤维结缔组织增生。在一定程度上毛刺可限制癌细胞扩散,提示预后良好[19]。多个学者发现ER阳性组及PR阳性组毛刺征象的发生率高于阴性组[19,33, 34],且LONG等[33]的研究结果显示毛刺与HER-2阴性相关。在本研究中,激素受体阳性组、HER-2阴性组乳腺癌毛刺的发生率更高,激素受体阳性乳腺癌多表现为均匀强化,而受体阴性乳腺癌以环形强化占比较大。环形强化提示肿瘤恶性程度高[27,34],其病理基础为高级别肿瘤生长速度快,肿瘤内营养不均衡,易出现中心性坏死或多灶性、混合性坏死区[33]。LONG等[33]的研究结果表明激素受体阳性乳腺癌分化程度高,恶性程度低。本研究结果中显示激素受体阳性乳腺癌出现毛刺和均匀强化比例较高,肿块也较小,提示肿瘤恶性程度低,预后良好,这与LONG等的结果相仿。肿瘤大小是乳腺癌最重要的预后因素之一,肿瘤越大,浸润范围越广,向周围侵犯及远处转移的风险也越高,预后越差[34]。本研究还发现,激素受体阳性乳腺癌出现子灶、NME、周围血管增多以及腋窝淋巴结肿大的比例更低,很大程度上是因为受体阳性乳腺癌的肿瘤细胞以整倍体为主,细胞增殖程度低,转移和复发概率小[33]。
本组研究数据中,HER-2阳性乳腺癌形状多不规则,病灶更大,且更易出现子灶、周围血管增多、腋窝淋巴结肿大及乳头改变等征象。这方面与其他学者的研究结果一致[33, 34]。一般认为肿瘤的形状取决于肿瘤不同的生长方式,而HER-2阳性乳腺癌多出现较大肿块及肿瘤相关征象,可能是由于HER-2过表达能抑制癌细胞凋亡,同时促进肿瘤新生血管形成,进一步促使肿瘤快速生长、侵袭周围正常组织并向远处转移。另外,我们发现HER-2阳性乳腺癌中NME的发生率更高,其原因或许与HER-2阳性肿瘤具有更多导管内成分有关[21]。
本研究结果显示TNBC不易出现乳头改变,可能与TNBC的肿瘤-乳头距离更大有关[35]。相关研究结果显示TNBC中圆形及卵圆形病灶占比大于NTNBC [18,32],本研究同样发现TNBC中圆形及卵圆形病灶较NTNBC多见,尽管差异无统计学意义,这也符合TNBC多表现出良性影像特征的特点[19,32]。
在定量参数方面,TNBC的Ve小于NTNBC,这与许华等[24]的研究结果一致。本研究还发现受体阳性乳腺癌的Ve大于激素受体阴性乳腺癌,而KANG等[36]的研究结果则为PR阴性组的Ve值大于阳性组,与本研究结果不同。关于定量参数Ktrans和Kep,多篇文章探讨了它们与乳腺癌预后因素和分子亚型的关系,相应结果各有不同。我们的结果显示,在激素受体组间、HER-2阳性及阴性组间以及TNBC和NTNBC间的Ktrans和Kep差异均无统计学意义,与NAGASAKA等[6]的研究结果一致。但也有不同结果,相关研究[18]认为HER-2阳性与Ktrans、Kep呈显著正相关,低Kep与PR阳性状态独立相关[22],高Ktrans和Kep的肿瘤与ER阴性、TNBC、Ki-67高表达、P53阳性、高组织学分级(Ⅱ、Ⅲ)和淋巴血管间隙相关[36]。上述差异的出现可能与研究人群、MRI扫描方案、ROI放置、药代动力学分析软件的不同以及乳腺癌的异质性有关,尚需要更多研究来分析定量参数与乳腺癌免疫组化结果或分子分型的相关性。
本研究结果提示DCE-MRI影像学特征能够无创预测激素受体阳性、HER-2阳性及TNBC,进而为临床乳腺癌个性化治疗提供依据。对临床乳腺癌辅助治疗反应不敏感的患者,本研究结果可以为其治疗方案的调整提供一些参考依据。本研究为进一步更深入地研究多个MRI定量参数预测不同类型乳腺癌奠定了基础。
本研究的不足之处首先是采用了两种不同机器扫描得出的图像特征及定量参数,需进一步研究明确本结果是否受扫描机器及扫描参数的影响;其次是样本量偏少以及乳腺癌图像特征的判断存在一定主观性,还需更多数据来验证本研究结果。随着MRI技术的改进、DCE-MRI序列的优化以及影像组学等多种手段的综合运用,有望进一步提高多参数乳腺MRI预测乳腺癌分子分型的潜能。
综上所述,乳腺DCE-MRI图像不仅能够提供肿瘤形态、血流动力学特征以及肿瘤周围情况,其部分图像特征及定量参数还与乳腺癌免疫组化结果及分子分型显著相关。乳腺DCE-MRI检查在无创预测乳腺癌分子亚型方面具备较大潜力,有望为乳腺癌个性化治疗决策提供一定参考依据。
代婷, 苏桐, 王锐, 等. DCE-MRI影像特征对乳腺癌激素受体、HER-2及三阴性乳腺癌的预测价值[J]. 磁共振成像, 2023, 14(4): 57-67.
DAI T, SU T, WANG R, et al. Predictive value of DCE-MRI features of breast cancer on hormone receptor, HER-2 and triple negative breast cancer[J]. Chin J Magn Reson Imaging, 2023, 14(4): 57-67.
National Key R & D Program (No. 2020YFA0714002); Medical Scientific Research Project of Chongqing Health and Family Planning Commission (No. 2015MSXM011).
全体作者均声明无利益冲突。



























