
探讨基于动态对比增强MRI(dynamic contrast enhancement MRI, DCE-MRI)瘤内及瘤周的影像组学模型联合临床、影像学指标预测乳腺癌患者人表皮生长因子受体2(human epidermal growth factor receptor 2, HER-2)表达状态的价值。
回顾性收集2018年6月至2022年9月经病理证实为乳腺癌的患者病例资料272例,其中HER-2阳性139例,阴性133例,所有病例均在治疗前进行DCE-MRI检查。采取7:3的比例随机分为训练集和验证集。在训练集中使用皮尔森相关系数、递归特征消除法、逻辑回归对瘤内及瘤周影像组学数据进行降维及模型构建;利用多因素logistic回归筛选临床及影像学资料中的独立危险因素,以此构建临床模型;最终以瘤内、瘤周及临床特征构建联合模型。采用受试者工作特征曲线下面积(area under the curve, AUC)评价模型的效能,应用决策曲线分析(decision curve analysis, DCA)评估模型的临床价值。
临床模型、瘤内模型、瘤周模型、瘤内+瘤周模型及联合模型在训练集的AUC分别为0.736、0.784、0.806、0.831、0.854,准确度分别为69.5%、70.5%、75.8%、73.7%、76.8%,敏感度分别为87.6%、53.6%、71.1%、62.9%、72.2%,特异度分别为50.5%、88.2%、80.6%、84.9%、81.7%;在验证集中的AUC分别为0.731、0.724、0.713、0.780、0.799,准确度分别为73.2%、70.7%、68.3%、73.1%、78.0%,敏感度分别为76.2%、61.9%、88.1%、76.2%、78.6%,特异度分别为70.0%、80.0%、47.5%、70.0%、77.5%。经DeLong检验,训练集中联合模型与临床模型、瘤内模型、瘤周模型之间差异有统计学意义(Z=3.660、2.791、2.201,P=0.0003、0.005、0.028),联合模型与瘤内+瘤周模型之间差异无统计学意义(Z=1.583,P=0.114)。结果表明在训练集和验证集中联合模型对预测HER-2的状态优于临床模型、瘤内模型、瘤周模型及瘤内+瘤周模型。DCA显示在训练集中风险阈值在13%~60%时联合模型较临床模型、瘤内模型、瘤周模型及瘤内+瘤周模型具有更高的临床价值。
基于DCE-MRI瘤内及瘤周影像组学联合临床、影像学特征构建的联合模型能够较好地预测乳腺癌患者HER-2的表达状态。

本刊刊出的所有论文不代表本刊编委会的观点,除非特别声明
根据国际癌症研究机构发布的数据,2020年全球新增癌症病例约1930万、死亡人数约1000万,乳腺癌超越肺癌,成为发病率最高的恶性肿瘤[1]。研究探索与乳腺癌诊断、预后等相关的指标具有现实意义。研究表明人类表皮生长因子受体2(human epidermal growth factor receptor 2, HER-2)在大约20%~25%的患者中过度表达[2],HER-2过表达型乳腺癌具有更高的侵袭性和转移率,患者的预后往往不佳[3],且HER-2阳性乳腺癌患者确诊时间越晚患者预后就会越差[4]。抗HER-2靶向药物使用可以显著改善HER-2阳性乳腺癌患者的治疗及预后[5, 6, 7, 8]。因此准确预测乳腺癌患者HER-2表达对提高患者的治疗效果及改善预后具有较为重要的临床意义。目前,临床上主要采用荧光原位杂交法(fluorescence in situ hybridization, FISH)和免疫组织化学法来确定患者HER-2的表达和扩增状态,手术切除或穿刺活检获取标本都为有创检查,会给患者带来不同程度的伤害,同时穿刺活检由于取材较少,对HER-2的评价并不能代表肿瘤的整个区域[9]。影像组学为我们提供了一种可以无创地对肿瘤整体HER-2的表达状态进行预测评价的方法,进而就能更精准地对乳腺肿瘤进行对应治疗,对改善患者的预后有着较高的价值[10]。临床上对乳腺方面的检查通常为乳腺钼靶、超声及磁共振成像,乳腺钼靶和超声由于价格较低、检查用时较短多用于乳腺癌患者的筛查,也有相关研究表明乳腺钼靶和常规超声参数可以预测乳腺癌患者HER-2的表达[11, 12, 13],但乳腺钼靶和超声提供的影像信息较少,且病灶识别受操作者影响差异明显。动态对比增强MRI(dynamic contrast enhancement MRI, DCE-MRI)可以连续采集多期增强图像,得到时间-信号强度曲线(time-signal intensity curve, TIC),有学者基于TIC曲线的参数进行了相关研究,表明TIC曲线参数与乳腺癌患者的治疗预后有一定的相关性[14],但未对TIC分型与乳腺癌患者HER-2表达的相关性做进一步的研究。本研究旨在探讨基于DCE-MRI瘤内及瘤周影像组学特征联合临床指标在预测乳腺癌患者HER-2基因表达中的价值。同时本研究创新性地纳入了时间-信号强度曲线,探究TIC分型对乳腺癌患者HER-2表达的影响,可为临床提供一种无创预测HER-2表达的方法,并对乳腺癌患者的治疗具有一定的指导作用。
回顾性收集2018年6月至2022年9月于皖南医学院弋矶山医院诊断为乳腺癌患者的DCE-MRI影像资料与临床信息。纳入标准:(1)原发病灶经手术病理证实为乳腺癌的患者;(2)有完整的治疗前临床、影像学资料;(3)无其他恶性肿瘤病史;(4)TIC分型为Ⅱ~Ⅲ型(TIC I型的乳腺病变大多为良性病变,本研究乳腺癌患者TIC Ⅰ型较少,为了防止选择偏倚,因此只纳入了TIC Ⅱ~Ⅲ型进行研究)。排除标准:(1)进行DCE-MRI前进行过手术或新辅助化疗等相关治疗;(2)图像质量欠佳,病灶显示欠清,难以勾画出完整的病灶;(3)多发病灶或已发现远处转移。最终入组病例272例,共272个病灶,将患者按照7∶3的比例随机分为训练集和验证集。本研究遵守《赫尔辛基宣言》,经皖南医学院弋矶山医院伦理委员会批准,免除受试者知情同意(批准文号:2019伦审研第62号)。
所有患者均进行了常规及DCE-MRI检查,采用GE Signa HDxt 3.0 T MR扫描仪,8通道乳腺专用相控阵线圈。患者取俯卧位,双侧乳腺自然悬垂于线圈内,扫描范围为腋窝至乳腺下缘。采用轴位和矢状面扫描;LAVA T1WI扫描参数:TR 5.68 ms,TE 2.20 ms,TI 16 ms,层厚2.0 mm,层间距 0 mm,FOV 340 mm×340 mm,矩阵 348×348。增强扫描采用双筒高压注射器静脉注射对比剂钆-二乙烯三胺五乙酸(拜耳制药,德国),注射流速 2.5 mL/s,剂量0.1 mmol/kg,轴位平扫后注入对比剂后即行LAVA T1WI扫描,参数同上。每期扫描60 s,扫描8期,共480 s。
将所有患者的DCE-MRI第三期图像从医学影像存档与通信系统以DICOM格式导入ITK-SNAP 3.8.0软件,将患者匿名化处理。肿瘤的瘤内区域由一名具有5年以上乳腺MRI诊断经验的主治医师在DCE-MRI第三期图像上通过手动分割的方法逐层勾画肿瘤原发灶(避开肿瘤的液化、坏死区),肿瘤的瘤周区域选择肿瘤瘤体自动向外扩张5 mm,手动调整确定勾画的范围(图1)。再将勾画出的图像导入基于Python 3.6.8编写的开源组学分析平台FeAture Explorer(FAE, v0.5.2,https://github.com/salan668/FAE)[15]进行影像组学特征提取与分析,两周后由原先这名医师和另外一名具有15年以上乳腺MRI诊断经验的副主任医师随机抽取40例患者再次进行勾画,并进行可重复性检验,删除组内及组间相关系数(intra-and inter-class correlation coefficient, ICC)<0.80的特征。首先对提取出来的影像组学特征进行Z-score标准化处理,使数据之间具有可比性,使用皮尔森相关系数(Pearson correlation coefficients, PCC)、递归特征消除法(recursive feature elimination, RFE)对影像组学数据进行降维(删除PCC值大于0.950的特征),使用logistic回归作为分类器,分别构建瘤内及瘤周影像组学模型;并采用5折法交叉验证,以提高模型的稳定性。分别计算每个患者的瘤内及瘤周影像组学标签得分,以此构建瘤内及瘤周影像组学模型、瘤内+瘤周模型;将有统计学意义的临床指标及影像学特征纳入多因素logistics回归分析,得出模型的独立预测因子以此构建临床模型;最终将有统计学意义的临床变量和瘤内及瘤周影像组学标签纳入多因素logistics回归分析以此构建联合模型。


HER-2表达情况为(+++)时认定为阳性,表达情况为(-)或(+)判定为阴性,对于(++)的病例需进一步做FISH检测判断,有扩增者为阳性组,无扩增者为阴性组。将(-)、(+)、(++)无扩增定义为阴性组,将(++)扩增、(+++)定义为阳性组。
采用SPSS 25.0软件和R软件(版本4.2.1)进行统计学分析。采用Kolmogorov-Smirnov检验对计量资料进行正态性检验,符合正态分布的计量资料用(±s)表示,不符合正态分布的计量资料用中位数(上下四分位数)表示。计量资料比较采用独立样本t检验(正态分布且方差齐)或Mann-Whitney U检验(偏态分布或方差不齐),计数资料以例表示,组间比较采用χ2检验。采用多因素logistic回归分析筛选出独立预测因子构建预测模型并绘制诺谟图,绘制校正曲线评价模型的拟合优度,并用Hosmer-Lemeshow检验评价校正曲线的一致性,计算受试者工作特征(receiver operating characteristic, ROC)曲线下面积(area under the curve, AUC),评价模型的鉴别效能,通过DeLong检验比较临床模型、瘤内影像组学模型、瘤周影像组学模型、瘤内+瘤周模型及联合模型间AUC。绘制决策曲线分析(decision curve analysis, DCA)比较模型的临床价值。P<0.05表示差异有统计学意义。
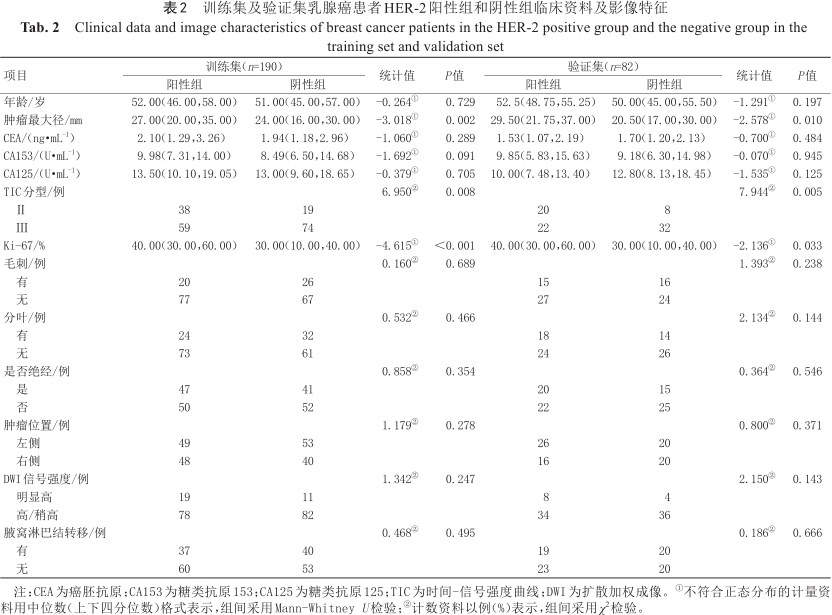
本研究共收集行DCE-MRI检查的乳腺癌患者415例,排除图像质量不佳使病灶难以勾画的患者32例,在行DCE-MRI检查前行新辅助化疗的78例、手术治疗的患者33例,最终入组272例。272例患者中HER-2阳性139例,阴性133例,采取7∶3的比例随机分为训练集和验证集。训练集和验证集中临床资料及影像学特征比较见表1。在训练集和验证集中HER-2阳性组和HER-2阴性组的年龄、癌胚抗原(carcinoembryonic antigen, CEA)、糖类抗原153(carbohydrate antigen 153, CA153)、糖类抗原125(carbohydrate antigen 125, CA125)、有无毛刺、有无分叶、是否绝经、肿瘤位置、扩散加权成像信号强度、有无腋窝淋巴结转移差异均无统计学意义(P>0.05),TIC分型、增殖细胞核抗原Ki-67、肿瘤最大径差异均有统计学意义(P<0.05)(表2、图2)。将训练集中有统计学意义的变量纳入多因素logistics回归分析,结果显示TIC分型(OR=2.784,P=0.004)、Ki-67(OR=1.033,P<0.001)、肿瘤最大径(OR=1.031,P=0.025)为独立预测因子,以此构建临床模型并绘制ROC曲线,在训练集和验证集中AUC分别为0.736、0.731。

训练集及验证集乳腺癌患者临床资料及影像特征比较
Comparison of clinical data and image features of breast cancer patients in training set and validation set
训练集及验证集乳腺癌患者临床资料及影像特征比较
Comparison of clinical data and image features of breast cancer patients in training set and validation set
| 项目 | 训练集(n=190) | 验证集(n=82) | 统计值 | P值 |
|---|---|---|---|---|
| 年龄/岁 | 51.00(45.75,58.00) | 51.50(46.00,55.25) | -0.348① | 0.728 |
| 肿瘤最大径/mm | 25.00(19.00,30.00) | 25.00(18.75,34.00) | -0.386① | 0.699 |
| CEA/(ng·mL-1) | 1.99(1.22,3.18) | 1.65(1.12,2.14) | -2.545① | 0.011 |
| CA153/(U·mL-1) | 9.30(6.70,14.25) | 9.54(5.90,15.38) | -0.532① | 0.595 |
| CA125/(U·mL-1) | 13.05(10.06,18.93) | 11.25(7.77,16.28) | -2.685① | 0.007 |
| Ki-67/% | 40.00(20.00,50.00) | 30.00(20.00,50.00) | -1.188① | 0.235 |
| TIC分型/例 | 0.458② | 0.498 | ||
| Ⅱ | 57 | 28 | ||
| Ⅲ | 133 | 54 | ||
| 有无毛刺/例 | 5.216② | 0.022 | ||
| 有 | 46 | 31 | ||
| 无 | 144 | 51 | ||
| 有无分叶/例 | 2.302② | 0.129 | ||
| 有 | 56 | 32 | ||
| 无 | 134 | 50 | ||
| 是否绝经/例 | 0.305② | 0.581 | ||
| 是 | 88 | 35 | ||
| 否 | 102 | 47 | ||
| 肿瘤位置/例 | 0.134② | 0.714 | ||
| 左侧 | 102 | 46 | ||
| 右侧 | 88 | 36 | ||
| DWI信号强度/例 | 0.059② | 0.809 | ||
| 明显高 | 30 | 12 | ||
| 高/稍高 | 160 | 70 | ||
| 腋窝淋巴结转移/例 | 1.159② | 0.282 | ||
| 有 | 77 | 39 | ||
| 无 | 113 | 43 |
注:CEA为癌胚抗原;CA153为糖类抗原153;CA125为糖类抗原125;TIC为时间-信号强度曲线;DWI为扩散加权成像。①不符合正态分布的计量资料用中位数(上下四分位数)格式表示,组间采用Mann-Whitney U检验;②计数资料以例(%)表示,组间采用χ2检验。
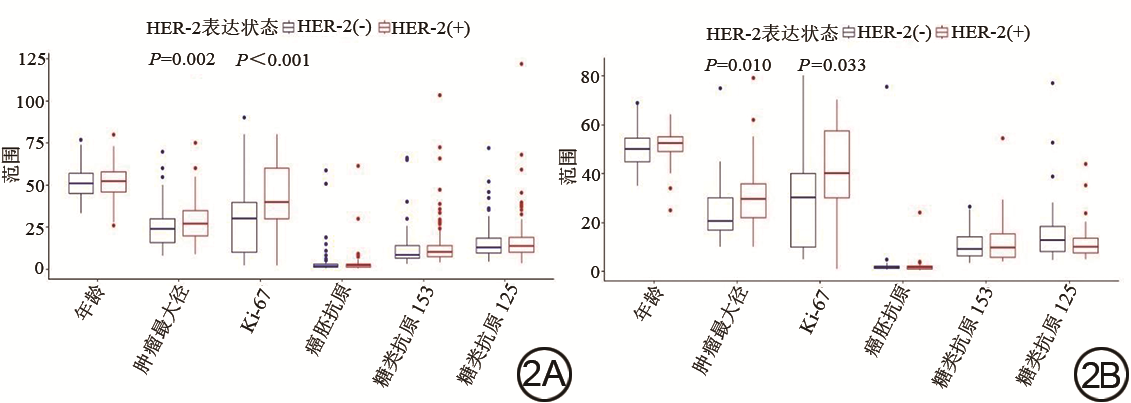

训练集及验证集乳腺癌患者HER-2阳性组和阴性组临床资料及影像特征
Clinical data and image characteristics of breast cancer patients in the HER-2 positive group and the negative group in the training set and validation set
训练集及验证集乳腺癌患者HER-2阳性组和阴性组临床资料及影像特征
Clinical data and image characteristics of breast cancer patients in the HER-2 positive group and the negative group in the training set and validation set
| 项目 | 训练集(n=190) | 统计值 | P值 | 验证集(n=82) | 统计值 | P值 | ||
|---|---|---|---|---|---|---|---|---|
| 阳性组 | 阴性组 | 阳性组 | 阴性组 | |||||
| 年龄/岁 | 52.00(46.00,58.00) | 51.00(45.00,57.00) | -0.264① | 0.729 | 52.5(48.75,55.25) | 50.00(45.00,55.50) | -1.291① | 0.197 |
| 肿瘤最大径/mm | 27.00(20.00,35.00) | 24.00(16.00,30.00) | -3.018① | 0.002 | 29.50(21.75,37.00) | 20.50(17.00,30.00) | -2.578① | 0.010 |
| CEA/(ng·mL-1) | 2.10(1.29,3.26) | 1.94(1.18,2.96) | -1.060① | 0.289 | 1.53(1.07,2.19) | 1.70(1.20,2.13) | -0.700① | 0.484 |
| CA153/(U·mL-1) | 9.98(7.31,14.00) | 8.49(6.50,14.68) | -1.692① | 0.091 | 9.85(5.83,15.63) | 9.18(6.30,14.98) | -0.070① | 0.945 |
| CA125/(U·mL-1) | 13.50(10.10,19.05) | 13.00(9.60,18.65) | -0.379① | 0.705 | 10.00(7.48,13.40) | 12.80(8.13,18.45) | -1.535① | 0.125 |
| TIC分型/例 | 6.950② | 0.008 | 7.944② | 0.005 | ||||
| Ⅱ | 38 | 19 | 20 | 8 | ||||
| Ⅲ | 59 | 74 | 22 | 32 | ||||
| Ki-67/% | 40.00(30.00,60.00) | 30.00(10.00,40.00) | -4.615① | <0.001 | 40.00(30.00,60.00) | 30.00(10.00,40.00) | -2.136① | 0.033 |
| 毛刺/例 | 0.160② | 0.689 | 1.393② | 0.238 | ||||
| 有 | 20 | 26 | 15 | 16 | ||||
| 无 | 77 | 67 | 27 | 24 | ||||
| 分叶/例 | 0.532② | 0.466 | 2.134② | 0.144 | ||||
| 有 | 24 | 32 | 18 | 14 | ||||
| 无 | 73 | 61 | 24 | 26 | ||||
| 是否绝经/例 | 0.858② | 0.354 | 0.364② | 0.546 | ||||
| 是 | 47 | 41 | 20 | 15 | ||||
| 否 | 50 | 52 | 22 | 25 | ||||
| 肿瘤位置/例 | 1.179② | 0.278 | 0.800② | 0.371 | ||||
| 左侧 | 49 | 53 | 26 | 20 | ||||
| 右侧 | 48 | 40 | 16 | 20 | ||||
| DWI信号强度/例 | 1.342② | 0.247 | 2.150② | 0.143 | ||||
| 明显高 | 19 | 11 | 8 | 4 | ||||
| 高/稍高 | 78 | 82 | 34 | 36 | ||||
| 腋窝淋巴结转移/例 | 0.468② | 0.495 | 0.186② | 0.666 | ||||
| 有 | 37 | 40 | 19 | 20 | ||||
| 无 | 60 | 53 | 23 | 20 | ||||
注:CEA为癌胚抗原;CA153为糖类抗原153;CA125为糖类抗原125;TIC为时间-信号强度曲线;DWI为扩散加权成像。①不符合正态分布的计量资料用中位数(上下四分位数)格式表示,组间采用Mann-Whitney U检验;②计数资料以例(%)表示,组间采用χ2检验。
本研究应用FAE软件在272例数据集患者的DCE-MRI第三期图像共提取到瘤内1781个影像组学特征和瘤周1781个影像组学特征,删除瘤内无效特征120个、瘤周无效特征119个,删除组内及组间ICC<0.80的影像组学特征(瘤内36个、瘤周14个),最终剩余瘤内1625个特征、瘤周1648个特征。在训练集中通过PCC、RFE方法分别对瘤内及瘤周影像组学特征进行降维,最终筛选到瘤内10个特征及瘤周10个特征(图3),使用logistics回归作为分类器,并计算每个患者对应的瘤内和瘤周影像组学标签。结果显示,瘤内影像组学模型影像组学标签在训练集的预测效能:AUC=0.784,95% CI为0.720~0.848;在验证集的预测效能:AUC=0.724,95% CI为0.612~0.837。瘤周影像组学模型在训练集的预测效能:AUC=0.806,95% CI为0.743~0.868;在验证集的预测效能:AUC=0.713,95% CI为0.600~0.825。将瘤内及瘤周影像组学标签纳入多因素logistics回归分析,构建瘤内+瘤周影像组学模型(训练集中AUC=0.831,95% CI:0.774~0.887;验证集中AUC=0.780,95% CI:0.678~0.883)(表3、图4)。



临床模型、瘤内影像组学模型、瘤周影像组学模型、瘤内+瘤周模型、联合模型诊断效能
Diagnosis efficacy of the clinical model, intratumoral radiomic model, peritumoral radiomic model, intratumoral+peritumoral model, and combined model
临床模型、瘤内影像组学模型、瘤周影像组学模型、瘤内+瘤周模型、联合模型诊断效能
Diagnosis efficacy of the clinical model, intratumoral radiomic model, peritumoral radiomic model, intratumoral+peritumoral model, and combined model
| 项目 | 训练集(n=190) | 验证集(n=82) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| AUC | 95% CI | 准确度/% | 敏感度/% | 特异度/% | AUC | 95% CI | 准确度/% | 敏感度/% | 特异度/% | |
| 临床模型 | 0.736 | 0.665~0.807 | 69.5 | 87.6 | 50.5 | 0.731 | 0.618~0.844 | 73.2 | 76.2 | 70.0 |
| 瘤内影像组学模型 | 0.784 | 0.720~0.848 | 70.5 | 53.6 | 88.2 | 0.724 | 0.612~0.837 | 70.7 | 61.9 | 80.0 |
| 瘤周影像组学模型 | 0.806 | 0.743~0.868 | 75.8 | 71.1 | 80.6 | 0.713 | 0.600~0.825 | 68.3 | 88.1 | 47.5 |
| 瘤内+瘤周模型 | 0.831 | 0.774~0.887 | 73.7 | 62.9 | 84.9 | 0.780 | 0.678~0.883 | 73.1 | 76.2 | 70.0 |
| 联合模型 | 0.854 | 0.802~0.906 | 76.8 | 72.2 | 81.7 | 0.799 | 0.697~0.901 | 78.0 | 78.6 | 77.5 |
注:AUC为受试者工作特征曲线下面积;CI为置信区间。
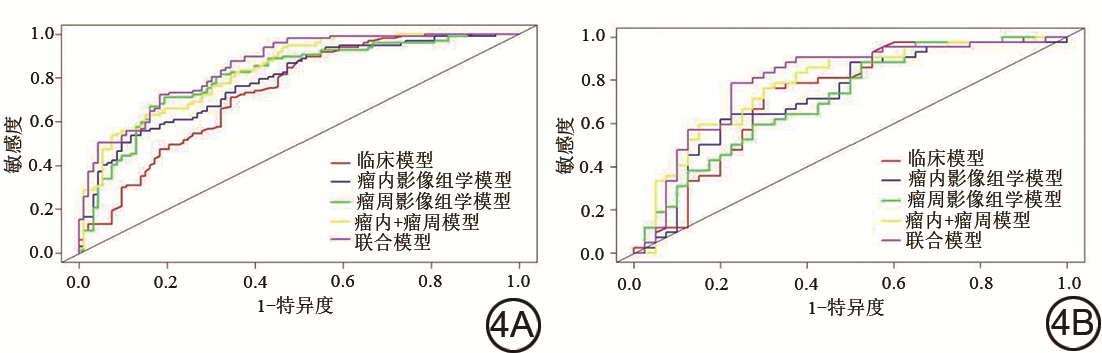

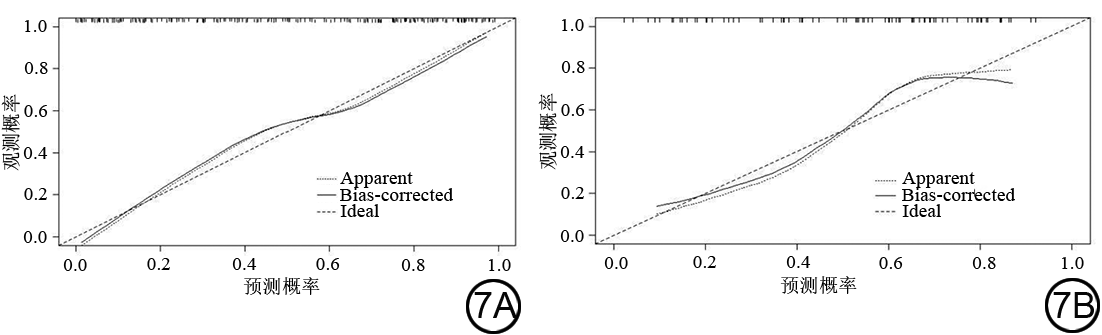
将训练集中有统计学意义的临床指标、影像学特征及瘤内和瘤周影像组学标签纳入多因素logistic 回归分析(图5),纳入的变量有TIC分型(Ⅱ、Ⅲ型)、Ki-67、肿瘤最大径及瘤周和瘤内影像组学标签,其中TIC分型(OR=2.717,P=0.017)、Ki-67(OR=1.029,P=0.002)、瘤内影像组学标签(OR=1.877,P=0.001)及瘤周影像组学标签(OR=2.102,P<0.001)为独立预测因子,建立临床+瘤内+瘤周影像组学联合模型。联合模型在训练集和验证集中的AUC值分别为0.854、0.799,优于临床模型、瘤内影像组学模型、瘤周影像组学模型及瘤内+瘤周模型(表3、图4)。经DeLong检验,训练集中联合模型与临床模型、瘤内影像组学模型、瘤周影像组学模型之间差异有统计学意义(Z=3.660、2.791、2.201,P=0.0003、0.005、0.028),联合模型与瘤内+瘤周模型之间差异无统计学意义(Z=1.583,P=0.114)。因此,对联合模型绘制诺谟图(图6),训练集和验证集的校正曲线均显示了良好的校正性能(图7),Hosmer-Lemeshow检验该模型的拟合优度,得到一个不显著的统计学结果(训练集:χ2=8.924,P=0.349,验证集:χ2=9.282,P=0.319),表明模型未偏离完美的拟合。DCA曲线显示在训练集中风险阈值为13%~60%时联合模型预测乳腺癌患者HER-2表达状态的临床价值优于临床模型、瘤内影像组学模型、瘤周影像组学模型及瘤内+瘤周模型(图8)。





术前如何无创且准确地预测乳腺癌患者HER-2的表达状态对乳腺癌患者的临床治疗有着较为重要的意义。本研究基于DCE-MRI瘤内及瘤周影像组学特征联合临床指标建立的联合模型,用于术前无创预测乳腺癌患者HER-2的表达状态,同时创新性地提出了TIC分型对乳腺癌患者HER-2表达的预测价值,结果显示基于瘤内、瘤周影像组学联合TIC分型及Ki-67建立的联合模型对预测乳腺癌患者HER-2表达状态在训练集和验证集中均表现出较好的预测能力,预测效能高于临床模型、单独瘤内或瘤周影像组学模型及瘤内+瘤周模型,其中诺谟图的构建为临床提供了一个简单、直观地预测HER-2表达的方法,对乳腺癌患者的治疗具有一定的指导作用。
影像组学能够无创地提取数字医学图像中肉眼无法观察到的高维数据,发现感兴趣区内与肿瘤异质性相关的特征,从而可以对肿瘤相关特点进行客观评价[16, 17],大量研究表明影像组学在探究基因组突变方面具有较高的可行性和有效性[18, 19, 20]。由于乳腺癌患者中HER-2基因表达阳性是患者接受抗HER-2基因靶向治疗的重要标志物,其表达状态对临床治疗具有重要的价值[21, 22, 23, 24, 25, 26]。因此,国内外关于乳腺癌患者HER-2表达状态的相关研究有很多,冯海霞等[27]通过体素内不相干运动联合DCE-MRI等定量参数预测乳腺癌患者HER-2表达状态,其预测模型的AUC为0.778,同本研究相比其试验纳入的指标较为单一,对肿瘤本身的评价不够全面可能会导致丢失大量同HER-2表达相关的信息,本研究同时纳入了临床、影像学指标、瘤内及瘤周影像组学特征对病灶的评价,最终联合模型在训练集中的AUC为0.854,验证集中AUC为0.799,模型的预测能力优于冯等研究。张晶等[28]通过表观扩散系数来预测乳腺癌患者HER-2的表达状态,其模型的AUC仅为0.691,其预测能力远远低于本研究构建的联合模型。
MRI在乳腺癌诊断方面具有无创、多功能成像的优点[29, 30, 31, 32],既往研究结果表明DCE-MRI能够反映病灶的形态学及血流动力学特征,并预测乳腺癌的分子亚型及远期预后[23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36]。但目前的影像组学研究很多都是对病灶本身的特征进行分析,研究者常忽略病灶周围的特征。有研究表明,乳腺癌的肿瘤周围区域可能存在一些与肿瘤生物学特征相关的信息,如血管生成、淋巴管和血管的瘤周浸润以及间质反应[37, 38, 39]。此外,有研究发现瘤周区域MRI特征与乳腺癌化疗疗效及局部复发有关,认为乳腺癌在进展过程中会侵犯周围组织,导致瘤周结构重塑[40]。姜原等[41]在鉴别乳腺原位癌和浸润性癌的研究中的结果显示,瘤内模型的AUC为0.865,纳入瘤周影像组学特征的联合模型的AUC达到0.922,优于瘤内模型,表明纳入瘤周区域的MRI特征可以提高模型对乳腺原位癌和浸润性癌的鉴别能力。BRAMAN等[10]研究结果显示基于肿瘤组织的影像组学模型在预测乳腺癌患者HER-2表达状态的模型AUC仅为0.65,将肿瘤周围组织特征纳入联合模型后模型的AUC提高到0.7,表明肿瘤周围可能存在相关特征对乳腺癌患者HER-2表达具有一定的相关性,但与本研究相比其纳入的样本量较小,同时其只考虑了影像组学特征,忽略了临床指标对预测HER-2表达的影响,导致了其模型不够全面,模型的预测效能低于本研究的联合模型。本研究选择在DCE-MRI第三期扫描图像中分割病灶,源于此期病灶强化程度较高,可以较明显地反映病灶血流灌注情况,这与朱永琪等[42]和MAO等[43]使用DCE-MRI峰值时相图预测乳腺癌腋窝淋巴结转移的研究方法相似。BRAMAN等[38]的研究表明将肿瘤周围2.5~5.0 mm的瘤周特征联合瘤内特征可以较好地预测乳腺癌患者治疗的预后。明洁等[44]的研究对乳腺癌患者Ki-67的表达状态进行了预测,结果表明在训练集及验证集中瘤内模型的AUC分别为0.901、0.689,联合瘤周5 mm的周围特征后AUC为0.949、0.862。故本研究参照他们的研究定义瘤周范围,结果表明无论在训练集还是验证集中联合模型的AUC均为最高。
Ki-67是一种双分子蛋白,目前被认为是检测细胞增生活性较理想的标志物,代表了细胞的生长和增殖水平,与乳腺癌的侵袭、转移、早期复发等相关,BOTTINI等[45]的研究表明,Ki-67和HER-2表达呈阳性相关,本研究纳入的Ki-67指标为预测HER-2基因状态的独立预测因子,同上述研究结果相符。俞巍[46]研究同样证实了Ki-67和HER-2表达有关,同时此次研究还探究了肿瘤指标CEA、CA153、CA125等对HER-2的表达状态的关系,最终结果表明肿瘤指标与HER-2表达状态差异无统计学意义,与本研究结果相符。
为了预测HER-2的表达状态,本研究纳入的TIC分为三型:Ⅰ型为流入型,Ⅱ型为平台型,Ⅲ型为流出型。由于表现为TIC Ⅰ型的乳腺病变大多为良性病变,本研究乳腺癌患者TIC Ⅰ型较少,为了防止选择偏倚,因此本研究只纳入了TIC Ⅱ~Ⅲ型进行研究,汤伟军等[47]研究表明TIC分型不仅在对乳腺病变良恶性鉴别中有着重要意义,还与肿瘤微血管密度有关;郝亮等[48]研究表明线样或段样强化有利于预测HER-2阳性,如果加入了TIC分型(Ⅱ型或Ⅲ型)可以进一步提高HER-2的预测效能,但在试验中并未给出相关的数据。本研究表明TIC分型为预测HER-2表达状态的独立预测因子,证明了TIC分型对预测HER-2的表达状态有一定的意义。本研究纳入TIC分型的联合模型的预测效能优于临床模型、瘤内模型、瘤周模型及瘤内+瘤周模型。
本研究存在一定的局限性:第一,本研究为回顾性研究,样本数据是回顾性收集,病理类型为Luminal B型明显多于其他类型,数据存在一定的偏倚;第二,采用手动分割的方式进行勾画感兴趣区,难以避免受到勾画者主观影响;第三,本试验为单中心研究,缺少多中心研究进行验证;第四,本研究选取DCE-MRI第三期图像,主要原因是乳腺癌在第三期强化明显,但是DCE-MRI其他时期可能提供不同的重要信息,将来可进行进一步验证。
综上所述,本研究表明基于临床、瘤内及瘤周影像组学建立的联合模型对预测乳腺癌患者HER-2表达的状态有着较高的价值,可以为临床提供一种较为可靠且无创的预测HER-2表达的工具。同时本研究证实了TIC分型同乳腺癌患者HER-2表达具有一定的相关性。
张成孟, 丁治民, 陈鹏, 等. 基于DCE-MRI瘤内及瘤周影像组学联合TIC分型及Ki-67预测乳腺癌患者HER-2表达[J]. 磁共振成像, 2023, 14(4): 68-75.
ZHANG C M, DING Z M, CHEN P, et al. Prediction of HER-2 expression in breast cancer patients based on DCE-MRI intratumor and peritumoral imaging combined with TIC typing and Ki-67[J]. Chin J Magn Reson Imaging, 2023, 14(4): 68-75.
Medical Emollient Research Project of Red Cross Foundation of China (No. XM_HR_YXFN_2021_05_24); Health Research Project of Anhui Province (No. AHWJ2022b044).
全体作者均声明无利益冲突。



























