
为了解反复腹型过敏性紫癜患儿营养风险及营养不良的发生率,观察通过营养干预后营养不良发生率的变化,探讨营养干预在反复腹型过敏性紫癜患儿的应用价值。
回顾性分析我院2017年至2019年收治的诊断为反复腹型过敏性紫癜患儿90例,按照有无进行营养干预进行分组,2017年1月至2018年5月病例为对照组(n=42),2018年6月至2019年12月的病例为试验组(n=48),在对原发病治疗的基础上,试验组的高营养风险病例采用深度水解奶粉进行营养干预。用STRONGkids营养工具对患儿进行营养风险评估,据评分结果分为高营养风险及中营养风险。所有患儿入院时及出院时用Z评分进行营养不良评估,对入院时及出院时营养不良程度进行比较。
反复腹型过敏性紫癜患儿高营养风险81例(90.0%),中营养风险9例(10.0%)。试验组与对照组入院时中重度营养不良发生率[39.6%(19/48)比40.5%(17/42)]比较差异无统计学意义(P>0.05),出院时对照组中重度营养不良发生率高于试验组[66.7%(28/42)比22.9%(11/48),P<0.05]。
反复腹型过敏性紫癜患儿,因消化道症状重,营养不良发生率高,对高营养风险患儿使用深度水解奶粉进行营养干预,可以避免住院期间医源性营养不良发生。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
过敏性紫癜(Henoch Schonlein purpura,HSP)是儿科常见疾病,是儿童时期常见的小血管炎,可导致多个器官受累,临床表现主要为紫癜、关节肿痛、腹痛、便血、血尿、蛋白尿等。部分患儿表现为反复腹型HSP,腹型HSP患儿常需住院治疗,国外有研究显示,患儿住院期间的营养风险可增加15%~30%[1],但目前HSP营养状况未引起临床医师重视。本文旨在调查初诊的反复腹型HSP患儿住院期间营养不良的发生情况及营养干预的效果。
回顾性分析2017年1月1日至2019年12月30日在云南省第一人民医院儿科住院治疗的诊断反复腹型HSP患儿90例。2017年1月至2018年5月诊断的反复腹型HSP患儿42例为对照组,男26例,女16例;发病年龄最小2岁,2~5岁28例,6~9岁10例,10~14岁4例。2018年6月至2019年12月诊断为反复腹型HSP患儿48例为试验组,男34例,女14例;年龄最小2.4岁,2.4~5岁30例,6~9岁15例,10~14岁3例。两组患儿的性别和年龄差异无统计学意义,具有可比性。
纳入标准:(1)临床表现为皮肤紫癜,血小板计数及凝血功能等相关实验室检查结果正常,符合第8版《诸福棠实用儿科学》中关于HSP的诊断标准[2];(2)以腹痛、便血及呕吐等消化道症状为主要临床表现;(3)初次发病者经常规剂量激素治疗后症状缓解,减量过程中消化道症状复发2次及以上;(4)发病前4周未曾使用过肾上腺糖皮质激素、免疫抑制剂等抑制免疫功能的药物;(5)无肝肾心脑及基础胃肠道疾病者;(6)无严重感染、无免疫功能缺陷;(7)无其他类型风湿免疫性疾病及紫癜性肾炎。
本研究方案经云南省第一人民医院伦理委员会批准同意(批准号:2018WZ16),患儿家属知情同意并签署知情同意书。
患儿入院24 h内由经培训后专业人员采用STRONGkids营养风险筛查工具对入组患儿进行营养风险评估,由4个项目组成[3]:(1)主观临床评估(1分);(2)高危疾病(2分);(3)营养摄入情况(1分);(4)体重下降或不增(1分)。每个项目相加所得总分即为营养风险得分:0分为低风险;1~3分为中度风险;4~5分为高风险。
用年龄、体重作为儿童营养不良评价的主要指标。患儿于入院次日及出院当天晨起空腹排便后着单衫裤称体重(kg),保留小数点后1位。采用年龄别体重为金标准来判断患儿的营养状况,所有符合诊断患儿入院和出院时均进行营养状态评估,并计算Z值,-2<Z<2为正常,-3≤Z≤-2为中度营养不良,Z<-3为重度营养不良[4,5]。
均常规给予口服双嘧达莫片、氯雷他定片,忌异型蛋白饮食治疗;合并有细菌感染的患儿加用抗生素治疗;呕吐、便血明显者暂禁食补液治疗。必要时人免疫球蛋白或激素冲击治疗、免疫抑制剂治疗。所有患儿入院后均忌高蛋白饮食,对照组3例因消化道症状明显需禁食时间长或长期进食较少者,经患儿家属同意加用静脉营养支持治疗。试验组患儿饮食管理上对有高营养风险的44例患儿进食开始即选用深度水解蛋白奶粉,所有病例均能耐受。总热卡按照《中国儿科肠内肠外营养支持临床应用指南》[6]所推荐的各年龄段所需热卡,从总热卡的1/5开始起步,每天增加总量的1/5,5 d加到足量热卡,然后再逐渐过渡到正常饮食。对重度营养不良者,如经济条件允许,则待营养不良症状改善后再停用深度水解蛋白奶粉。
采用SPSS 25.0统计软件包进行数据分析。计数资料以例数、百分比表示,采用卡方检验,P<0.05为差异有统计学意义。
对照组及试验组中、高营养风险的发生比例差异无统计学意义(χ2=0.025,P=0.875)。见表1。
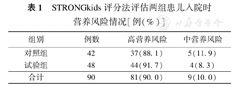
STRONGkids评分法评估两组患儿入院时营养风险情况[例(%)]
STRONGkids评分法评估两组患儿入院时营养风险情况[例(%)]
| 组别 | 例数 | 高营养风险 | 中营养风险 |
|---|---|---|---|
| 对照组 | 42 | 37(88.1) | 5(11.9) |
| 试验组 | 48 | 44(91.7) | 4(8.3) |
| 合计 | 90 | 81(90.0) | 9(10.0) |
两组入院时营养不良发生率差异无统计学意义(χ2=0.443,P>0.05),出院时两组营养不良发生情况差异有统计学意义(χ2=17.891,P<0.001),试验组出院时正常营养患儿比例高于对照组,见表2。对照组出、入院时营养状况比较差异有统计学意义(χ2=6.003,P<0.05),出院时正常营养患儿比例低于入院时。试验组出入院时患儿营养状况差异无统计学意义(χ2=3.752,P=0.153),出院时正常营养患儿比例高于入院时,见表2。
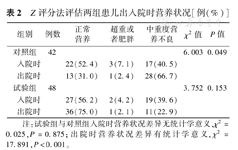
Z评分法评估两组患儿出入院时营养状况[例(%)]
Z评分法评估两组患儿出入院时营养状况[例(%)]
| 组别 | 例数 | 正常营养 | 超重或者肥胖 | 中重度营养不良 | χ2值 | P值 | |
|---|---|---|---|---|---|---|---|
| 对照组 | 42 | 6.003 | 0.049 | ||||
| 入院时 | 22(52.4) | 3(7.1) | 17(40.5) | ||||
| 出院时 | 13(31.0) | 1(2.4) | 28(66.7) | ||||
| 试验组 | 48 | 3.752 | 0.153 | ||||
| 入院时 | 27(56.2) | 2(4.2) | 19(39.6) | ||||
| 出院时 | 36(75.0) | 1(2.1) | 11(22.9) | ||||
注:试验组与对照组入院时营养状况差异无统计学意义,χ2=0.025,P=0.875;出院时营养状况差异有统计学意义,χ2=17.891,P<0.001。
近些年,儿童HSP发病率呈逐年上升趋势,可能与人们饮食结构、生活方式、自然环境、感染因素等变化有关。HSP是全身性血管炎的一种,在儿童中HSP是发病率最高的一种血管炎。本病中腹型HSP占58%~77.8%,18%~52%的患儿可合并消化道出血,短时间内大量出血甚至危及患儿生命[7]。部分患儿腹部症状及皮疹反复发作,且病程长,予抗细菌、抗病毒、抗过敏、糖皮质激素等治疗效果不佳[8]。儿童腹型HSP临床主要表现为腹痛、消化道出血等,肠套叠、肠穿孔是消化道最为严重的并发症,如不及时干预和手术,可能会出现十分严重的后果,甚至危及生命[9]。腹型HSP需激素治疗,病情反复及激素不良反应对患儿生理和心理均可能造成创伤,尤其对于青春期患儿。皮疹、腹痛、便血等症状成为患儿及家属的主要主诉,易引起临床医师的重点关注,而营养不良的发生及HSP患儿营养风险的评估则较少引起患儿家属及临床医师的关注。
早在2005年,欧洲儿科胃肠肝病营养学会提出对入院患儿常规进行营养风险筛查的建议,认为该措施有助于减少或者避免医院内营养不良的发生及发展。有研究显示,15%~30%的住院患儿存在营养不良[10,11]。而本研究对我院近3年诊断的90例反复腹型HSP患儿,入院时用Z评分法计算营养不良发生情况,对照组患儿入院时营养不良占40.5%,试验组患儿营养不良占39.6%,营养不良发生比例较高,可能与腹型HSP患儿消化道症状较重且病程长,导致患儿不愿意进食,医师及家属对营养状况关注度不够等有关。本研究对照组患儿饮食管理中,因过敏原常不能在短时间内明确,故常用限制饮食的治疗以尽可能减少异体蛋白的摄入[12],即予单一饮食,如白米、白面等淀粉类食物,病初忌海鲜鱼虾高蛋白饮食,根据消化道症状缓解情况逐渐少量单一地添加食物。而对于便血或呕血腹型HSP患儿,在病初常予以禁食,目的是避免膳食中变应原刺激致病情加重或反复。有研究显示,饮食限制对HSP患儿的症状消失及降低症状复发的效果明显[13]。有文献报道,住院患者的营养状况在住院期间可能呈进行性恶化的趋势,尤其在入院时即存在营养不良的患者,这种现象更为明显[13]。本研究对照组患儿入院时与出院时营养不良发生情况有明显差异,与文献报道一致。对照组患儿多数营养状态进一步恶化,考虑与限制饮食时间较长,膳食结构不合理,尤其缺乏蛋白质摄入有关。加之在应激时,分解代谢激素如胰高血糖素、肾上腺皮质激素、儿茶酚胺等分泌增加,蛋白质和脂肪分解加速,合成减少,糖异生增加,能量消耗增加,分解代谢大于合成代谢,从而处于负氮平衡及负能量平衡。而对于反复腹型HSP患儿胃肠损伤可能表现更为突出,导致消化吸收面积减少或吸收障碍,患儿营养状况进一步恶化。
HSP的病因仍未明确,大部分研究认为感染及食物不耐受为引起HSP的两大原因,目前越来越多的研究认为儿童HSP的病因和食物不耐受有重要关系[15,16]。在疾病的发展过程中,感染因素、过敏因素等刺激因子会直接作用于具有遗传背景的个体,促使B细胞多克隆扩增,进而导致IgA生成异常引发白细胞碎裂性血管炎[17,18]。过敏性食物对反复腹型HSP的治疗存在影响,多数反复腹型HSP患儿存在多种食物不耐受情况,因此食物特异性IgG阳性率较高,说明食物不耐受在腹型HSP患儿中发挥着重要作用[19]。本研究试验组在饮食管理上,对高营养风险患儿选用了深度水解蛋白奶粉进行营养干预。深度水解蛋白奶粉肽段中95%以上的分子质量低于3 000,致敏性非常低,肠道黏膜受损的患儿可完全吸收,肠道内残留少,不易增加肠道负担[20],并能够帮助维持和改善胃肠屏障功能,能量充足,能量密度可达100 kcal/100 mL,能够满足疾病状况下患儿的高能量需求。试验组有19例患儿选用深度水解蛋白奶粉进行营养干预,所有病例经营养干预后营养状况未进一步恶化,说明对于反复腹型HSP患儿进行营养干预非常有必要。因营养不良除了影响患儿的生长发育外,还会在很大程度上降低患儿的免疫功能及重要脏器功能从而导致病程延长,并发症发生率和病死率增加,延长住院天数,甚至影响预后[21],对于反复腹型HSP患儿可能对普通食物不耐受,导致肠内营养无法顺利进行,选用深度水解蛋白奶粉作为肠内营养制剂,提高了耐受性,有利于患儿营养状况改善及疾病恢复。因此,对住院患儿进行营养风险评估十分有必要,应对高中营养风险患儿进行营养干预。
所有作者均声明不存在利益冲突



























