细菌性角膜炎是常见的感染性角膜炎,多数患者即使治愈后也会有严重的视力损害。由于病原菌耐药性的逐渐增强,现有抗生素对细菌性角膜炎的治疗效果越来越差。面对这一挑战,本文从诊断和治疗的角度将近年来细菌性角膜炎的临床处置经验进行了概述。除对感染灶标本取材、常见培养基和抗生素选择的共识进行了归纳和总结外,还介绍了一种有效且实用的,治疗严重、顽固性眼表感染的眼睑下抗生素持续灌注给药方法。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
目前,全球范围内角膜感染占致盲原因的1/5,细菌性角膜炎是常见的感染性角膜炎,每年约有50万例[1],即使经过治疗也仅有约50%的患者视力可以达到0.3,约25%的患者视力低于0.1[2]。近年来,由于抗生素的广泛应用,病原菌对抗生素的耐药性逐渐增强,因而现有抗生素对细菌性角膜炎的治疗效果越来越差,能够根治感染性角膜炎的抗生素种类也逐渐减少。面对这一新的挑战,本文从诊断和治疗的角度将近年来细菌性角膜炎的临床处置经验进行概述。
细菌性角膜炎的临床症状及表现各异,主要取决于病原菌致病力的强弱,患者眼表的条件、免疫能力以及发病时的用药情况等。某些细菌感染对角膜组织的破坏速度非常快,因而及时确诊并选择有效的药物非常重要。金黄色葡萄球菌、肺炎链球菌、β-溶血性链球菌及铜绿假单胞菌或淋球菌致病力很强,因而发病较快,角膜组织损伤也比较严重。相反,病情较缓且轻的致病菌包括凝固酶阴性的金黄色葡萄球菌属、草绿色链球菌、放线菌属、分枝杆菌、诺卡菌属、莫拉菌属及沙雷菌属。棒状杆菌虽然属于正常结膜表面菌群之一,但在眼表条件恶化时也可以变成致病菌。眼外伤,包括化学伤、烧伤及局部放射创伤等,往往会引起一些少见细菌的角膜感染,如诺卡菌属。眼表麻醉药的持续应用也会破坏角膜上皮完整性而增加感染的风险。有报道表明,吸食可卡因与角膜感染有关,可能与其对角膜上皮及神经的毒性作用有关[3]。眼睑闭合不全导致的角膜暴露也是造成角膜上皮完整性破坏的一个主要原因。在西方国家中佩戴角膜接触镜仍然是常见的细菌性角膜炎的危险因素,以铜绿假单胞菌感染最为常见。佩戴一次性角膜接触镜并不能明显降低感染的发生率,使用持续佩戴的角膜接触镜可使感染的风险增加10倍左右[4]。细菌性角膜炎也是角膜塑形镜常见的严重并发症[5]。眼表疾病可造成泪膜不稳定,也会导致角膜上皮表面黏蛋白的减少,因而使细菌在角膜表面附着而引起感染。角膜移植手术后任何时候都有发生细菌感染的风险,因为这期间常常会伴有上皮愈合不良,慢性干眼、长期使用角膜接触镜、糖皮质激素,以及缝线松弛、暴露或者断裂的情况。分枝杆菌感染在准分子激光角膜屈光手术后比较常见。另外,系统性疾病,如营养不良、糖尿病、胶原血管性自体免疫性疾病等均可以增加眼表微环境的恶化,从而增加角膜感染的机会。
绝大多数细菌造成的角膜感染是因角膜上皮的异常或者缺损引起的。从病理机制的角度看,除细菌的贴附和入侵之外,感染期间经常伴有的炎症反应也是造成角膜基质损伤和影响视力的一个主要因素。细菌性角膜炎可以发生在角膜的任何部位,一般情况下角膜中央的感染预后较差,临床评定的目的是为了找出细菌性角膜炎的易感和促进因素,确定疾病的严重程度和破坏范围,判断可能的致病菌,以便及时采取有效的治疗措施。详尽的病史采集,包括发病时间、可能的诱因、症状的严重程度及发展速度,甚至眼部的既往病史等对于临床诊疗至关重要。裂隙灯显微镜检查应注重以下方面:(1)睑缘 睑板腺功能是否异常,是否有睑缘溃疡、睫毛异常及泪点或泪道堵塞等;(2)泪膜 是否有干眼性泪膜异常、碎屑等;(3)结膜 是否充血、是否有分泌物和膜样渗出,是否有滤泡或乳头样增生、瘢痕或角化变性、异物等;(4)巩膜 是否有炎症、溃疡、结节及缺血等;(5)角膜 是否有上皮缺失、点状角膜斑或水肿,是否有基质浸润、变薄甚至穿孔等。角膜溃疡的部位、大小、形状、深度、性状、颜色和透明性,以及是否有卫星病灶等均应详细记录,角膜内皮的变化及前房的炎症反应程度则更不应忽略。此外,对侧眼的检查往往也能看到类似病变而成为查找病因的线索。
支持细菌性角膜炎诊断的临床表现包括化脓性角膜基质浸润(尤其是大于1 mm的病灶)伴有清晰的边缘水肿及周边基质的白细胞浸润、角膜上皮缺损、前房反应相对较重等。严重的角膜溃疡有以下几个特点:进展迅速、浸润直径大于6 mm、深度超过角膜厚度的1/3、即将或已经穿孔、病变累及巩膜。详细的病史及仔细的裂隙灯显微镜检查虽然可以发现一些体征,但仅凭借角膜溃疡的特点仍难以准确地鉴别致病菌。为了更准确地选择药物,临床辅助检查尤其对那些中央型、严重的、久治不愈以及不典型的角膜溃疡极为重要。
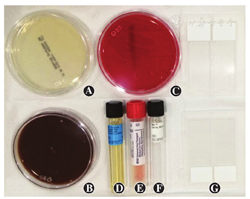
角膜溃疡刮出物培养和涂片是分离致病菌的主要手段,一般是在眼表面麻醉后在裂隙灯显微镜下进行操作。质量分数0.5%盐酸丙美卡因因其抑菌效应低而作为首选表面麻醉药,其他表面麻醉药会明显降低细菌的回收率和检查的阳性率,有时药物中的防腐剂也会影响检出结果。取材时应从感染灶的进展边缘反复刮取组织以获得最高检出率,仅刮取脓性分泌物是不够的。刮取工具包括无菌棉签、刀片、尖镊子和针头等,取材后立即直接接种到培养皿表面或培养液中。获取的样本最少应制备2张涂片,用于基本的革兰和吉姆萨染色。革兰染色最适用于细菌种类的鉴别,但也可以显示真菌及阿米巴,而吉姆萨染色则适合鉴别细菌、真菌、衣原体及阿米巴。总体上,通过病原检查成功鉴定病原菌的机会约为50%。眼科门诊应该常备的基本培养基及其适用范围见图1及表1。

眼科门诊必备的基本培养基
眼科门诊必备的基本培养基
| 培养基 | 用途 |
|---|---|
| 血琼脂培养皿 | 需氧菌a,厌氧菌a,分枝杆菌,真菌,阿米巴 |
| 巧克力琼脂培养皿 | 需氧菌a,厌氧菌 |
| Thioglycollate培养液 | 需氧菌a,厌氧菌a |
| Sabouraud琼脂培养皿 | 真菌a |
| 病毒转输培养基 | 病毒a,支原体a |
注:a:最适用途

早期治疗效果不理想,尤其是最初培养结果是阴性时有必要重复培养甚至行角膜病灶活检,检查前应先停用抗生素12~24 h,这样可增加检出的阳性率。角膜深基质的活检可用2~3 mm的环钻直接取样,也可用7-0或8-0线由针引导穿过深部溃疡部位(但如果表浅组织仍完整,则无需破坏),然后对缝线上带出的致病菌样本进行培养。检出的阳性菌应做药敏试验,对进一步的临床治疗有极大的指导意义。最小抑菌浓度指标能较好地反映组织中有效的药物抑菌浓度,因而比其他检查结果更为准确和实用。
致病菌培养结果至少需要24~48 h,因而快速且准确的诊断方法是今后应该研究和发掘的目标。激光扫描共焦显微镜对细菌感染的诊断价值虽然较低,但可用于活体组织内的直接检查,有经验的操作者对真菌或阿米巴诊断的敏感性和特异性分别可达到50%和80%[6],对排除细菌感染有临床指导意义。PCR技术在感染性角膜炎病原菌鉴定中的应用已日渐成熟,4~8 h内即可得到鉴定结果,且理论上该鉴定方法不受取材时是否曾用抗生素的影响。在1项以致病菌培养为金标准的前瞻性非随机细菌性角膜炎的研究中,与常规致病菌培养和涂片相比,PCR技术优于涂片,与致病菌培养方法得到的结果相当,是一个很有前途的辅助检测手段[7]。但目前PCR技术在临床应用方面仍需很长时间的努力。利用生物工程技术做直接抗原免疫鉴定理论上可行,但距离达到临床实用标准仍相差甚远。
感染性角膜炎的基本治疗原则为根除感染、纠正致病危险因素、最大限度降低损伤和促进组织修复。在得知致病菌之前,眼科医生通常根据经验来选择抗生素。一般对于直径≤2 mm的周边性角膜溃疡选择1种广谱抗生素滴眼液频繁点眼,以达到治疗效果,对于严重的、威胁视力的角膜溃疡给药前应尽可能获取病灶标本进行涂片或培养及药敏试验,确定最有效的抗生素药物,然后再根据角膜溃疡对初期药物治疗的反应以及药敏试验的结果调整治疗药物,以达到最快、最好的临床治疗效果。
临床上首选的广谱抗生素是氟喹诺酮类,尤其是第4代氟喹诺酮,如加替沙星或莫西沙星,这类抗生素在人角膜组织有很好的药物动力学特性,局部用药后在溃疡部位可以达到较高的药物浓度。但是至今由于该类抗生素在农牧业以及医学其他专业的广泛应用,其杀菌效果已经受到挑战。氟喹诺酮家族的最新成员是贝西沙星,是为专用滴眼液而开发的,因此不曾在农牧业以及医学其他领域应用过,环境中产生耐药菌的机会极小。贝西沙星的优点还包括其广谱性,可以抗革兰阳性菌、革兰阴性菌和厌氧菌,甚至可用于甲氧西林耐受性金黄色葡萄球菌(methicillin-resistant Staphylococci aureus,MRSA)和甲氧西林耐受性表皮葡球菌(methicillin-resistant Staphylococci epidermidis,MRSE)感染[8]。尽管如此,目前临床上我们仍不应忽视头孢菌素和氨基糖苷类抗生素的作用。这两类抗生素虽有商用滴眼液,但用药后在人角膜组织中的药物动力学特性不如氟喹诺酮类抗生素。所幸这2种抗生素在应用时都可以人为配置成强化药效的高质量浓度滴眼液,能够弥补其药物动力学特性方面的不足。在有MRSA或MRSE感染时,万古霉素是首选药物,因为这类致病菌对上述许多抗生素均有耐药性。氟喹诺酮对分枝杆菌的疗效也有限,对这类致病菌的治疗要使用强化药效的高质量浓度的阿米卡星或克拉霉素。值得强调的是,这些致病菌生长缓慢,即使在治疗过程中它们也会产生耐药性,因而需要对所用药物进行及时调整,甚至包括使用更新一类的抗生素,如利奈唑胺。任何缓慢生长的致病菌都可能发生这种耐药情况,因而在疗效不佳的情况下对溃疡部位重新做刮片培养很有必要。目前的基本用药原则是,中央部位、累及角膜基质并伴有基质坏死或前房积脓的角膜溃疡应该首选第4代氟喹诺酮,再根据所判断的致病菌联合应用1种强化的高质量浓度的头孢菌素或氨基糖苷类抗生素;也可以直接从头孢菌素和氨基糖苷类各取1种混合使用。目前常用的强化高质量浓度抗生素见表2,常用的药物组合方式为从覆盖革兰阳性菌(头孢唑林,万古霉素)及革兰阴性菌的抗生素(妥布霉素、庆大霉素)中各选1种联合使用。头孢他啶属第3代头孢菌素,对某些革兰阳性菌和铜绿假单胞菌有效,常用于对氨基糖苷及氟喹诺酮耐药的铜绿假单胞菌感染。强化的高质量浓度抗菌素的常见应用方式为频繁点眼,可每30分钟~1小时点眼1次,临床症状改善时再减少点眼频度,可以细菌培养及药敏试验提供更明确的治疗指导方案。

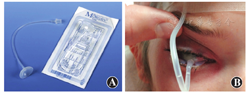
常用的首选强化的高质量浓度抗生素及其质量浓度
常用的首选强化的高质量浓度抗生素及其质量浓度
| 抗生素 | 质量浓度 |
|---|---|
| 头孢唑林或头孢他啶 | 50 mg/ml |
| 妥布霉素或庆大霉素 | 14 mg/ml |
| 万古霉素 | 15 mg/ml,25 mg/ml,50 mg/ml |
| 阿米卡星 | 40 mg/ml |
初选的抗生素药物治疗是否有效一般至少要24 h以后方能做出判断,有时由于感染严重,用药48 h后病情仍不见好转,应考虑其他病原微生物感染的可能,有必要重新刮取溃疡边缘组织进行培养,同时应考虑进一步增加感染组织中的有效药物浓度,同时将点眼频率增至每10~15 min 1滴,但临床上这种用药方法不宜持久。有报道提到上眼睑结膜囊内留置输液管做抗生素的眼表连续灌注可达到控制顽固性感染的效果[9],但全层切开上眼睑,对眼睑组织创伤较大,会遗留瘢痕,甚至影响提上睑肌功能。近几年,我们尝试用摩根镜置于双眼睑下进行抗生素持续灌注给药的方法治疗严重、顽固性的眼表感染,包括铜绿假单胞菌角膜炎,收到了很好的效果[10]。摩根镜常是用于眼表异物冲洗或眼表酸碱化学伤后盥洗的装置[11],美国绝大多数急诊室都有备用,其形状类似一个反置的漏斗,尖端连接输液管,放置容易且无需手术,节省人工,给药速度可通过输液泵进行调节,易普及和应用(图2)。从目前的临床经验看,应用该镜15 d以内尚未见不良反应发生。通过输液管可在不同时间段采用不同药物进行治疗,有望完全覆盖可能的致病菌。除了增加给药浓度外,利用摩根镜持续灌注还能不断冲掉坏死组织,可能会有预防或破坏致病菌产生的生物膜的作用。生物膜的形成往往会阻断抗生素与致病菌的接触,影响药物的杀菌效果。如果感染已造成角膜穿孔,直径小于2 mm的穿孔可用氰基丙烯酸酯组织胶加绷带镜修补,以暂时维持眼球的完整性。因为感染中的角膜炎症严重,此时紧急实施角膜移植术排斥率很高,应尽量避免。待感染得到根治,炎症明显控制后再择期行角膜移植术治疗角膜白斑,以增加角膜植片成活率。3 mm以上的角膜穿孔需要行羊膜、结膜下筋膜或结膜瓣修补术,手术若不成功则行紧急角膜移植术。因为新鲜供体角膜来源不易,进行紧急角膜移植时最好采用在乙醇或甘油内长期保存的非活性角膜植片。手术中切除的组织要送病理检查复核,术后要继续治疗并且密切观察感染复发的迹象。