
近年来,基于扫频光相干断层扫描(SS-OCT)技术的光学生物测量仪开始应用于眼科临床。在测量白内障患者术前眼部生物参数方面,与之前的光学生物测量仪相比,SS-OCT光学测量仪测量速度更快,结果更准确,检出率更高,并内置更多人工晶状体(IOL)计算公式,OCT图像具有检出黄斑病变、预测术后IOL倾斜等诸多优势。本文主要就SS-OCT生物测量仪的工作原理、重复性和再现性评价、与其他设备的一致性对比及其在白内障其他方面的应用等研究进行介绍。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
随着相关设备的不断更新、手术技术的不断提高和各种功能性人工晶状体(intraocular lens,IOL)的不断推出,白内障手术已转变为屈光性手术,术前精准的眼生物参数测量对于达到理想的术后屈光状态至关重要[1]。1999年,第一台光学生物测量仪Carl Zeiss IOLMaster面市,因其在眼生物参数测量的准确性和便捷性方面的优势得以广泛应用,从此眼部生物测量从超声测量时代进入了光学生物测量时代[2,3,4]。目前,各类光学生物测量仪已广泛应用于临床,主要采用的测量技术包括部分相干干涉(partial coherence interferometry,PCI),如Carl Zeiss IOLMaster 500和Nidek AL-Scan;光学低相干反射(optical low-coherence reflectometry,OLCR),如Haag-Streit Lenstar LS 900和Suoer SW-9000;光学低相干干涉(optical low-coherence interferometry,OLCI),如Topcon Aladdin。这些仪器都能比较准确地测量眼轴长度(axial length,AL)、前房深度(anterior chamber depth,ACD)、角膜曲率(keratometry readings,K)、晶状体厚度(lens thickness,LT)和白到白角膜直径(white-to-white distance,WTW)等眼生物参数[5]。然而,由于测量时难以客观判断患者是否固视,影响参数测量准确性而导致IOL度数计算误差,从而影响术后效果。近年来,基于扫频光相干断层扫描(swept-source optical coherence tomography,SS-OCT)技术的生物测量仪开始应用于临床,以其更长的扫频光波长和更强的穿透性提高了混浊晶状体患者AL测量的检出率[6,7],同时可以监测被检眼的眼位,从而提高了测量的准确性[8,9]。目前,SS-OCT生物测量仪主要有德国Carl Zeiss IOLMaster 700和日本Tomey OA-2000,本文主要就SS-OCT的基本原理和相关临床研究进展进行介绍。
OCT是将光纤技术、光电探测技术与计算机处理技术等有机结合的一种医学成像技术,保持了计算机扫描的高分辨率,同时避免了辐射,可以实时、无损地获取活体眼组织显微结构乃至功能信息。近二十年来,从最初的时域OCT(time domain OCT,TD-OCT)到基于傅里叶探测的频域OCT(frequency domain OCT,FD-OCT),从传统的谱域OCT(spectral domain OCT,SD-OCT)再到最新一代的SS-OCT,这一技术得到了迅速发展和广泛应用。不同于采用低相干光源的TD-OCT和FD-OCT,SS-OCT采用输出波长随时间高速扫描的扫频光源,具有高扫频速度、窄瞬时线宽、高输出功率、宽扫频范围以及线性频率扫描的特点。使用快速可调谐激光器实现干涉光谱信号探测,成像速度和信噪比均有极大提高。
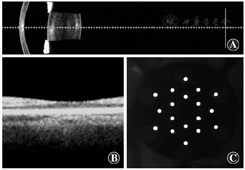
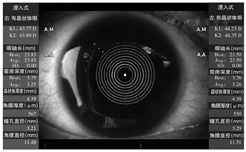
目前,应用于白内障检查和IOL预测方面的SS-OCT生物测量仪设备主要是IOLMaster 700和OA-2000。IOLMaster 700扫频光源波长为1 055 nm,扫描深度为44 mm,眼前节和视网膜扫描宽度分别为6 mm和1 mm,组织分辨率为22 μm[10];测量时发出的激光以2 000次/s的速度从6个不同方向(0°、30°、60°、90°、120°、150°)进行平面扫描,实现了从角膜顶点至视网膜的全眼轴长可视化测量,还可以截取视网膜的OCT图像以确认固视。OA-2000扫频光源波长为1 060 nm[11],扫描速度为1 000次/s,也具有较强的穿透性和较高的信噪比。IOLMaster 700角膜曲率的测量采用远心光学技术保证测量位置不受操作时对焦准确性的影响,3环(直径1.5、2.5和3.5 mm)18点的测量模式进一步提高了测量准确性和一致性(图1)。OA-2000在SS-OCT基础上,采用Placio盘角膜地形图技术测量角膜曲率,可获得直径2.5 mm、3.0 mm的角膜曲率;除了测量一系列眼部生物参数,如AL、K1和K2、ACD、LT、WTW、瞳孔直径(pupil distance,PD)和中央角膜厚度(central corneal thickness,CCT)外,其还可以绘制角膜地形图,具有角膜地形图仪的功能(图2)。在内置IOL屈光度计算公式方面,IOLMaster 700在SRK-T、Hoffer Q、Holladay2、Haigis以及Haigis-L公式基础上,新增了Haigis-T公式,即将内置Barrett公式组(Barrett Universal Ⅱ、Barrett Toric、Barrett True-K)。OA-2000上述公式均有内置。


由于IOLMaster 500和OA-2000临床应用时间不长,尚无这2种SS-OCT光学生物测量仪之间的对比研究。下面分别就这2种设备各自的重复性和再现性及其与其他生物测量仪一致性的对比研究进行介绍。
重复性和再现性是评价仪器精密度的重要指标。重复性是指同一检查者利用同一设备,对同一组病例进行多次测量的测量值之间的差异;再现性是指不同的检查者利用同一设备,对同一组病例进行测量的测量值之间的差异。Ferrer-Blasco等[9]用IOLMaster 700测量了30眼健康眼的生物学参数,每位受试者测量5次评估其重复性,结果显示AL、ACD、CCT、LT、WTW、K1和K2的重复性限分别为0.03、0.07、0.004、0.11、0.20、0.06和0.05 mm,其中AL的结果变异系数最小,LT的结果变异系数最大,所有眼生物参数都具有较好的重复性。Garza-Leon等[12]的一项前瞻性横断面研究使用IOLMaster 700对45眼健康眼分别进行了3次测定,用变异系数(coefficient of variation,CoV)、组内标准差(within subject standard deviation,Sw)和组内相关系数(intraclass correlation coefficient,ICC)对再现性进行评价,结果显示平坦K值(flat keratometry,Kf)、陡峭K(steep keratometry,Ks)值、CCT、AL、ACD、AD、LT和WTW等参数均有很高的再现性,每次测量的CoV为0.3%~1%,ICC高于0.87。Huang等[11]用OA-2000测量健康右眼65眼,所测得的AL、Kf、Ks、Km、ACD、LT、CCT和角膜直径重复性好,CoV均小于1.11%,且ICC均大于0.96;再现性测量中,CoV均小于0.55%,而ICC接近1。此外,Hua等[13]和Wang等[14]对OA-2000的研究结果相同。这些研究都表明了SS-OCT在眼生物学参数测量方面的优势。
调节时LT增加,尤其是晶状体前表面前凸会导致ACD变浅,从而影响IOL度数预测。Ferrer-Blasco等[15]采用IOLMaster 700比较注视生物测量仪目标(有调节)和注视0 D聚散度外部目标(无调节)2种状态下的测量结果,显示调节时ACD减少20 μm,LT增厚30 μm,差异均有统计学意义(均P<0.05);调节状态下ACD和LT改变呈线性相关(R2=0.91),但二者的变化所引起IOL度数计算和术后屈光度的改变均低于0.25 D,没有明显的临床意义。Esteve-Taboada等[16]采用IOLMaster 700对7例26~41岁的受试者在不同调节状态下(0.00、1.50和3.00 D)进行眼生物学参数测量,结果显示ACD和LT的变化差异均有统计学意义,且二者具有高度相关性(R2≥0.99),每调节1 D,ACD减小(0.052±0.011)mm,LT增厚(0.057±0.011)mm。Schachar等[17]采用IOLMaster 700对10名20~26岁的健康受试者进行研究,调节7.8 D(6.6~9.7 D)时ACD减小-0.4~110 μm,平均减小67 μm;LT增厚100~130 μm,平均增厚117 μm;晶状体前表面变陡大于后表面。Grzybowski等[18]采用IOLMaster 700探讨药物性扩瞳对测量值的影响,对受试者右眼采用质量分数4%毛果芸香碱缩瞳,继而采用质量分数10%去氧肾上腺素扩瞳,测得LT平均变化量为(81±54)μm,ACD平均变化量为(-145±86)μm,平均屈光调节变化量为(-12.45±3.45)D,LT与调节幅度密切有关,在调节过程中晶状体位置不变。以上研究说明,利用SS-OCT可以对调节引起的变化进行精确测量,调节越强则AL和LT变化越大;提示临床上进行眼生物学参数测量时不能忽视调节的影响,不要用扩瞳和缩瞳滴眼液,尤其对于年轻白内障患者,以免导致测量误差。
IOLMaster 500是基于PCI技术的光学生物测量仪,不能测量CCT和LT。研究表明,SS-OCT光学生物测量仪与IOLMaster 500在测量生物学参数时具有较好的一致性[11,13,19,20]。然而,SS-OCT对明显后囊下混浊和重度核性白内障患者的检出率高于IOLMaster 500。Akman等[6]分别用IOLMaster 500和IOLMaster 700测量白内障患者188眼的AL、ACD、K1和K2的ICC分别为1.000、0.920、0.992和0.989,一致性较好;尽管预测IOL度数差异无统计学意义,但二者AL的检出率分别为90.96%和100%。Srivannaboon等[21]的前瞻性对照研究也得到了类似结果。同样对1 226眼白内障患眼的大样本研究指出,IOLMaster 700 AL的检出率为99.5%,高于IOLMaster 500的93.6%[22]。Reitblat等[7]将IOLMaster 500未检测出的301例白内障患者再用OA-2000测量,结果284例检出AL。对于重度白内障,接触浸润式A型超声也可以测量出AL,但容易引起角膜损伤和感染,而非接触式SS-OCT生物测量仪检出率高,测量准确,无角膜损伤的风险。因此,SS-OCT光学生物测量仪对重度和后囊下混浊白内障的IOL预测有明显优势。但对于极重度白内障,SS-OCT光学生物测量仪仍存在一定的局限性,需要A型超声辅助检查。
Lenstar 900是基于OLCR原理的光学生物测量仪。Arriola-Villalobos等[23]采用Lenstar 900和IOLMaster 700测量AL、ACD、K、LT和CCT,仅AL和ACD差异有统计学意义,但无临床意义,不会引起预测IOL度数的差异,二者一致性较好。Arriola-Villalobos等[24]研究表明,Lenstar 900与IOLMaster 700使用Holiday 2公式预测IOL度数无差异,而使用SRK/T公式时存在0.05 D的差异,且差异有统计学意义,但二者仍具有较好的一致性。在白内障检测方面,Lenstar 900的检出率为87.5%[24],IOLMaster 700的检出率≥96%[24,25]。Reitblat等[7]研究表明,OA-2000、IOLmaster 500和Lenstar-LS900测量结果的一致性较好,AL、ACD和Km的ICC分别为1.000、0.970和0.998,平均球镜预测误差相似,为0.25~0.29 D,差异无统计学意义。在预测术后散光方面,OA-2000逆规散光预测精准性更高,术后逆规散光仅为(0.06±0.59)D @13.4°,低于IOLmaster 500和Lenstar-LS900的(0.20±0.61)D @14.8和(0.16±0.55)D @ 21.4,差异均有统计学意义(P<0.001)。上述研究均表明,SS-OCT光学生物测量仪和Lenstar 900在眼生物参数测量中一致性较好,但前者测量结果更精确,白内障AL的检出率更高。OA-2000在预测散光时逆规散光的误差可能更小。
Aladdin为基于OLCI技术的光学生物测量仪,Aladdin测量AL、K和LT时与IOLMaster 700有良好的一致性,ICC分别为1.000、0.970和0.952,2种仪器ACD和CCT测量值比较差异均有统计学意义,ICC分别为0.994和0.938,但仍具有较好的相关性;Aladdin在白内障测量中检出率为96.36%,IOLMaster 700的检出率为100%[26]。同样地,McAlinden等[27]对377眼白内障眼进行检测时,Aladdin的检出率为86.47%,远低于OA-2000的100%,但二者之间测量参数一致性仍较好。
瑞士Ziemer Galilei G6同样是基于OLCI技术的光学生物测量仪,联合了双旋转Scheimpflug相机和Placido环地形图仪。Jung等[28]测量54例101眼白内障患者的生物参数,除WTW外,IOLMaster 700测量的重复性均优于Galilei G6;虽然Kf和平均K值差异均有统计学意义,但不具备显著的临床意义,2种仪器CCT测量值比较差异有统计学意义,其他参数比较差异均无统计学意义;使用SRK/T公式预测IOL度数,IOLMaster 700误差在0.50 D以内的概率为85%,而Galilei G6为80%,两者的检出率分别为99.1%和93.1%。除CCT外,2种仪器其余参数的测量值均具有较好的一致性,但在预测IOL度数和重度混浊白内障中,IOLMaster 700表现更佳。
角膜总散光由角膜前表面散光和角膜后表面散光组成,忽略白内障患者的角膜后表面散光而植入散光矫正型IOL会导致散光过矫或欠矫[29]。LaHood等[30]首先报道1 098例IOLMaster 700测量角膜前后表面散光的大小和轴向,进行亚组分析后发现角膜散光特征与角膜前表面散光相关,即随着年龄的增长,角膜前表面散光陡峭轴在垂直方向的情况越来越少见,而角膜后表面散光的陡峭轴仍然多位于垂直方向。研究显示,平均角膜后表面散光为(0.24±0.15)D,且陡峭轴处于垂直方向的比例为73.32%;当角膜前表面散光陡峭轴位于垂直方向时,角膜前后表面散光的相关性较好(r=0.68)。对于角膜后表面曲率检查,Scheimpflug原理的设备更有优势,Klijn等[31]和Miyake等[32]采用Oculus Pentacam HR测量的角膜后表面散光高于IOLMaster 700的测量值。IOLMaster 700测量角膜后表面散光功能尚需要在国内注册软件升级后才能实现。
术后良好的视觉质量,除了精准的IOL度数测量和计算外,预测术后IOL倾斜度和方向也非常重要。Hirnschall等[33]采用IOLMaster700对62例白内障患者分别在术前1周和术后2个月测量晶状体倾斜的相关参数,结果显示手术前后晶状体倾斜的度数之间存在较弱的相关性(R=0.37),而晶状体倾斜方向之间存在较好的相关性(R=0.70),这有助于临床医师个性化选择IOL,并对日后精确计算IOL倾斜程度提供了基础。同样对于是否选择植入非球面、Toric和多焦点IOL有较大的临床意义。
由于白内障患者混浊的晶状体影响眼底的观察,因此难以对预后进行准确判断。IOLMaster 700在可视化测量的同时提供宽度1 mm的黄斑区结构断层图像,有助于观察黄斑区是否异常,以便进一步行HD-OCT检查。Hirnschall等[34]研究表明,IOLMaster 700测量黄斑病变的灵敏度为42%~68%,特异性为89%~98%,不同人员测量的再现性为88.3%。虽然IOLMaster 700能鉴别黄斑病变,尤其是视网膜积液和黄斑裂孔,可以作为黄斑评估的辅助手段,但其组织分辨率较低,为2 μm,目前尚不能替代黄斑OCT[35,36]。OA-2000设计的重点是生物测量,其OCT图像分辨率较低而不足以发现黄斑病变。
目前,临床上白内障晶状体混浊程度分级方法有基于主观判断的LOCS Ⅲ分级、双通道客观视觉质量分析仪的客观散射指数值分级等。IOLMaster 700可进行客观的白内障分级测量,有助于手术时机的选择,其原理是将SS-OCT获得的晶状体二维图像进行密度分析,评价晶状体平均密度,以82.9像素单元为区分白内障与否的界限,此时灵敏度和特异性最佳,分别为73.9%和91.2%。该测量方法有较好的重复性和可靠性,且与已存在的客观测量方法之间有较好一致性,与LOCS Ⅲ之间有低相关性,原因是LOCS Ⅲ为主观判断,存在较大偏差[37]。
SS-OCT光学生物测量仪具有快速、精确地测量眼生物学参数的优势,测量结果有较好的重复性和再现性,部分设备通过观察视网膜黄斑区OCT图像确认固视状态,从而客观判断生物测量的准确性,可以提供CCT和LT参数。扫频光源波长更长,穿透力更强,对严重混浊白内障AL的检出率更高,有更多、更新的IOL计算公式,提高了IOL度数预测的准确性。OCT图像可以检出黄斑病变,预测术后IOL倾斜,有助于评判术后效果及选择IOL植入类型,保证屈光性白内障手术的效果。随着相关临床研究的深入和硬件、软件的升级,如角膜后表面测量软件及IOL计算公式软件的升级,SS-OCT生物测量仪在眼科临床的应用将会更加广泛。



























