版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
德国医生Grüntzig于1977年9月16日在瑞士苏黎世大学医院实施首例经皮冠状动脉腔内血管成形术(percutaneous transluminal coronary angioplasty,PTCA),开创了冠心病介入治疗的新时代(图1),此后经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)领域迅速发展,不断革新、进步,使之成为与药物治疗、冠状动脉旁路移植术并驾齐驱的冠心病三大治疗手段之一。器械方面,从球囊到支架、从金属裸支架到药物涂层支架、从永久残留到可完全吸收甚至无植入物理念;适应证方面,从简单病变到分叉病变、左主干病变、慢性完全闭塞病变;诊断手段方面,从单纯造影到腔内影像到功能学评估。可以说,冠状动脉介入的革命从未停歇,而在这40多年间,中国的冠状动脉介入也从无到有,从有到精,从模仿到创新,从引进到发扬光大、精益求精,逐渐与世界同步,甚至在某些领域已经取得了举世瞩目的成就。在此我们全面回顾我国PCI发展历程以及我国心血管病专家为冠心病介入事业做出的卓越贡献,并展望此领域的最新研究成果和前沿发展趋势。

国内冠心病介入诊断及治疗的起步和发展离不开陈灏珠院士、高润霖院士、朱国英教授、贾国良教授等一大批常年奋斗在心血管领域的拓荒专家学者对推动中国介入心脏病学发展做出的重要贡献(图2)。


冠状动脉造影术选择性地将造影剂注入冠状动脉,记录显影过程,可了解冠状动脉起源和分布、解剖和功能异常,目前仍然为诊断"冠心病"的金标准。复旦大学附属中山医院陈灏珠院士于1973年4月23日成功施行国内首例经皮穿刺股动脉选择性冠状动脉造影术。同年6月,北京、广州也相继开展选择性冠状动脉造影术。此后,冠心病介入性诊断在国内逐步开展并推广。1985年第四军医大学西京医院郑笑莲教授在国内首次独立开展PTCA,开创了我国冠心病介入治疗的时代。从1987年开始,中国医学科学院阜外医院、复旦大学附属中山医院、北京大学第一医院相继开展了PTCA的治疗。
总体来看,中国冠心病介入治疗在40多年间历经了3个主要发展阶段:最初20年的起步阶段,我国引进并陆续开展冠心病介入治疗技术,但当时全国开展的PTCA总数不及现在一个中心1年完成的例数;之后的10年,我国冠心病介入治疗进入蓬勃发展阶段,冠心病介入治疗相关技术趋于成熟,器械的使用更加方便、安全、有效,随着支架的使用,介入治疗并发症大大减少,且目前国内能够实施PCI的医院已由最初的几家、几十家发展到数百家,有10~20倍增长;最近的10年间我国冠心病介入治疗突飞猛进,不断完善,介入治疗数量与质量齐头并进,器械的发展、尤其是药物洗脱支架的广泛使用,使PCI治疗效果更佳,近期与远期疗效得到很大改善。
心血管介入治疗学习周期长,对术者的技术水平要求高,而由于我国地域宽广,经济发展不平衡,不同省份、不同地区的PCI无论是数量还是质量均存在很大的差异。为尽量缩小各地区介入领域发展的不平衡现状,并规范心血管疾病介入诊疗技术临床应用,保证医疗质量和医疗安全,有效整合各种医疗资源,在过去的10年间,国家开始着手对冠心病介入治疗技术的应用进行管理,并取得了初步的成绩。原国家卫生部于2007年7月13日颁布了《心血管疾病介入诊疗技术管理规范》,对心血管疾病介入诊疗技术实行培训、准入和质控制度。首先,坚持培训制度:建立一定数量的培训基地,基地设有专门培训的导师,并制定培训教程及考核评估制度;其次,建立准入制度:设立介入医师准入标准、准入考试及准入后认证体系;最后,建立质控制度:建立质控体系及网络,加强介入治疗的质控作用。同时,建立了实时上传更新的全国冠心病介入治疗注册数据库,从国家层面为我国PCI的良好发展奠定政策基础。
与传统的经股动脉穿刺途径相比,经桡动脉、经尺动脉穿刺途经可极大地降低穿刺相关并发症发生率,避免了股动脉穿刺相关的大出血、血肿、动脉瘤、动静脉瘘等发生,并可使患者无需卧床、恢复更快,减少患者痛苦,对股动脉或髂动脉狭窄、闭塞、过度迂曲或穿刺失败的患者可提供良好的替代路径。1989年Campeau医生[1]首次完成经桡动脉造影,1992年Kiemeneij和Laarman医生[2]首次报道经桡动脉PCI治疗并取得成功(图3,图4)。我国经桡动脉途径诊断及介入治疗具有起步相对晚、发展迅速、覆盖广的特点。1996年笔者在南京完成国内首例经桡动脉冠状动脉介入治疗,2000年笔者在复旦大学附属中山医院实施了国内首例门诊经桡动脉冠状动脉造影术,适用于单纯冠状动脉造影或者PCI术后复查患者;2001年傅向华教授在我国率先开展了尺动脉入径作为桡动脉入径备选血管的可行性和安全性研究。




根据2017年中国大陆冠心病介入治疗注册数据显示,自2012年我国经桡动脉介入治疗比例达到82.35%,此后稳步增长,2017年达到90.89%,有些冠状动脉介入中心甚至达到95%以上。但在欧美国家,经桡动脉路径PCI开展尚不普遍(约50 % )。此外,我国心脏介入医生在经桡动脉急危重症及复杂冠状动脉病变介入治疗、桡动脉保护及避免桡动脉内膜损伤和术后闭塞、桡动脉路径拓展包括经尺动脉、肱动脉入路以及桡动脉血管变异等方面积累了丰富的经验,可以说,我国经桡动脉冠状动脉介入影像诊断及介入治疗技术目前已经走在欧美国家前列,形成了PCI领域的中国特色。
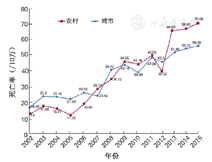
尽管冠心病PCI治疗得到了快速发展,但对于ST段抬高型心肌梗死(ST-segment elevation myocardial infarction,STEMI)患者的治疗效果,死亡率或其他衡量治疗效果的指标等没有取得显著改进,特别在基层。据中国心血管病报告2017数据显示,近10年来我国急性心肌梗死(acute myocardial infarction, AMI)死亡率总体呈上升态势,农村地区AMI死亡率不仅于2007、2009、2011年数次超过城市地区,而且2012年开始农村地区AMI死亡率明显超过城市地区,至2015年农村及城市的AMI死亡率分别升至70.1/10万人及56.4/10万人(图5)[3]。
2015年Lancet杂志发表的China PEACE研究分析了我国2001、2006及2011年3个阶段性年份随机抽取的162家医院13 815例心肌梗死患者的救治情况[4]。研究发现,过去10年间医院因STEMI住院的患者显著增加,尽管2011、2006及2011年间,STEMI患者直接冠状动脉介入治疗(primary percutaneous coronary intervention, P-PCI)的比例增加明显,分别为10.6 %、17.4%及28.1 %,但3年总的再灌注治疗比例分别为45.3%、45.5%及44.8%,并无增加。P-PCI率显著增高的同时,基层医院的溶栓比例却显著降低,此外患者就诊延迟也是导致再灌注治疗比例低的主要原因。
早期、快速和完全地疏通梗死相关血管是改善STEMI患者预后的关键,尽管我国在STEMI规范化救治,尤其是P-PCI方面取得了长足的进步,但是由于患者就诊延迟严重、直接PCI单位不足且分布不均、120与院内衔接不足、医院救治水平参差不齐等问题,距离理想的STEMI防控治网络还有很大的距离。如何让更多的STEMI患者尽早就诊是当前中国STEMI救治面临的巨大挑战,最重要的就是缩短发病-首次医疗接触时间以及首次医疗接触时间-开通梗死相关动脉时间。心肌梗死救治是一个综合管理工程,需要行政管理部门、区域救护系统、医院以及患者的共同参与和协作,包括通过媒体公益宣传和社区人群教育,使患者早期识别心肌梗死症状,并在发生疑似心肌梗死症状后,及时就医或呼叫救护中心等。而积极推进胸痛中心建设,提倡区域性AMI救治网络体系,是现阶段进一步提升中国STEMI救治水平的有效措施,不仅能够缩减各个医院之间的治疗差距,同时能够使患者享受到新型模式带来的益处。
冠状动脉慢性完全闭塞(chronic total occlusion,CTO)病变因接受PCI手术成功率低、并发症发生率较高,被称为冠状动脉介入领域"最后的堡垒"。早期CTO病变PCI的成功率不高,为50%~70%。然而,随着现代器械及技术的进步,全球很多中心CTO-PCI的成功率已经超过80%,部分中心可达到90%左右。国内由笔者最早开始开展CTO的介入治疗,并于2005年首次在美国经导管心血管治疗(transcatheter cardiovascular therapeutics ,TCT)大会成功演示"逆向导引钢丝技术"。在我国,地域介入发展水平不均衡、新型器械普及度不高等客观因素在一定程度上阻碍了我国CTO介入治疗的发展和规范化进程。2005年8月于上海组建中国冠状动脉慢性闭塞病变介入治疗俱乐部(Chronic Total Occlusion Club,China,CTOCC )(图6)。以CTOCC平台为基础,广泛建立以病例为基础的教学形式,不断规范化CTO介入治疗,并在器械选择、对病人病变部位判断及对手术时机的方向把握越来越精确,提高术前多排螺旋CT (multi-slice CT,MSCT)和血管内超声(intravenous ultrasound ,IVUS)使用比例,在有条件的中心进一步提高逆向技术使用比例,并建立中国冠状动脉慢性完全闭塞病变介入治疗注册研究数据库(CTOCC Registry Study),通过实战经验和数据总结最终不断提高CTO介入手术成功率。2018年,在结合我国临床实践并复习该领域相关资料和研究进展的基础上,CTOCC起草并发布了《中国冠状动脉慢性完全闭塞病变介入治疗推荐路径》[5],为规范我国CTO介入治疗提供了具体的依据。


冠状动脉分叉病变始终是PCI治疗中值得探讨解决的难题,是冠状动脉介入技术及处理策略的重要研究方向。冠状动脉分叉病变介入治疗的过程中技术操作难度大,接受放射线量多,斑块移位、分支血管开口弹性回缩等,甚至分支血管闭塞,术后再狭窄率高,近期及远期主要心脏不良事件发生率相对较高,此外,冠状动脉分叉病变解剖结构千变万化,并随着治疗过程也发生改变,因而目前治疗决策选择仍没有公认的"金标准"。左主干前三叉病变常累及前降支和回旋支开口,因手术风险和技术难度均较大而被视为特殊类型的分叉病变。
如何客观评价分叉病变的解剖生理特点,制定合理的治疗策略,一直是我国心脏介入医生努力的方向。冠状动脉分叉病变最合适、最优化的策略不仅仅要达到最佳的即刻临床效果,更重要的是要获得最佳的长期预后效果:较低的血栓发生率、较低的再狭窄率、较低的主要不良心血管事件(major adverse cardiac events,MACE)发生率等,以最简单的方式解除复杂病变,提高介入操作的有效性和安全性。尽管现行的专家共识及PCI指南倾向于采用简单的策略治疗分叉病变,如单支架术或必要时边支支架术,但对于严重真分叉病变、主要血管分叉病变如左主干前三叉病变等,为了避免术中重要血管的闭塞丢失、提高PCI术的安全性,双支架策略依然是临床医生的经常选项,包括Crush系列术、Culotte系列术、T支架系列术、V支架系列术等(图7)。在双支架术的技术改进中,我国心脏介入医生做出了巨大贡献。2005年陈绍良教授在体外研究的基础上,进行大量的基础研究与模拟实验,并主持开展了系列临床研究,发明了DK-Crush技术[6],通过两次对吻,使最终对吻扩张的成功率从70%达到接近100%。DK-Crush系列研究证实了该技术的安全性和有效性,并且对于左主干末端真性分叉病变和复杂分叉病变中同样具有较好的安全性和有效性[7]。2011年陈良龙教授提出改良DK-Culotte技术,进一步降低环状限制性支架膨胀不良,降低支架再狭窄及潜在血栓风险[8]。
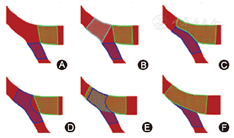

注:A图示V支架;B图示Y支架;C图示Kissing支架;D图示T支架;E图示Culotte术式;F图示Crush术式
近年来,随着药物球囊在冠状动脉介入治疗中的推广,作为新的介入治疗理念,将会为分叉病变的治疗策略提供新的选择,有望成为分叉病变介入治疗的利器。目前由于费用限制等原因,我国药物球囊使用尚未普及,药物球囊在分叉病变中的应用仍有较大的提升空间。
尽管冠状动脉造影是冠心病诊断的金标准,但是由于其二维血管投照显影的技术限制,使其在评价管壁及斑块的特征方面存在很大局限性。一方面对于弥漫性冠状动脉病变,经常无法找到真正"正常"的参考血管节段,因而冠状动脉造影往往低估病变程度;另一方面,在冠状动脉病变早期阶段,病变血管可发生正性重构,冠状动脉造影也可能低估病变程度,此外,对于偏心性病变,造影投照的局限性也会影响对血管狭窄程度的评估。而冠状动脉腔内影像技术可以对冠状动脉管腔细微结构进行精确评价,不仅可评价管腔狭窄程度,且可对斑块负荷程度、易损性等其他精细化结构进行评价,对探究冠心病发病机制,优化指导冠心病经皮冠状动脉介入治疗具有重要临床意义。IVUS和光学相干断层成像(optical coherence tomography,OCT)作为经典腔内影像技术,两者探查管腔和血管壁,形成横截面二维影像的技术,弥补了X线冠状动脉造影的不足。
我国IVUS于20世纪90年代初开始开展,上海中山医院、山东齐鲁医院、北京协和医院、北京军区总医院以及西安、武汉和广州等地区的多家医院进行了大量卓有成效的基础研究和临床应用,使IVUS在我国得到快速推广和应用。上海中山医院是国内最早开展IVUS临床应用和研究的中心之一,深入研究血管三层结构的成像特征,提出不稳定斑块的量化指标,探讨粥样斑块导致血管发生重构的规律,发现心肌桥的特异性诊断指标"半月现象",并将这一技术应用到冠状动脉疾病的诊治过程中[9]。当前,IVUS已进入到国内众多心脏介入中心,2011年,笔者发起并成立中国血管内超声学院,以此为平台,进一步推广和普及血管内超声知识和临床使用技能,旨在提高广大心脏介入医生对冠状动脉疾病病理生理特征的认识,进一步发挥IVUS在指导介入治疗病变和方案的选择、疗效的评估方面的重要作用。2018年5月发布了《血管内超声在冠状动脉疾病中应用的中国专家共识(2018)》[10],该共识更符合我国国情,同时紧扣临床,以实用为主旨,以期规范操作,并提高临床医生对IVUS的运用和解读水平。目前我国每年完成的IVUS病例数正在迅速增加,极大地提高了冠状动脉疾病的诊治水平,有效地指导了冠状动脉疾病的介入治疗。
与IVUS相比,OCT有很高的敏感性和高于IVUS 10倍的分辨率,因而可了解血管和斑块表面的细微结构,在观察血栓形态方面比IVUS更具有优势。在我国,冠状动脉OCT成像技术于2005年由哈尔滨医科大学附属第二医院心内科率先引进,近年来,OCT进入到越来越多的心脏介入中心,用于指导和优化冠状动脉介入治疗。于波教授首次通过OCT阐明在体冠状动脉纤维帽厚度、斑块负荷、狭窄程度是易损斑块破裂并引起临床事件的主要决定因素;揭示ACS发病机制主要为斑块破裂、斑块侵蚀和钙化结节,确立了OCT影像上的分类标准和诊断流程;并于2016年发布EROSION研究结果,证实通过OCT可以检测ACS患者冠状动脉内斑块性质,筛选出适合非介入治疗的人群,首次提出由斑块侵蚀导致的ACS患者,保守的抗栓治疗是可行的[11]。该研究被欧洲心脏病学会年会评为2016年度全球十大最佳临床研究之一。随着OCT技术不断进步和完善,三维OCT冠状动脉成像在临床开始得到应用,因其优秀的分辨率及成像速度可更加准确地显示血管内腔的微细结构改变,可以更好地评价和指导冠心病介入治疗。相信在不远的将来,OCT将成为常规的腔内影像诊断技术在更多的心脏介入中心普及,在冠心病的诊治中发挥更为重要的作用。
腔内影像在冠状动脉造影基础上提供了更为详细的解剖学和组织学信息,但近年来,冠心病的诊治已从过去仅关注血管解剖学狭窄,进入到了功能学评价时代。解剖学狭窄并不等于功能学上的缺血,判断与心肌缺血相关的血管及病变对于改善患者预后具有很重要的意义,FAME系列研究表明,冠状动脉血流储备分数(fractional flow reserve,FFR)指导的PCI术与传统的血管造影指导的PCI术相比,可显著降低MACE发生率[12,13]。FFR目前为冠状动脉功能学评价的金标准,由于其操作的有创性、复杂性、腺苷或ATP等药物的不良反应,以及压力导丝成本昂贵等问题,FFR在我国的临床应用很不理想。为使FFR在指导PCI中的运用更为广泛,基于影像的无创FFR计算技术成为近年国际心血管领域关注的热点技术。2017年TCT会议公布的FAVOR II China以及FAVOR II Europe/Japan研究是定量血流分数(quantitative flow ratio,QFR)的临床验证研究,结果均显示,QFR在对具有血流动力学意义的冠状动脉狭窄诊断上与金标准FFR具有高度一致性,QFR的诊断精度显著高于冠状动脉造影定性分析[14]。QFR是由涂圣贤博士研究团队自主研发的中国原创技术,经过两个阶段的研发,在国际上首次实现了无需压力导丝、患者无需注射腺苷或腺嘌呤核苷三磷酸(adenosine triphosphate ,ATP),仅使用造影数据即可快速准确计算FFR(从影像传输到分析计算完成总时间仅4 min)。QFR有望在导管室在线实时使用以指导介入手术,成为临床评估冠状动脉狭窄功能学意义、明确患者是否需要进行血运重建治疗的新工具。
冠状动脉介入治疗的进展离不开冠状动脉介入器械的发展与进步。和国外相比,中国的医疗器械的创新仍处于初级阶段。欧盟医疗器械委员会统计数据显示,美国、欧盟各国、日本共占据全球医疗器械市场超80%份额,其中美国一家独占40%以上,是全球最大的医疗器械生产国和消费国。国内医疗器械市场规模增长速度大大高于全球增速。尽管目前我国医疗器械生产厂家有近万家,但其中90%以上为中小型企业,市场竞争力相对薄弱。在高端医疗器械市场,国外产品在大部分市场处于垄断地位,我国高值耗材市场除了支架类产品实现国产化外,大部分被进口产品垄断。然而近10年来,中国心血管创新已从模仿、改进逐步走向了原创,中国医疗器械企业正在走向世界。
国产冠状动脉介入器械的研发为我国冠状动脉介入治疗的快速发展提供了有力保证和支持。我国冠状动脉介入器械生产企业正在努力完成从模仿到创新,从制造到创造、从产品到品牌的转变。目前,国产药物涂层支架(drug-eluting stent,DES)的市场占有率达70%以上。Excel支架为全球第一个上市的不锈钢平台、可降解聚合物涂层携载雷帕霉素支架[15] (图8)。第二代DES将钴-铬合金代替不锈钢,减小了支架丝厚度,或应用可降解聚合物涂层。更新一代的DES包括靶向释放药物的DES或无聚合物涂层DES。这些新型支架均已经过临床试验验证,大多数已获得国家食品药品监督管理总局(China Food and Drug Administration ,CFDA)批准上市(部分仍在进行临床试验或审批之中)。


CFDA颁布的《冠状动脉药物洗脱支架临床试验指导原则》提高了我国DES批准上市的标准,保证了国产DES的质量。Firehawk支架是第一个完全遵照CFDA指导原则进行严格临床验证的国产DES,也是全球第一个获准上市的靶向释放药物的DES(图9)[16]。它通过单面刻槽工艺将可降解聚合物和药物隐藏于槽内,实现药物向血管组织靶向释放,减少了支架壁厚度,明显减少了药量,降低了对血管壁的炎性刺激。TARGET系列研究[17]结果表明,Firehawk支架无论从血管造影晚期管腔丢失率、临床事件,还是靶病变失败率等终点,都显示出与Xience V支架的等效结果。

生物可吸收支架(bioresorbable scaffolds,BRS)已成为继经皮冠状动脉腔内血管成形术(percutaneous transluminal coronary angioplasty ,PTCA)、裸金属支架和药物洗脱支架后冠心病介入治疗史上的第四次革命性进展(图10)。BRS在植入后早期可支撑血管壁,避免弹性回缩和血管闭塞,在血管负性重构完成后可完全降解为水和二氧化碳,对人体无害,并具有金属支架无法比拟的优势:不会禁锢边支血管、与磁共振检查兼容、可在同一部位反复介入治疗等,但更为关键的是支架完全降解后,血管可恢复正常的生理结构和功能,去除了永久血管植入物,也去除了致血管壁炎症的因素,理论上可减少支架内再狭窄和支架血栓的发生,这也是目前流行的"血管修复治疗"的理念。然而,理想很丰满,现实却很残酷,BRS的发展轨迹可以用"高开低走"来形容。自2006年开始用于临床至今,10年间BRS经历了峥嵘初露、如日中天和备受质疑3个阶段。2017年9月,雅培公司宣布Absorb GT1退市,BRS彻底陷入低谷。在BRS的低潮期中,来自中国的BRS临床研究结果始终是一抹亮色。ABSORB China研究结果明显优于同期进行的ABSORBⅡ和ABSORB Ⅲ研究[18,19,20],其原因在于来自中国的研究者能通过造影准确判断并选用与患者血管直径匹配的BRS。此外,由国人自主研发的BRS在此番低潮期中也异军突起,显示了良好的长期疗效。如今,国内研究者正直面BRS存在的问题,继续稳步推进BRS的研发。复旦大学附属中山医院心内科和山东华安生物技术有限公司合作研制和开发的XINSORB生物可吸收支架是第一个在国内开展临床研究的国产生物可吸收支架,初步随访结果证实了其安全性和有效性[21,22]。此外,乐普医疗的NeoVas生物可吸收支架和微创医疗的FireSorb生物可吸收支架都同样进入CFDA创新医疗器械审批通道,有望在短期内上市,并造福于某些特定的介入病患人群[23]。BRS的出现无疑是冠心病介入治疗的里程碑事件。然而,和所有新生事物一样,BRS也不是完美的。发展中出现的问题,要用发展来解决。我们应抱着宽容的态度,允许BRS有些许缺陷,给它时间,让它逐步完善,使血管修复治疗真正能造福冠心病患者。


由于社会制度、文化和价值观等问题,本应在医疗器械创新中发挥核心作用的中国医生却普遍缺乏创新的动力,更缺少创新的方法。由于种种壁垒的存在,即使医生有创意,也无法做成产品,技术无法量产,专利无法保护,初创企业融资无门,从而无法形成高效高产的创新闭环。正是在此基础上,2015年9月笔者倡导成立了中国心血管医生创新俱乐部(Cardiovascular Doctors Innovation,CCI)(图11)。CCI以医生为核心,始终坚持"of the doctors,by the doctors,for the doctors"的理念。在CCI平台上,我们可以分享创新咨询、提供创新培训和专利服务,并为初创公司寻找资金支持和产品推广。中国创造有能力填补市场空白,引领行业发展。我们期待有更多来自中国的原创医疗技术和产品在国际舞台上发出自己的最强音。


回顾40余年历史,我们发现,中国心血管介入医生孜孜以求、不断探索的精神贯穿始终而不变。目前,中国年PCI开展例数已达到全球第二,PCI的先进理念和技术仍处在不断发展中,中国的PCI技术发展潜力巨大。当然,例数和规模将不再是心血管介入医生追求的主要目标,在规范化的前提下,应进一步做好技术的普及和推广,更好、更快地应用在最适宜的患者中。同时关注围术期诊疗和有效的预防,以期从整体上降低冠心病的发病率和死亡率。另外,PCI领域研究的原始创新程度还不够高,中国心血管医生应更加密切地与国际或国内学术组织和同道合作,以未解决的临床需求为目标,携手投身于新技术、新疗法的创新事业中,努力完成从数量到质量、从临床问题到科研课题的转变,提高临床研究的原创性。因此,我们期待我国未来冠状动脉PCI领域出现以技术、器械、材料、药物、临床、预防、康复、基础等多个学科交叉渗透和相互促进的发展模式,为更多的冠心病患者带来更大的获益。