
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
心脏瓣膜病是我国常见的心脏疾病之一,据不完全统计,全国至少有3 000万瓣膜病患者,尤其是随着人口老龄化,心脏瓣膜病在65岁以上人群的发病率已经超过6.4%[1]。心脏瓣膜病明显地改变了心腔内血流动力学,造成心脏扩大、心力衰竭和心律失常,致死致残率很高。随着中国经济和卫生水平的提高,我国既往占主体的风湿性瓣膜病发病率逐渐下降,但老年瓣膜退行性改变以及冠状动脉粥样硬化性心脏病和心力衰竭合并瓣膜病的比例在逐渐升高[2]。目前的治疗措施主要是外科体外循环下手术进行瓣膜成形或者瓣膜置换,近年来经导管介入瓣膜手术发展迅速,成为治疗重症和老年患者的新方法。本文旨在归纳总结2019年国际心脏瓣膜病领域的研究成果,为国内该领域同行提供参考。
检索Medline、Sciencedirect、Springer、Ovid、中国知网及万方医学数据库,中文检索词选用"心脏瓣膜病""瓣膜手术""瓣膜外科""瓣膜成形""经导管瓣膜治疗技术"及"介入瓣膜手术",英文检索词选用"heart valve disease""valve surgery""valve repair"及"transcatheter valve treatment"。纳入2019年公开发表的瓣膜病临床研究和新技术进展方面的论著文献,排除动物实验和离体测试等基础研究文章。
2019年心脏瓣膜病的研究方向可以分为心脏外科手术和介入手术两大部分,其中常规的外科开胸手术又分为微创小切口手术、瓣膜成形技术、重症瓣膜病手术等几大领域,介入手术发展研究则以经导管主动脉瓣置换术(transcatheter aortic valve replacement,TAVR)和经导管二尖瓣夹合术(MitraClip)为主。本文重点总结常规外科开胸心脏瓣膜手术技术的研究进展。
为了更好地总结近年来心脏瓣膜病治疗策略的趋势变化,2019年备受瞩目的EURObservational Research Programme心脏瓣膜病Ⅱ研究更新了自2015年后的新进展情况,28个国家/地区的222个中心进行的调查显示了心脏瓣膜病患者人口结构的变化及其对临床治疗的影响[3],作为国际上最大的多中心注册研究,该研究登记了7 247例心脏瓣膜病患者(包括4 483例住院治疗患者及2 764例门诊患者)。与2005年进行的类似调查相比,主要发现包括心脏瓣膜病患者的年龄上升、主动脉瓣疾病患者的治疗更符合指南(二尖瓣疾病患者通常更晚干预)以及经导管介入治疗的比例逐渐增加(主动脉瓣狭窄占39%,二尖瓣关闭不全占17% )[4],这也反映了过去几年心脏瓣膜介入治疗技术的迅速发展对临床实际工作的影响。
自1983年法国Carpentier教授开拓性研究和开展二尖瓣疾病成形技术以来,针对二尖瓣退行性变为主的成形技术不断取得技术进步。多伦多总医院的Tirone David团队等是该领域的国际领先者,2019年该团队报告了将近30年的随访数据研究[5],1981至2010年间1 234例患者中随访时间最长者延长到了34年。随访结果显示,对二尖瓣退行性疾病的成形术效果持久,中重度二尖瓣反流复发率10年为6.3%,20年为12.5%;20年后再次行二尖瓣手术的患者不到5%。这些数据表明,大多数退行性疾病引起的二尖瓣关闭不全患者在有经验的瓣膜中心接受瓣膜成形手术,患者二尖瓣关闭不全几乎被持久地治愈。实际上,现在的二尖瓣成形技术相比30年前又有了较大的进步,因此我们有理由相信当前针对二尖瓣退行性变的成形技术可以取得更好的长期治愈效果。
值得注意的是,David教授的二尖瓣成形患者平均年龄为59岁,但是随访中有接近1/3患者在20年内死亡,死亡率似乎比人们预期的要高,为什么这些退行性二尖瓣疾病的患者在持久地纠正其二尖瓣反流(mitral regurgitation,MR)疾病后,寿命仍然不及同龄正常人群?部分原因在于手术患者的术前心脏功能状态已经明显下降。如果患者在手术时已经出现心功能下降、心脏扩大明显或射血分数降低,则预期效果不佳,可能出现较早死亡。这些证据提示在严重临床症状或左心室功能不全出现前早期手术治疗MR的重要性。
David教授研究的中长期随访患者中,20%出现了三尖瓣明显反流,带来了一系列心力衰竭和并发症问题。美国Adams教授团队近年来一直主张对三尖瓣采取更加积极的手术策略,在接受二尖瓣修补术的患者中对存在术后远期三尖瓣反流危险因素患者均进行三尖瓣成形术,其中超过60%的患者接受了三尖瓣成形术[6],中期随访效果良好。在David教授等的二尖瓣成形术患者队列中,只有5%的患者接受了三尖瓣成形术,30年前对三尖瓣远期复发还没有充分认识,当前三尖瓣成形术的早期使用策略可能会改善二尖瓣成形术患者远期三尖瓣反流的发生率,进而降低心源性死亡率。
类似的,有心房颤动风险的患者,如伴有阵发性心房颤动史和左心房明显增大,可能是常规左心耳闭合和伴随的预防性迷宫消融手术的候选对象。这项研究的结果再次强调了包括三尖瓣成形、房颤消融、左心耳术等这些完全手术策略的重要性,近些年很多医师都在强调微创小切口手术,但是经常会忽略掉辅助手术的重要性,这项研究长期随访的结果对于临床手术策略选择具有非常重要的借鉴意义[6]。毫无疑问,我们需要寻求真正治愈退行性二尖瓣关闭不全的技术,这也是未来重要的研究课题。
二尖瓣成形术后残余的反流不利于远期二尖瓣成形术效果的维持,会带来潜在的心脏扩大和心力衰竭等并发症风险,但采用二次心脏停跳并再次进行体外循环手术同样会带来额外的手术创伤和风险,因此术中是否需要二次心脏停跳并再次进行手术的抉择非常重要。美国纽约西奈山医院El-Eshmawi等[7]总结了2011—2016年40例手术室实施第二次主动脉阻断并再次进行瓣膜手术的患者数据资料,结果显示:患者年龄(57.3±13.5)岁,35%的患者术前没有明显症状;经食管超声心动图显示残余MR患者轻度25例,中度9例,中重度6例;二尖瓣残余反流原因包括技术或残余病变35例和收缩期瓣叶前向运动征(systolic anterior motion,SAM)5例;再次手术的成形技术包括瓣叶间隙闭合22例、反流原发处缝线成形13例和重新人工腱索成形术9例;二次手术后34例(85%)没有MR,4例(10%)微量反流,2例(5%)轻度反流;总体体外循环时间208.5 min,第一次阻断时间106 min,第二次阻断时间(34±12)min。平均监护室时间2 d,住院时间8 d。出院时13例(33%)无二尖瓣反流,23例(58%)微量反流,4例(10%)轻度反流。5年随访时无一例出现中度及以上反流。该研究的结论是二次转机手术可以获得更加良好的中远期瓣膜成形效果,应该重视把握手术台上的宝贵机会。
Bhatt等[8]的研究强调,术中经食管三维超声心动图与常规二维超声心动图相比,可以更好地模拟二尖瓣和三尖瓣外科术中状态,有助于术前评估和判断三尖瓣病变和制定更精确的成形方案。尤其是三尖瓣的不规则三维构型特点,相比二尖瓣更加难以单纯用二维超声来检测。术前可以使用三维超声测量三尖瓣瓣环的各个部分的大小。研究显示二维超声检测数据和术中直视测量数据误差为0.21 cm[标准差(standard deviation,SD)= 0.36 cm],而经食管三维超声心动图误差仅为0.03 cm (SD = 0.19 cm ),更精准的评估技术可以更好地完成瓣膜成形手术。
心力衰竭危重症近些年来使用左心室辅助装置(left ventricular assist device,LVAD)的病例越来越多,也取得了很多成果与经验。很多严重心力衰竭患者合并有严重的二尖瓣继发性关闭不全,在LVAD植入时严重MR的处理与否仍然存在争议。以往很多研究者认为,MR由于LVAD植入时提供的心室负荷减轻而得到解决,可以有利地促进反向重塑。因此,功能性MR被认为对LVAD的结果影响很小,并且很多这类患者存在多器官功能不全,难以耐受体外循环下的二尖瓣成形术,因此很多研究者不提倡进行常规的外科开胸二尖瓣成形术。2019年Pawale等[9]在LVAD植入时对重度MR采取了二尖瓣成形术,总结了2013—2017年78例LVAD植入术中合并重症MR患者的随访结果。用Cox模型和倾向评分方法,将这些患者的数据与2011—2013年期间未接受二尖瓣成形术的28例同样患有严重MR的历史对照组进行了比较。78例患者中有62例仅使用环缩或者缘对缘成形技术,其中16例通过左心室心尖途径完成缘对缘成形(原因主要为小切口手术或患者多器官衰竭),2例瓣膜脱垂也进行了瓣叶成形,中位随访时间为17.7个月。结果显示,接受二尖瓣成形术的患者(成形组)比未接受患者(非成形组)年轻(55岁vs. 63岁;P=0.006 ),但其他方面具有相似的术前特征。两组的30 d死亡率(2.6% vs.3.6%;P=0.78)和其他早期主要不良事件的发生率相似。在随访3个月时,成形组中无一例患者的MR超过轻度,而非成形组中有7例患者(29%)存在中度以上MR (P<0.001 )。术后3~6个月行心导管术,成形组肺动脉收缩压较非成形组有明显下降趋势[-20 mmHg (1 mmHg=0.133 kPa)vs. -13 mmHg;P=0.10],成形组2年后因充血性心力衰竭再入院的累积发生率低于非成形组[7.1% vs.19.7%;调整后的风险比(hazard ratio,HR)为0.18;95%置信区间(confidence interval,CI)为0.04~0.76;P=0.02]。该研究显示LVAD植入同时行二尖瓣成形术是安全的,且不会增加围手术期不良事件的发生。二尖瓣成形术可能减少了随访期间心力衰竭的再入院率,使患者更加获益。但是,就像Pagani[10]指出的那样,是否建议所有计划安装LVAD的心力衰竭患者都要常规进行功能MR的二尖瓣成形术呢?参考Kassis等[11]的研究结果,LVAD术后多数MR都明显缓解,因此最重要的是术前评估哪些患者可能在使用LVAD后左心室负荷降低以及减轻MR效果不佳,这还需要今后多中心的临床试验来回答这个问题。
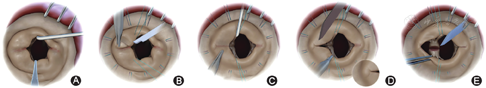
二尖瓣疾病是中国心脏瓣膜疾病最常见的种类,据不完全统计,中国有250万左右风湿性二尖瓣疾病患者需要进行手术治疗[12]。既往国内外科医生多常规使用二尖瓣置换手术,但是无论采用机械瓣还是生物瓣均有很大局限性。机械瓣会带来终身华法林抗凝的出血/血栓风险,生物瓣带来的毁损问题则严重影响患者的身心健康。国内外有经验的瓣膜成形中心的配对研究显示,风湿性二尖瓣成形术效果良好,随访中可以保持更完整的左心室腱索乳头肌瓣膜等复合结构,因此与风湿性二尖瓣置换相比左心功能不全的比例更低,而且出血/血栓比例更低[13]。首都医科大学附属北京安贞医院心外科瓣膜中心近年来致力于风湿性二尖瓣成形术的研究,结合成形难易程度和超声检测参数,总结提出风湿性二尖瓣病变的新病理分型,并在此基础上提出了包括交界切开等容易掌握的风湿性二尖瓣疾病的成形手术四步法(图1)[14],近年来已经联合北京吴英恺医学发展基金会在国内十余家大型医疗中心进行公益技术推广,每年完成300余例风湿性二尖瓣成形术,临床效果满意,并在2018年牵头组织国内多中心心脏外科专家制定了中国风湿性二尖瓣外科治疗指征专家共识[15]。

瓣膜病心脏外科微创小切口手术是近十年来一直持续的研究热点,瓣膜外科手术,特别是置换手术的术式相对固定,因此也相对容易开展微创小切口手术。在胸骨上段或胸骨旁小切口行主动脉瓣微创手术和右侧肋间小切口行二尖瓣或三尖瓣手术为最常见的手术方法,各个中心经验和习惯略有不同。经验丰富之后,切口可能会越来越小,从而过渡到胸腔镜辅助和全胸腔镜瓣膜手术。从临床技术和对患者的损伤程度来看,这类微创小切口瓣膜手术实质上还是要在体外循环下心脏停跳并切开进行手术,也就是说刀口里面的手术技术和以往经典的正中开胸手术并无不同,因此技术难度明显加大,而且改良和提高空间并不是很大,难以有本质上的突破。微创小切口瓣膜手术需要临床术者具有较为丰富的常规开胸手术经验,在此基础上可以尝试逐步扩大适应证。
此外,由于切口小,心脏组织结构显露稍差,会导致体外循环和心脏停跳时间延长,随之而来的心脏和全身脏器功能损伤也会增多,因此微创小切口手术仅适用于身体条件好、美观要求比较多的年轻患者,对于复杂重症高龄患者并不适合,这也是这类手术真正微创程度不及介入瓣膜技术的原因。
对于单纯性主动脉瓣关闭不全合并主动脉环扩张的患者,手术策略常采用瓣环下环缩技术来进行主动脉瓣成形。环缩的材料经常使用涤纶条、缝线或者人工瓣环,但是各类技术的环缩效果对比研究较少。2019年Benhassen等[16]利用猪的动物模型比较了使用涤纶条和缝线进行环缩成形术的瓣环几何构型变化和动力学变化特点。结果显示,在自体主动脉瓣环组和涤纶条组中,右冠瓣环区域的节段性扩张最大,而缝线组的节段性扩张比较均匀,各个区域差异无统计学意义。自体瓣环、涤纶条带组主动脉瓣环收缩期以卵圆形为主,舒张期呈圆形,而缝合组在整个心动周期内基本维持为球形。此项研究首次在标准化的猪模型中进行了详细描述,并比较了涤纶环和缝线环缩成形术的节段几何构型变化特点。两种环缩成形术都有效地缩小了主动脉环,同时保持了心动周期内的扩张性。每种瓣膜成形术都有其自身的几何构型变化特点,但涤纶环缩技术更接近于天然主动脉环的特点。
2019年Gocoł等[17]报告了一种主动脉瓣成形的HAART 300内置人工瓣环,可呈现三维立体结构,术中与自体瓣环缝合,可以起到环缩和固定作用。该人工瓣环植入手术操作简单,不影响主动脉瓣叶和根部的其他手术。作者报告了15例主动脉瓣关闭不全患者采用这种硬质三维主动脉瓣成型环进行主动脉瓣成形的临床结果,术中和术后随访6个月时超声显示出其良好和稳定的成形效果。
A型急性主动脉夹层中细化手术策略目前仍然在探索中,其中越来越多的技术倾向于保留主动脉瓣,但是其手术技术和远期随访效果并不一致。2019年Urbanski等[18]回顾总结了2001—2011年46例A型急性主动脉夹层患者的临床治疗结果,年龄为(62±14)岁,3例为马凡综合征。患者均接受了主动脉根部成形手术,瓣膜保留率为56%。主动脉瓣反流严重程度0/1+、2+、3+和4+者分别有16、17、12和1例患者。主动脉根部成形切除所有病变累及组织,术后没有使用止血胶。窦部置换手术中涉及1、2、3个窦部的患者例数分别为29、12和5例。同期还有7例患者进行瓣叶的成形技术。随访10个月时有6例患者死亡(平均年龄76岁,年龄范围63~81岁),生存率为87%。8年生存率为85.5%±5.6%,线性死亡率2.9%/年。死亡原因均与主动脉瓣和主动脉根部无关。随访4年的心脏超声显示,33例患者无主动脉瓣反流,13例仅有轻度主动脉瓣反流。研究结果提示,主动脉瓣成形同期进行主动脉窦部病变部位而非全部窦部置换手术的远期效果良好。这种选择性的主动脉窦部成形手术操作相对简单,多数情况下可以解决主动脉根部扩张问题。
目前国内外指南均建议,主动脉瓣二叶瓣化畸形合并主动脉窦部大于45 mm时可同期行主动脉瓣根部人工血管置换手术。但是对于主动脉窦部直径为40~45 mm者尚缺乏统一意见,因为冠状动脉移植操作会明显增加手术的难度和风险。2019年Carlotta等[19]总结了主动脉瓣二叶瓣化畸形合并窦部中度扩张和升主动脉明显扩张病例的手术效果,术中只对主动脉窦扩张最明显者进行无冠窦置换(hemi-remodeling ),同时联合升主动脉置换和主动脉瓣成形术。2003—2017年共进行18例该手术,主动脉根部平均直径为(42.3±3.3)mm。主动脉瓣成形除了瓣叶成形技术之外,还会使用主动脉瓣根部外环缩技术。术后88.9%患者无主动脉瓣反流,11.1%有轻度反流,无一例患者存在中重度反流。随访4年生存率为100%,无一例出现中度以上主动脉瓣反流。该研究结果显示,这种局部窦部重建技术临床效果良好,而且因为避免了冠状动脉移植,使得手术操作更为简单,主动脉阻断时间更短。
虽然风湿病主要影响二尖瓣,但是仍有30%的患者存在风湿性主动脉瓣的严重病变[20]。风湿性炎症病变使主动脉瓣增厚、纤维化、缩小成杯状,通常在交界处融合,有时伴有钙化。风湿性主动脉瓣的成形对于改善心室重塑、维持良好的左心室收缩功能和提高远期患者存活率尤其重要。此外,在抗凝依从性较差的年轻患者中,避免终身抗凝的机械瓣置换手术也具有重要意义。尽管目前在风湿性二尖瓣成形方面已经取得较好的临床效果,但是风湿性主动脉瓣病变由于其特殊的解剖学和组织病理学特征,成形的难度更大。
风湿性主动脉瓣病变的成形技术有很多,一些风湿性主动脉瓣有明显的交界融合,可以通过锋利的刀片切开(图2)。瓣叶病变可以从主动脉环下左心室流出道组织平面开始去除钙化或增厚部分。剥离增厚的瓣叶部分可以改善瓣叶活动度,增加其柔韧性、表面积和对合高度。心包补片在瓣叶游离缘位置时通常远期成形效果不佳,在游离边缘进行主动脉瓣修补时,主动脉瓣退化很快。可以尝试在瓣体中央位置进行心包扩大成形,或者完全用心包进行整体瓣叶的重建。Ozaki团队[21]采用模具测量进行个体化自体心包重建瓣叶技术。当然后者技术更多地被认为是一种无支架主动脉瓣置换,而非成形技术。修补用的心包多采用自体心包,聚四氟乙烯材料已经显示效果不佳。自体新鲜心包容易获取,具有一定生物活性。术中戊二醛处理的自体心包虽然操作更容易,但也更容易退化。也有术者使用成品的牛心包在术中进行瓣膜成形,但缺少长期随访效果观察。更具前景的组织工程补片尚在研究中。不同材料瓣膜成形的差异尚需要积累长期的随访结果。
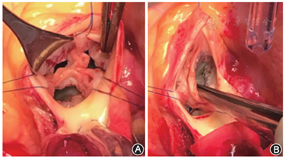

风湿性主动脉瓣疾病现今仍没有完美的治疗方案,手术技术仍在发展中,目前治疗方法的有效性需要通过更多患者的长期随访来验证。术者于术前应根据患者的年龄、活动习惯、药物依从性以及主动脉环和主动脉根部的大小和形状进行量身定制手术策略。
主动脉瓣二叶瓣化畸形患者经常会出现主动脉瓣反流,但多数术者不考虑瓣膜成形,一定程度上是由于主动脉瓣二叶瓣化畸形瓣膜成形耐久性的长期数据有限。2019年Arnaoutakis等[22]对主动脉瓣二叶瓣化畸形成形手术的长期结果进行荟萃分析,对主动脉瓣二叶瓣化畸形成形术后的耐久性和存活率进行系统评价,共纳入26项研究,结果显示,主动脉瓣二叶瓣化畸形成形手术5年随访死亡率很低(0~0.65%),二次手术率很低(0~10%)。涉及主动脉根部处理的两种最常用外科技术为主动脉根部再植入(reimplantation )技术和再塑形(remodeling)技术,它们在术后二次手术风险上并没有明显差异。对主动脉瓣瓣叶采用充分的对合高度和瓣环固定技术是获得更好的长期效果的重要环节。术前瓣叶钙化会导致二次手术风险升高。
Schneider等[23]报告的主动脉瓣二叶瓣化畸形成形和主动脉根部再塑形随访了20年。357例进行了瓣叶成形,226例进行了同期缝线的瓣环环缩技术,15年生存率为81%,21.7%的患者进行了二次手术。瓣叶钙化和心包补片扩大与随访中主动脉瓣反流复发、二次手术相关。而且早期不适合采用缝线瓣环环缩的病例更容易复发主动脉瓣反流。Lansac和de kerchove[24]报告了AVIATOR(Aortic Valve repair InternATiOnal Registry)研究,即主动脉瓣成形和再塑形、瓣环环缩手术的177例患者登记注册研究结果。59例(33.6%)具有主动脉瓣二叶瓣化畸形,10年随访中无一例进行二次手术。瓣环环缩和瓣叶充分对合高度可以有效降低再次手术风险。该技术使用的主动脉瓣人工瓣环可以明显缩小瓣环直径(4.3±3.9)mm,而且可以维持具有有效瓣叶的对合高度(10.2±3.3)mm。
关于主动脉瓣反流再植入成形技术,David等[25]报告了333例患者的20年随访结果,但是只有13.5%的患者是主动脉瓣二叶瓣化畸形病例,20年随访生存率为72.4%±3.8%。随访20年中96%的患者无二次手术,只有1例主动脉瓣二叶瓣化畸形病例术后8年进行了二次手术。斯坦福大学Kari等[26]总结了75例主动脉瓣二叶瓣化畸形再植入成形术治疗主动脉瓣反流(31%)或主动脉根部瘤(69%)。32%的患者为Type 0型主动脉瓣二叶瓣化畸形,66%的患者在升主动脉手术同期行瓣叶成形手术。6年随访时生存率为99%,免于二次手术率90%。瓣叶游离缘短缩并不影响瓣膜退化,但是交界悬吊技术具有较高的反流复发率。比利时de Kerchove等[27]报告了1995—2010年161例主动脉瓣二叶瓣化畸形,74例采用再植入成形技术,87例没有接受再植入成形手术,6年随访生存率为98%,两组生存率差异无统计学意义。但是接受再植入成形组无中度以上反流和无二次手术例数更多,其中瓣叶明显不对称和边界类似三叶瓣的成形效果最差。
回顾2019年心脏瓣膜病的研究进展,在外科手术瓣膜成形技术方面,无论是二尖瓣还是主动脉瓣仍然是研究热点,综合使用多种技巧恢复瓣膜生理性和解剖性结构是心脏瓣膜外科治疗技术追求的最理想结果,值得我们不断深入研究。另外,在外科瓣膜微创小切口手术基础上,无需体外循环、创伤更小的经导管瓣膜技术发展迅猛,尽管目前还有一些不足之处,但是随着技术经验和工艺材料等的不断提高,未来会给众多瓣膜病患者带来新的治疗策略和选择。


























