
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。








早期大量临床研究证实抗血小板治疗对于动脉粥样硬化性心血管疾病的一级和二级预防有显著益处,抗血小板药物在冠状动脉粥样硬化性心脏病(以下简称冠心病)、缺血性脑血管疾病和外周动脉疾病(peripheral arterial disease,PAD)的治疗中得到广泛运用(图1),尤其对急性冠状动脉综合征(acute coronary syndrome,ACS)和置入药物洗脱支架(drug eluting stent,DES)的患者,国内外指南均将双联抗血小板治疗(dual antiplatelet therapy,DAPT)作为Ⅰ类推荐[1,2,3]。然而,抗血小板治疗的疗效和安全性呈现较大的个体差异,在许多患者中出现不耐受情况,包括导致或加重消化道损伤及出血、其他器官部位出血和高尿酸血症/痛风等;此外,因患者对药物反应性低而增加抗血小板药物治疗剂量所导致的上述不良反应也屡见不鲜。因此,对于抗血小板药物不耐受高风险人群的识别,对于各类常规抗血小板治疗出现不耐受及低反应时的临床决策,亟须具体指导性意见。故而,由中国医师协会心血管内科医师分会、中国卒中学会和国际血管联盟中国分部发起,根据近年国内外动脉粥样硬化性疾病抗血小板治疗临床研究成果,结合我国临床现状和从业专家的临床经验制定此共识。希望通过本共识的制定与应用,为优化临床抗血小板药物不耐受及低反应性患者的诊疗提供指导。
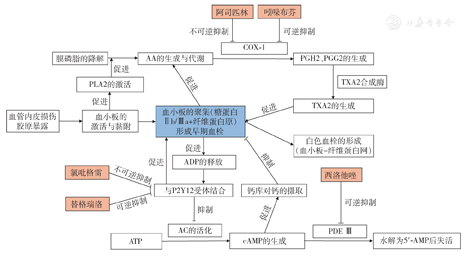

注:COX-1,环氧化酶1;AA,花生四烯酸;PGH2,前列腺素H2;PGG2,前列腺素G2;PLA2,磷脂A2;TXA2,血栓素A2;ADP,二磷酸腺苷;AC,腺苷酸环化酶;PDE Ⅲ,磷酸二酯酶Ⅲ ;ATP,三磷酸腺苷;cAMP,环磷酸腺苷;5′ -AMP,5′腺嘌呤核苷酸
抗血小板药物不耐受是指由于抗血小板药物可能或已经产生的不良反应等导致患者无法坚持长期服用某种或多种抗血小板药物的情况。
服用阿司匹林等抗血小板药物可出现反酸、恶心和腹胀等消化道损伤症状,严重者可导致消化道出血。既往溃疡病史[4,5]、非甾体抗炎药(nonsteroidal antiinflammatory drug,NSAIDS)或糖皮质激素的长期使用、胃食管反流病史、幽门螺杆菌(Helicobacter pylori ,HP)感染[6,7,8]、高龄及长期饮酒史[9]等更容易导致该类症状的出现。
阿司匹林可直接破坏消化道黏膜屏障,并不可逆性地抑制环氧化酶,减少前列腺素的合成,不利于胃黏膜的修复。研究表明,阿司匹林可使消化道损伤危险增加2~4倍[7]。与阿司匹林不同,P2Y12受体抑制剂并不直接损伤消化道黏膜,但会阻碍新生血管生成和影响溃疡愈合,因而与阿司匹林联合用药时损伤更为严重。虽然氯吡格雷与阿司匹林导致消化道出血的危险相似[10],但当阿司匹林与氯吡格雷联合应用时,消化道出血发生率较单用一种抗血小板药物风险增加2~3倍[11,12]。替格瑞洛亦可加重已存在的胃肠道黏膜损伤。PLATO研究[13]发现,相较于氯吡格雷,替格瑞洛显著增加了ACS患者消化道出血风险。相较阿司匹林,吲哚布芬胃肠反应少且出血发生率低。荟萃分析表明,吲哚布芬对缺血性心脑血管疾病患者的心血管死亡、心肌梗死和卒中发生率等方面的作用与阿司匹林相当,但总体出血、胃肠道反应等的发生率则低于阿司匹林[14];PAD患者服用吲哚布芬所致胃肠道紊乱发生率显著低于阿司匹林[15]。多个研究提示,吲哚布芬可作为阿司匹林不耐受或胃肠道反应较大患者的替代治疗[14,16]。
与阿司匹林相比,使用西洛他唑所致消化道出血发生率显著减少[17]。但因其禁用于充血性心力衰竭患者,且可能增加心率诱导心绞痛发生,冠状动脉狭窄的患者慎用,因此西洛他唑多用于非冠心病的其他患者。相较于传统抗血小板治疗,西洛他唑单药的出血性卒中风险更低,且联合用药没有增加出血性卒中的风险[18]。
多项荟萃分析显示,阿司匹林明显增加大出血和颅内出血发生率,对一级预防而言,阿司匹林对小出血及颅内出血事件的影响差异无统计学意义,但显著增加大出血事件[19,20]。PLATO研究[21]显示,替格瑞洛较氯吡格雷增加致命性颅内出血的发生率。EUCLID研究[22]提示,PAD患者服用氯吡格雷或替格瑞洛时,颅内出血的发生率差异无统计学意义;PRINCE研究[23]提示,替格瑞洛和氯吡格雷与阿司匹林联合治疗轻型缺血性卒中或短暂性脑缺血发作(transient ischemic attack,TIA)时,颅内出血发生率无统计学意义。CASISP研究[24]显示,在中国人群中,西洛他唑预防卒中的效果与阿司匹林相似,但西洛他唑导致颅内出血的风险明显降低,安全性更好;CSPS2研究[25]表明,在亚洲患者中,与阿司匹林相比,西洛他唑治疗的血管性事件发生率差异无统计学意义,且不增加出血风险;RESTART研究[26]显示,颅内出血后重启抗血小板治疗并没有增加出血风险,复发性颅内出血的风险可能小于抗血小板治疗作为二级预防的益处。
除抗血小板药物自身作用外,颅内出血与合并高血压、脑淀粉样血管病和脑血管畸形等机体自身因素相关。此外,颅内出血还与一些共性因素相关,如高龄[27]、肝肾功能不全[28]和凝血功能障碍等。
在抗血小板药物导致的出血中,除消化道出血及颅内出血外,其他重要出血部位主要包括深部组织(如泌尿生殖道、呼吸道和眼底)及皮肤黏膜出血。局部组织病变是深部组织出血的重要原因,如泌尿生殖道的结石、结构畸形、呼吸道肿瘤占位病变、肝肿瘤、血管瘤以及眼底动脉硬化改变等等。
CRUE研究[11]显示,对于ACS患者,氯吡格雷联合阿司匹林使大出血发生率从2.7%上升到3.7%。临床试验提示,DES置入后我国ACS患者口服阿司匹林联合替格瑞洛或者氯吡格雷大出血事件发生率比较,差异无统计学意义[29]。而KAMIR-NIH研究[30]显示,年龄≥ 75岁的东亚患者应用替格瑞洛后,住院期间心肌梗死溶栓治疗试验(thrombolysis in myocardial infarction,TIMI)大出血风险明显高于氯吡格雷。
在缺血性卒中患者中,虽然长期联合抗血小板治疗明显增加出血事件,但临床试验及荟萃分析[17,18,31]提示,使用西洛他唑较阿司匹林的颅内出血和鼻出血等出血事件发生更少;PRoFESS研究[32]显示,氯吡格雷用于预防卒中复发,主要出血事件发生率为3.6%,其中颅内出血发生率为1.0%;SOCRATES研究[33]提示,替格瑞洛和阿司匹林治疗的急性缺血性卒中或TIA患者90 d大出血发生率分别为0.5%和0.6%;MATCH研究[12]显示,对于卒中二级预防,阿司匹林和氯吡格雷联合并不优于单独使用氯吡格雷;CHRISMA研究[34]显示,对于有多重危险因素、既往未确诊的动脉粥样硬化疾病患者,阿司匹林与氯吡格雷联用不优于单用阿司匹林。另有荟萃分析提示,与阿司匹林单药相比,中期及长期阿司匹林联合氯吡格雷治疗会增加TIA或缺血性卒中患者大出血风险[35]。TARDIS研究[36]显示,对于急性非心源性缺血性卒中或TIA患者,阿司匹林、氯吡格雷和双嘧达莫的三联用药与氯吡格雷单药或阿司匹林联合双嘧达莫的双联用药相比,90 d内缺血事件复发率和严重程度差异无统计学意义,但三联用药的出血发生率显著高于单药或双联用药。吲哚布芬单药治疗动脉粥样硬化缺血性血管病变患者,未发生大出血事件[37]。
COMPASS研究[38]显示,胃肠道肿瘤将PAD患者胃肠道出血风险升高了20倍,泌尿生殖道肿瘤将泌尿系统出血风险升高了32倍。EUCLID研究[39]提示,使用氯吡格雷或替格瑞洛治疗的PAD患者,大出血发生率差异无统计学意义。一项荟萃分析也提示,使用P2Y12受体抑制剂的患者和接受阿司匹林治疗的PAD患者大出血事件发生率差异无统计学意义[40]。在CHARISMA研究[41]中,PAD患者使用DAPT的小出血事件发生率显著高于单药抗血小板治疗(single antiplatelet therapy,SAPT)。
阿司匹林对于尿酸代谢的影响具有剂量特异性,小剂量阿司匹林(75~325 mg/d)可引起血清尿酸水平增高和痛风复发[42,43,44,45]。替格瑞洛增加血清腺苷水平,促进尿酸合成,导致高尿酸血症和痛风[46]。在PLATO研究[21]中,替格瑞洛组患者血清尿酸浓度升高的比例和幅度明显高于氯吡格雷。PEGASUS-TIMI 54研究[47]结果显示,替格瑞洛治疗显著增加心肌梗死患者的痛风风险。另一项临床研究显示,服用替格瑞洛后血清次黄嘌呤和黄嘌呤水平升高,从而导致血清尿酸水平升高[48]。一般认为,高尿酸血症通常程度较轻且可逆。值得注意的是,痛风性关节炎和高尿酸血症与PAD风险相关,PAD患者中高尿酸血症的发生率也升高[49]。
老年人是动脉粥样硬化性心血管疾病的高发人群,也是抗血小板药物不耐受高发人群[50]。衰老所致的胃肠道[51]、肝脏及肾脏等器官储备功能下降,导致药物代谢发生改变[52],更易发生出血事件,并加重75岁以上高龄患者出血事件的预后恶化[53]。英国一项回顾性研究结果显示,服用低剂量阿司匹林(75 mg/d)后,65岁以上人群消化性溃疡穿孔发生率是正常人群的10.1倍[54],即使使用低剂量阿司匹林治疗,其相关的上消化道出血风险也随着年龄的增长而增加[55]。
对冠心病患者而言,GRACE注册研究[56]结果显示,年龄≥ 75岁的ACS患者1年内严重出血事件发生率高达5.3%、全因死亡率9.3%,年龄≥ 85岁分别达到6.6%和18.4%。PEGASUS TIMI 54研究[57]亚组分析显示,替格瑞洛联合阿司匹林对于既往陈旧心肌梗死史的稳定性冠心病患者,年龄≥ 75岁的患者大出血发生率是年龄<75岁患者的2倍。
一项纳入6项随机临床试验研究的荟萃分析显示,年龄是缺血性卒中患者发生严重出血事件的最为显著的预测因素[58]。美国住院人群调查提示,年龄≥ 75岁急性缺血性卒中患者胃肠道出血发生率显著增加[59]。一项荟萃分析显示,DAPT治疗年龄≥ 65岁缺血性卒中或TIA患者中,使用阿司匹林的严重出血风险和颅内出血风险分别增加2.18和2.13倍[60]。此外,在ASPREE研究[61]中,服用阿司匹林与安慰剂相比未能延长健康老人的5年生存期,且显著增加主要出血发生率,其中胃肠道出血增加60%。
血压升高不仅增加血管破裂风险,并且高血压患者出血性卒中的发病率也大大增加。对于非急性卒中或TIA的高血压患者,建议将血压降至正常范围后再按需使用抗血小板药物治疗。HOT研究[62]指出,严重出血事件的增加主要与血压控制不良并应用阿司匹林有关。
肾功能不全会影响患者血小板聚集能力和凝血功能,同时肾脏排泄能力降低又会影响抗血小板药物的代谢。对于ACS患者而言,随着肾功能衰竭的进展,患者缺血和出血风险均显著增加,且可能导致抗血小板药物低反应性的发生[63]。此外,COMPASS研究[64]后继分析发现,大出血发生率与肾小球滤过率(glomerular filtration rate,GFR)水平呈负相关,而阿司匹林与利伐沙班联用将进一步升高PAD患者的出血风险。
目前已知,经常使用阿司匹林的人群,慢性肾功能衰竭风险增加2.5倍,且随着累积剂量增加而增高[65];服用阿司匹林较安慰剂患者的肾功能恶化更显著且更为普遍[66]。此外,对于重度肾功能不全患者,替格瑞洛组的肾脏不良事件发生率显著高于氯吡格雷组[67]。目前尚无研究报道吲哚布芬可引起肾功能损伤或者肾功能恶化。此外,血小板减少症、贫血和血管畸形等也会增加抗血小板药物出血风险,此次共识不作详述。
抗血小板药物治疗低反应性通常指由于不同患者对同一种抗血小板药物的抗血小板作用反应不同,某些患者在治疗后血小板反应性仍较高(血小板功能检测提示血小板活性抑制不足),其发生血栓的风险显著增加;抗血小板药物低反应的机制较为复杂,包括遗传、细胞和临床等因素[68]。
值得注意的是,对于抗血小板药物低反应性人群来说,单纯增加药物剂量并不一定能够带来临床获益,反而会增加出血风险[69]。因此,临床上必须重视对抗血小板药物低反应性人群的识别与处理。为防止抗血小板药物低反应性的发生,已有研究证实了经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)术后患者在血小板功能检测指导下更换P2Y12受体抑制剂的可行性[70,71],提示血小板功能检测指导下的抗血小板药物使用可能会有很大的临床应用前景。
早期研究显示,阿司匹林单药治疗低反应性患者,择期PCI围手术期发生心肌梗死的风险增高2.9倍[72]。但近年来包括ADAPT-DES[73]和ASCET[74]在内的研究表明,在PCI术后接受DAPT的患者中,阿司匹林低反应性与心脏缺血事件并无关联。对缺血性卒中患者而言,阿司匹林单药治疗低反应性将增加卒中的严重程度以及脑梗死面积[75,76],且与梗死面积和卒中严重程度显著相关[21]。一项统计表明,在PAD患者中阿司匹林低反应性和氯吡格雷低反应性的发生率分别高达60%和65%,与冠心病患者相当,且PAD患者阿司匹林低反应性是髂股支架再闭塞和症状性颈动脉疾病患者卒中的重要危险因素,也是预测PAD患者缺血结局的独立危险因素[77]。
CYP2C19基因型与冠心病和缺血性卒中患者的预后具有显著相关性。多项回顾性研究均提示,在服用氯吡格雷的冠心病患者中,携带CYP2C19功能缺失等位基因者与未携带者相比,心血管不良事件的发生率显著升高[78,79,80,81]。TRITON-TIMI 38研究[79]的回顾性分析显示,CYP2C19功能缺失等位基因携带者的心血管复合终点事件(指心血管死亡、非致死性心肌梗死、非致死性卒中)发生率增加53%。而PLATO研究[82]显示,接受氯吡格雷治疗的ACS患者中,CYP2C19功能缺失等位基因携带者与未携带者相比,虽然30 d的主要心血管终点事件发生率明显增高,但是在12个月的随访终点差异无统计学意义。我国一项研究结果表明,携带CYP2C19基因2个多态位点且PCI术后合并血小板高反应性患者临床缺血事件的发生率显著高于未携带或仅携带1个多态位点且非血小板高反应性患者[80]。另有研究结果表明,检测CYP2C19基因多态性可以预测冠心病预后[79,83]。
在氯吡格雷治疗的缺血性卒中/TIA患者中,携带功能缺失等位基因CYP2C19的患者比未携带患者发生卒中和复合血管事件的风险更高[84]。此外,复发性缺血性卒中组患者的CYP2C19*2等位基因概率远高于无复发缺血性卒中组[85]。在氯吡格雷治疗的缺血性卒中患者中,氯吡格雷低反应性患者的缺血性事件发生率显著升高,表明氯吡格雷低反应性是缺血性血管事件的独立危险因素[86]。在PAD患者中,CYP2C19功能缺失等位基因携带者发生缺血事件的风险增加30%[77]。此外,CYP2C19活性降低的患者,其下肢动脉血管介入治疗的1年通畅率显著降低[87]。这些研究结果表明,对于确诊冠心病、缺血性卒中和PAD等高危缺血患者或者预后不良的患者,可考虑行基因检测和血小板功能检测,给抗血小板药物的使用提供综合参考[1,3,88,89,90]。
影响阿司匹林抗血小板作用的因素很多,包括遗传因素(如COX-1基因、血小板糖蛋白Ⅱb/Ⅲa受体基因及P2Y12受体基因的多态性)、药物使用不规范(如剂量不足、依从性差及治疗时间过短)、药物相互作用(如其他NSAIDS竞争性结合COX-1)、合并症(如高龄、慢性肾功能不全、高血压及肥胖)及血小板更新加速(如手术、感染及出血)等[93]。阿司匹林低反应性人群增加阿司匹林剂量并不能改善临床事件,反而增加出血风险[69]。
氯吡格雷在肝脏通过两个步骤进行代谢,主要涉及的药物代谢酶为CYP2C19,其次为CYP3A4。研究证实,CYP2C19基因多态性和CYP2C19受体抑制剂可影响氯吡格雷的抗血小板作用。依据CYP2C19的不同基因型表现,可分为超快代谢型、快速代谢型、中间代谢型和慢代谢型[94]。CHANCE药物基因亚组研究显示,我国超过58%的人群携有CYP2C19功能缺失等位基因(*2,*3)[95]。在亚洲,中间代谢型(约50.0%)和慢代谢型(13.0%~23.0%)的患者比例远远高于欧美国家[96]。携带CYP2C19功能缺失性等位基因(主要为CYP2C19*2)患者可能因体内氯吡格雷活化代谢率下降,不能充分抑制血小板聚集而发生缺血事件。
目前尚无研究表明替格瑞洛、吲哚布芬和西洛他唑存在低反应性的情况。
出现抗血小板药物不耐受的高风险人群包括高龄、低体重、贫血、既往存在胃肠道肿瘤、消化道损伤或出血、HP感染、颅内出血等病史、高尿酸血症及痛风患者等。
对于需要使用抗血小板药物的患者,病史的采集尤其重要,需要重点询问的内容包括年龄、身高、体重、既往是否有脑出血、卒中、肾功能不全、胃肠道出血、胃食管反流或者消化道溃疡及高血压病史(如有高血压病史,需询问是否服用降压药及血压控制情况)、是否存在吸烟及饮酒等不良嗜好、是否有高尿酸血症或痛风病史以及既往是否有大出血病史(特别是既往1年内因大出血的住院史)。
(1)基本检查。血压、心率、血常规、肝功能、肾功能、凝血功能、大便常规+隐血检查应作为抗血小板药物使用前的基本检查项目。(2)尿酸检测。血尿酸水平检测不仅可以明确尿酸代谢情况,也对抗血小板药物的选择具有一定指导意义,应作为抗血小板药物使用患者的常规检查项目。(3 )HP感染检测和胃镜检查。对于存在阿司匹林使用适应证的患者,可考虑进行14C/13C呼气试验,检测是否存在HP感染情况。对于存在消化道症状的患者,若无禁忌证可考虑行胃镜或钡餐等检查,以明确是否是消化道出血的高风险人群。
可考虑行血小板功能检测的患者主要包括行复杂介入治疗的患者,如左主干病变、多支血管病变、桥血管病变及弥漫病变需多枚支架重叠放置;PCI术中出现夹层、无复流等的患者;标准抗血小板治疗下再发血栓事件的患者。此外,对需要更改抗血小板药物的患者,可检测血小板功能以指导P2Y12受体抑制剂的转换。
对于高危缺血风险或者预后较差的动脉粥样硬化性心血管疾病患者,可行氯吡格雷基因多态性检测,以作为P2Y12受体抑制剂的选择参考。
如果因服用阿司匹林产生反酸、恶心及腹胀等消化道损伤症状,可不停用阿司匹林而给予抑酸药或H2受体阻滞剂联合胃黏膜保护剂,也可改用其他抗血小板药物[3,97];如患者发生活动性出血,常需停用抗血小板药物直到出血情况稳定,症状稳定后可根据下述建议考虑改用合适的抗血小板方案。
1.冠心病患者使用SAPT时,可选择长期服用阿司匹林、吲哚布芬、氯吡格雷、替格瑞洛及西洛他唑(心脏功能衰竭者禁用,冠状动脉狭窄者慎用,下同);如具有高危消化道出血风险的患者,可改用吲哚布芬/氯吡格雷/西洛他唑;对于需DAPT同时既往有消化道出血史或具有高危消化道出血风险的冠心病患者(包括老年人和服用华法林、糖皮质激素或者NSAIDS者等),推荐服用质子泵抑制剂(proton pump inhibitor,PPI)1~3个月或H2受体阻滞剂联合胃黏膜保护剂,可将既往DAPT方案改用氯吡格雷联合吲哚布芬/西洛他唑等治疗[97]。
2.对于轻型缺血性卒中或高危TIA患者,在发病24 h内启动DAPT,可选择联用阿司匹林+氯吡格雷,如出血风险较高或阿司匹林不能耐受者,可选用吲哚布芬/西洛他唑+氯吡格雷;持续21 d后改成单药治疗。葡萄糖-6-磷酸脱氢酶(glucose-6-phosphate dehydrogenase,G6PD)缺乏的动脉粥样硬化卒中患者应尽量避免使用阿司匹林。
3.DAPT期间发生消化道出血的患者,在尽快明确出血原因并积极治疗原发病的基础上,应权衡出血和缺血风险决定是否停用抗血小板治疗及何时恢复抗血小板治疗。轻度出血无需停用DAPT,如有明显出血(血红蛋白下降>30 g/L或需要住院治疗,但未引起血流动力学紊乱),可考虑首先停用阿司匹林,如出现危及生命的活动性出血,可停用所有抗血小板药物。病情稳定后,在确保安全的情况下尽快恢复抗血小板治疗,一般3~5 d后恢复氯吡格雷,5~7 d后恢复阿司匹林或者更换为吲哚布芬或西洛他唑。如服用替格瑞洛发生消化道出血的患者,建议停用替格瑞洛,如轻、中度出血可考虑直接换用氯吡格雷,重度出血需停用P2Y12受体抑制剂治疗者,在出血停止后换用氯吡格雷联用吲哚布芬或西洛他唑[97]。
对于之前接受抗血小板治疗的自发性脑出血患者应立即停药,如有必要恢复抗栓治疗时,可于症状改善数天后,优先考虑抗血小板单药治疗,首选出血风险更低的抗血小板药物,如吲哚布芬或西洛他唑。缺血性卒中伴有出血转化患者,可于症状性出血转化病情稳定后10 d至数周后,酌情考虑开始抗栓治疗。75岁以上脑出血患者,建议影像评估出血情况后重启抗栓治疗。
指任何无需药物干预或进一步评估的出血,如皮肤擦伤、瘀斑、自愈性的鼻出血和少量的结膜出血等。建议持续抗血小板药物治疗,可酌情考虑换用低效能P2Y12受体抑制剂、吲哚布芬或西洛他唑[98]。
指任何需要医疗照顾但无需住院的出血。建议持续抗血小板药物治疗,考虑缩短DAPT疗程或换用低效能P2Y12受体抑制剂、吲哚布芬或西洛他唑[98],尤其再次发生出血时;识别与出血相关的并发症(如肾结石、痔疮和肿瘤)并进行可能的治疗。
指任何导致血红蛋白丢失>30 g/L和(或)需要住院治疗的出血,但血流动力学稳定,病情不会快速进展。尽量使用SAPT,优选P2Y12受体抑制剂,认为安全后可根据情况尽快恢复DAPT;考虑缩短DAPT疗程或换用低效能P2Y12受体抑制剂、吲哚布芬或西洛他唑[98],尤其再次发生出血时;识别与出血相关的并发症(如肾结石、痔疮和肿瘤)并进行可能的治疗。
指任何导致血红蛋白丢失> 50 g/L并需要住院治疗的出血,但血流动力学稳定且病情不会快速进展。考虑停用DAPT,继续SAPT,优选P2Y12受体抑制剂、吲哚布芬或西洛他唑[97];对于持续出血或无法治疗时,考虑停用所有抗栓药物;一旦出血停止,再次评估需要DAPT还是SAPT治疗,优选P2Y12受体抑制剂、吲哚布芬或西洛他唑;再次启动DAPT后,考虑缩短DAPT疗程或换用低效能P2Y12受体抑制剂、吲哚布芬或西洛他唑,尤其再次发生出血时;血红蛋白<70~80 g/L时,考虑输注红细胞或血小板,如果可能,行紧急手术或内镜治疗出血源。
指任何威胁患者生命的严重活动性出血。应立即停用所有抗栓药物;一旦出血停止,再次评估需要DAPT还是SAPT,SAPT优选P2Y12受体抑制剂、吲哚布芬或西洛他唑[98];低血压时给予补液,酌情考虑红细胞及时输注,酌情进行血小板输注;如果可能,紧急手术或内镜治疗出血源。
1.ACS合并痛风治疗,应考虑阿司匹林对血尿酸的影响,小剂量阿司匹林(75~325 mg/d)可轻度升高血尿酸,一旦证实阿司匹林增加痛风风险,立即停用阿司匹林,换用吲哚布芬+氯吡格雷等方案。
2.支架置入术后服用DAPT过程中发生痛风,应权衡缺血和痛风危害,可考虑在DAPT基础上合用抗痛风药物,或将阿司匹林换为吲哚布芬或西洛他唑。
3.对于无需DAPT的稳定性冠心病、缺血性卒中或PAD患者,若合并高尿酸血症或痛风,建议优先选择对嘌呤代谢影响小的抗血小板药物,如氯吡格雷、吲哚布芬或西洛他唑。若仍然使用阿司匹林,则建议碱化尿液、多饮水,同时监测血尿酸水平[100]。对于既往高尿酸血症或痛风性关节炎的患者应慎用替格瑞洛,不建议尿酸性肾病患者使用替格瑞洛。
(1)75岁以上的冠心病患者,在没有禁忌证(如活动性出血和既往颅内出血)的情况下,可使用阿司匹林、吲哚布芬、氯吡格雷和替格瑞洛等抗血小板药物作为二级预防用药,长期治疗剂量无需改变。若患者出血风险较高,可以优先使用出血风险较低的吲哚布芬和氯吡格雷等。为预防支架内血栓形成,对于PCI术中成功置入DES的高龄患者,术后DAPT持续至少1年,期间可给予PPI防范消化道出血,或使用吲哚布芬联合氯吡格雷。(2)65岁以上动脉粥样硬化缺血性卒中、TIA或PAD患者进行抗血小板治疗时,可以首先选用阿司匹林或氯吡格雷,若患者出血风险较高,可以改用吲哚布芬或西洛他唑。颅内动脉支架置入术后进行DAPT,至术后3~9个月酌情改为SAPT。可以参考血小板功能或相关基因检测的结果调整抗血小板药物治疗方案。
(1)对于非急性期卒中或TIA高血压患者,建议服用降血压药物,使血压达到目标值后再酌情使用抗血小板药物。对于皮层下小卒中患者长期使用抗血小板药物,可以考虑血压降到130/80 mmHg (1 mmHg=0.133 kPa)以下。(2)降压药物的选择一般无特殊要求,对于合并冠心病的高血压患者,首选降低心血管不良事件、具有明确心血管系统获益的降压药物。(3)对于有高血压病史,目前血压控制已达标的冠心病、缺血性卒中或PAD患者,抗血小板药物的选择应根据病情决定,可选出血风险低的抗血小板药物,如吲哚布芬或西洛他唑。
(1)轻中度肾功能不全[估算肾小球滤过率(estimated glomerular filtration rate,eGFR)为30~90 ml (min·1.73 m2)-1]的患者,推荐阿司匹林、吲哚布芬或西洛他唑;对于ACS患者,可在阿司匹林或吲哚布芬的基础上联合替格瑞洛或氯吡格雷。服用阿司匹林期间需密切监测肾功能变化。(2)重度肾功能不全[eGFR<30 ml (min·1.73 m2)-1]及透析患者,尽量避免使用阿司匹林及替格瑞洛,SAPT方案建议使用吲哚布芬或西洛他唑;对于ACS患者,可考虑吲哚布芬联合氯吡格雷。
对于高危缺血风险或预后较差、高出血风险或已经发生出血的冠心病以及缺血性卒中或PAD患者,可考虑行基因检测和血小板功能检测,作为抗血小板药物使用的参考[68]。对需要更改抗血小板药物的患者,可检测血小板功能以指导P2Y12受体抑制剂的转换。对于高缺血风险同时又进行了复杂PCI手术的患者,在服用氯吡格雷前应进行相应基因检测。
阿司匹林低反应性人群可考虑换用其他抗血小板药物,如吲哚布芬或氯吡格雷;当阿司匹林与P2Y12受体抑制剂合用时,即使血小板功能检测结果提示阿司匹林治疗反应不佳,也不推荐增加阿司匹林剂量(超过100 mg/d)。
氯吡格雷低反应性人群,即对于常规剂量的氯吡格雷治疗无反应或低反应者,尤其是合并糖尿病的患者,不推荐首选增加氯吡格雷剂量,建议换用其他抗血小板药物,如替格瑞洛等;如存在出血高危因素,或因其他原因不能接受P2Y12受体抑制剂治疗,可换用阿司匹林、吲哚布芬或西洛他唑(非心力衰竭或冠状动脉狭窄患者)[68]。
执笔者:张冯筱(华中科技大学同济医学院附属协和医院心血管内科),杨柳(华中科技大学同济医学院附属协和医院心血管内科),邓珊(华中科技大学同济医学院附属协和医院心血管内科),谭泽锋(暨南大学附属第一医院神经内科),王茹璇(中国医学科学院北京协和医院血管外科),王硕(中国医学科学院北京协和医院血管外科)
专家组成员(按姓氏汉语拼音排序):陈跃鑫(中国医学科学院北京协和医院血管外科),陈韵岱(解放军总医院第一医学中心心血管内科),董强(复旦大学附属华山医院神经内科),樊东升(北京大学第三医院神经内科),葛均波(复旦大学附属中山医院心血管内科),谷涌泉(首都医科大学宣武医院血管外科),光雪峰(昆明市延安医院心血管内科),何俐(四川大学华西医院神经内科),何强(浙江省人民医院肾内科),黄恺(华中科技大学同济医学院附属协和医院心血管内科),黄立安(暨南大学附属第一医院神经内科),霍勇(北京大学第一医院心血管内科),李小鹰(解放军总医院第一医学中心老年心内科),林金秀(福建医科大学附属第一医院心血管内科),罗本燕(浙江大学医学院附属第一医院神经内科),罗素新(重庆医科大学附属第一医院心血管内科),毛威(浙江省中医院心血管内科),聂绍平(首都医科大学附属北京安贞医院心血管内科),施海明(复旦大学附属华山医院心血管内科),唐熠达(北京大学第三医院心血管内科),汪昕(复旦大学附属中山医院神经内科),王拥军(首都医科大学附属北京天坛医院神经内科),吴延庆(南昌大学第二附属医院心血管内科),徐安定(暨南大学附属第一医院神经内科),徐运(南京鼓楼医院神经内科),姚朱华(天津市人民医院心血管内科),余再新(中南大学湘雅医院心血管内科),曾春雨(陆军特色医学中心心血管内科),曾进胜(中山大学附属第一医院神经内科),张抒扬(中国医学科学院北京协和医院心血管内科),张运(山东大学齐鲁医院心血管内科),郑月宏(中国医学科学院北京协和医院血管外科),周胜华(中南大学湘雅二医院心血管内科)





























