
报道国内首例真实世界肾动脉神经消融术(renal denervation,RDN ),结合文献回顾评价RDN治疗高血压的有效性及安全性。
患者男性,34岁,高血压史4年,药物治疗血压控制不佳。服用非洛地平缓释片5 mg、1次/d,培哚普利吲达帕胺1片、1次/d,血压仍波动在135~150/70~80 mmHg (1 mmHg= 0. 133 kPa)水平。在排除其他继发性高血压病因后,患者希望接受RDN治疗。2021年4月26日在海南博鳌乐城医疗先行区博鳌超级医院,应用Symplicity Spyral™导管系统,经股动脉入路为患者顺利实施了国内首例RDN治疗(非临床研究)。术后第2天患者即停止服用所有降压药物,其后1个月血压保持在(125±4)/ (81±3)mmHg水平,心率保持在(75±5)次/min。
检索PubMed、中国知网和万方数据库。检索的中文关键词包括"去肾神经""去肾交感神经""高血压",英文关键词包括"renal denervation""renal sympathetic denervation""hypertension"。检索时间截至2021年4月30日。共检索出符合标准的文献2 077篇,经进一步筛选标题及摘要获得关于RDN治疗高血压的临床研究报道及系统回顾470篇。自2009年澳大利亚开展首例RDN治疗开始,至今全球已累计RDN治疗超过10 000例。绝大部分研究显示RDN降压有效,效果持续3年以上,并且安全性良好,极少有严重并发症出现,无手术致死病例。
本病例及众多临床研究显示,RDN具有明确的降压疗效,且安全性良好,将为受困于药物疗法的患者带来新的希望。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
高血压是我国常见的慢性疾病之一,全国有近3亿高血压患者[1]。每年我国因心脑血管疾病死亡约350万人,其中一半以上与高血压相关[2],因而高血压被称为"沉默的杀手"。但是目前我国高血压的治疗状况还非常不理想,与发达国家差距较大。长久以来高血压的治疗主要是通过药物治疗及生活方式的改善,但很多患者面临药物治疗效果不佳,长期药物治疗依从性差、出现药物不良反应、存在用药禁忌、需要终身服药、调药,以及经济负担重等问题,因此亟需药物治疗以外能长期平稳控压的全新治疗方式。肾动脉神经消融术(renal denervation,RDN)是一种通过导管微创介入手术实现降压的革命性创新方法,主要是通过射频能量对分布于肾动脉及紧邻的肾神经进行消融,一定程度上阻断大脑和肾脏之间的神经信号传导,从而降低高血压患者的交感神经兴奋性,调节神经内分泌系统,从而实现一次手术长期平稳降压的效果[3]。RDN技术已经经历了10多年的发展,近期越来越多的临床研究证实了RDN降压治疗的有效性、安全性以及疗效的多样性[4,5,6]。本文报道国内首例真实世界RDN治疗,并结合文献回顾评价RDN治疗高血压的有效性及安全性。
患者男性,34岁,因"发现血压升高4年"就诊,降压药物治疗血压控制不佳。服用非洛地平缓释片5 mg、1次/d,培哚普利吲达帕胺1片、1次/d,血压仍波动在135~150/70~ 80 mmHg (1 mmHg=0.133 kPa)水平,有室性早搏史,否认其他慢性病史。患者通过RDN招募广告主动要求进行RDN治疗,经检查排除继发性高血压及RDN禁忌证。术前24 h动态血压平均值为148/91 mmHg。心脏超声未发现结构或功能改变。肾动脉计算机断层扫描血管造影(computed tomographg angiography, CTA)显示双肾动脉走行正常,右肾动脉直径约6 mm,未见明显充盈缺损、扩张或狭窄。其他主要常规生化检查指标均正常:血红蛋白158 g/L,丙氨酸转氨酶33 U/L,谷草转氨酶25 U/L,总胆红素25.4 μmol/L,肌酐70 μmol/L,尿酸273 μmol/L,血糖5.7 mmol/L,三酰甘油0.56 mmol/L,总胆固醇3.88 mmol/L,高密度脂蛋白胆固醇1.19 mmol/L,低密度脂蛋白胆固醇2.44 mmol/L,血钾4.1 mmol/L,血钠141.0 mmol/L,尿蛋白阴性,醛固酮100.83 pmol/L,肾素活性1.82μg·L-1·h-1,醛固酮肾素活性比值2.00,血管紧张素Ⅱ 9.68 ng/L。患者在充分知情同意后,于2021年4月26日在海南博鳌乐城医疗先行区博鳌超级医院接受RDN治疗。患者术前一般情况:身高183 cm,体重90 kg,心率99次/min,血压155/105 mmHg,体温36.5 ℃。
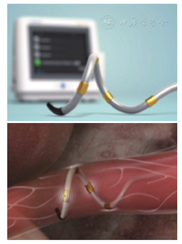
应用美国Medtronic公司Symplicity Spyral导管系统(图1),经股动脉入路实施。患者全身麻醉后,经右侧股动脉入路,使用6 F导管分别对右侧和左侧肾动脉进行造影,明确肾动脉血管走行和分支(图2)。

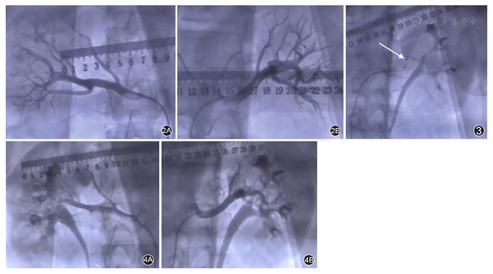

首先对左侧肾动脉进行消融。导丝顺利进入左侧肾动脉分支远端,沿导丝送入Symplicity Spyral导管,4个螺旋形分布的消融电极到位后,退出导丝,检查电极贴靠情况,调整电极贴靠良好后启动消融仪,以8 W功率完成左侧肾动脉的第1次消融60 s(图3)。并继续按由分支到主支,由远及近的顺序,继续完成左侧第2、3、4、5次60 s的消融。按同样策略,继续完成右侧肾动脉共计7次消融。左、右肾动脉合计消融位点48个。
消融完成后,复查双侧肾动脉造影(图4),肾动脉血管未见明显损伤,肾周无造影剂渗漏等,手术顺利结束。术中患者心率及血压平稳。
患者返回病房苏醒后,血压为118/73 mmHg,心率为83次/min,予停服降压药。2 d后患者股动脉穿刺处愈合良好,无其他不适,出院前患者血压为115/68 mmHg,心率为80次/min,术前1天至术后第6天血压、心率变化趋势见图5。术后随访1个月余,患者一直未再服用降压药物,血压保持在(125±4)/ (81±3)mmHg,心率保持在(75±5)次/min。
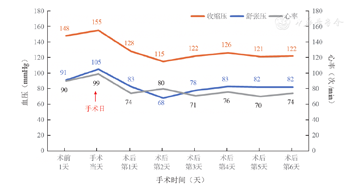

注:患者肾动脉神经消融时间术时间为2021年4月26日
检索PubMed、中国知网、万方数据库。检索的中文关键词包括"去肾神经""去肾交感神经""高血压",检索的英文关键词包括"renal denervation""renal sympathetic denervation""hypertension"。检索时间截至2021年4月30日。共检出符合标准的文献2 077篇,经进一步筛选标题及摘要获得关于RDN治疗高血压的临床研究报道及系统回顾470篇。分析文章显示,自2009年澳大利亚开展首例RDN治疗开始,至今全球已累计RDN治疗超过10 000例。绝大部分研究显示RDN降压有效,诊室收缩压降压幅度一般在10~ 40 mmHg,随访证实降压效果持续3年以上,并且安全性良好,极少有严重并发症出现,无手术致死病例。
本例患者RDN手术降压效果非常好,说明RDN确实对年轻、舒张压高、心率快的原发性高血压患者效果更佳。当前各项RDN临床研究的适应证虽不尽相同,但较既往的标准已经放宽,因为众多研究已充分证实了RDN的安全性,故研究入选不再局限于顽固性高血压,而是扩展到对药物治疗效果不佳,符合条件并且愿意进行RDN治疗的高血压患者。目前美敦力Symplicity SpyralTM导管RDN治疗的适应证为:(1)18岁以上的高血压患者,(2)诊室平均收缩压≥150 mmHg,(3 )愿意接受RDN治疗。排除标准主要包括[7]:(1)肾动脉解剖结构不适合;(2)中度以上的肾功能不全[肾小球滤过率< 45 ml/ (min·1.73 m2)];(3)I型糖尿病;(4)其他明确诊断的继发性高血压;(5)原发性肺动脉高压;(6)植入式心律转复除颤器(implantable cardioverter defibrillator, ICD)或起搏器设置不允许输送射频能量;(7)患者处于妊娠期或哺乳期或计划怀孕;(8)其他严重疾病或疾病急性活动期。接受RDN治疗患者可能的获益包括:(1)完全停服降压药物;(2)减少降压药物的使用;(3)原本控制不佳的血压,在其他治疗方案不做调整情况下,血压控制达标。手术主要的风险包括[8,9]:(1)与其他经股动脉途径介入治疗相似的风险及并发症,如血肿、动静脉瘘、动脉瘤、夹层及穿孔等;(2)肾动脉射频消融相关的风险及并发症,如疼痛、肾动脉痉挛、血肿、狭窄、闭塞及穿孔等;(3)麻醉药物及造影剂过敏等风险。
回顾去交感神经治疗高血压的研究发展历程,最早见诸20世纪初期。1924年,Papin和Ambard[10]首次在人体上进行外科去肾脏神经术,但此方法创伤大、围手术期病死率高,还存在各种远期并发症[11]。后因20世纪60年代新的有效降压药物逐渐问世,这一方式逐渐失去优势,最终彻底淘汰。外科手术虽然已不再广泛使用,但却在临床上证实了肾脏交感神经切除术是一种有效的血压控制手段。随着血管介入微创技术的发展,终于在半个多世纪后,古老的外科手术去交感神经治疗方法通过经皮导管RDN涅槃重生。
从2009年开展Symplicity HTN-1研究[4]到今天,RDN技术经历了10多年的发展。Symplicity HTN-1研究虽然是单臂研究且规模较小,但术后3年随访结果显示了很好的降压效果,患者的收缩压和舒张压分别下降了33 mmHg和14 mmHg。Esler等[5]开展的多中心随机对照试验(randomized controlled trial, RCT)研究(Symplicity HTN-2),术后6个月随访发现RDN治疗组(n=52)平均诊室收缩压下降11 mmHg,而对照组(n=54)平均收缩压仅下降3 mmHg (P<0.05),RDN治疗高血压的疗效得到了进一步的肯定。但是该研究在设计上未使用盲法,未设置假手术组,因此可能存在安慰剂效应。为排除安慰剂效应,Symplicity HTN-3随即开展[12],该研究设计更为完善,采用了随机、假手术对照、单盲的设计方法,并且规模更大。研究共纳入535例顽固性高血压患者,RDN组364例,假手术组171例。术后6个月随访,RDN组和假手术组的平均诊室收缩压分别下降6.8和4.8 mmHg (P=0.98),表明RDN的降压疗效并不显著。Symplicity HTN-3得到的阴性结果无疑为RDN治疗高血压的前景蒙上了一层阴霾。对于Symplicity HTN-3所得到的阴性结果,有学者认为术者技术生疏以及消融设备限制导致术中肾动脉神经消融不彻底是主要原因之一。
第二代RDN设备Symplicity Spyral做出了改进,在消融导管顶端安装了4组电极,呈螺旋形分布,可同时完成绕肾动脉360°的4个位点的消融,使消融更为彻底且快速。同时对于消融靶点研究者,也提出了新的见解,针对肾神经的解剖学特点,将肾动脉主干远端及分支也纳入了消融范围。2017年发表的一项小型临床研究中,消融肾动脉分支(n=25)相比单纯消融肾动脉主干(n=26 ),平均收缩压降低幅度惊人(22.6 mmHg vs. 9.4 mmHg;P=0.03)[13]。这种差异很可能源于肾神经解剖结构特点,组织学研究发现肾动脉近端及中间段的管壁内侧面3 mm内交感神经的累计百分比< 50%,而远端却高达75%。虽然肾动脉近端及中间段交感神经分布比重大,但神经距离肾动脉内膜远,消融时热量难以到达,因此消融不完全;肾动脉远端的神经分布所占比重小,但神经更贴近动脉壁内侧面,因而消融更为彻底[14,15]。在本例手术中,我们正是采用了肾动脉主干加分支血管联合消融的手术理念,对双侧肾动脉进行了充分的消融,消融点位多达48个,因而理论上尽可能地破坏了肾动脉血管壁分布的神经。从患者的显著降压效果来看,该消融理念是较为正确的,这与既往的研究结果也是一致的。
因此,在RDN技术从手术设备到手术理念都发生变革和进步后,一些设计更加精良的RCT研究都取得了不错的结果。2017年美敦力Spyral HTN-OFF MED研究再次为RDN降压的有效性提供了确切的生物学证据。该研究的最大特点是:(1)排除了受试者改变降压药对血压变化造成的干扰;(2)使用Symplicity Spyral多极射频消融导管,使消融更为完全;(3)改进消融手术方式,将肾动脉主干远端及分支也纳入了消融范围,每例受试者的消融点位高达44个,平均每侧肾脏为22个点,主干平均9个点,剩下的消融点都在分支上完成。对入组的80例受试者(RDN组38例,假手术组42例)数据进行中期分析发现,术后3个月,RDN组相比假手术组,24 h平均收缩压和舒张压分别下降5 mmHg (P=0.041 4)和4.4 mmHg (P= 0.002 4),达到预设的目标值(24 h平均收缩压下降≥5 mmHg)[6]。与此同时Spyral HTN ON-MED研究纳入稳定服用1~3种降压药物而血压仍然不达标的患者,结果表明,术后6个月与基线相比,RDN组(n=38)相比假手术组(n=42)平均收缩压降低7.4 mmHg (P=0.005 1),平均舒张压降低4.1 mmHg (P=0.029 2)[16]。该研究进一步肯定了RDN的降压效果,但研究仍具有一定局限性,即样本量相对较小。更大规模的研究正在进行中,计划于2021年下半年公布结果。
同时我们也在术中体会到,对于以Spiral消融导管为代表的射频消融导管,术者操作导管及电极技巧的重要性。是否能利用现有的导管设备,安全顺利地将消融电极尽量置入可进入的所有肾实质以外的肾动脉分支,并且控制好电极的贴靠和阻抗,实现完整的消融,将明显地影响整体的神经消融效果。除了Symplicity Spyral多极射频消融导管消融设备,目前还涌现了其他多种不同原理的消融装置:(1)血管内超声消融设备Paradise(图6A),其导管顶端由圆柱形超声换能器及周边密封水囊组成,因超声波具有良好的组织穿透性,从换能器发出的超声波可穿透球囊内液体到达血管组织,环状线性消融肾动脉交感神经。为避免造成内层血管损害,球囊中循环流动冷水以冷却血管。RADIANCE-HTN SOLO研究比较了超声消融与射频消融的降压疗效,结果显示,术后3个月时超声RDN降压效果明显优于单纯肾动脉主干射频消融,但较肾动脉主干+分支射频消融降压效果差异无统计学意义[17]。今年刚刚揭示结果的多中心随机双盲假手术对照RADIANCE-HTN TRIO研究结果显示,在术后2个月时,与假手术组相比,RDN组的平均动态收缩压降低5.6 mmHg (P=0.016),进一步证明了血管内超声消融对耐药高血压患者的疗效和安全性。这提示超声RDN穿透性较好,消融更为彻底,因而无需进行分支消融。(2)化学消融设备Peregrine(图6B),利用3根微型针头刺破肾动脉,向肾动脉外膜注射无水乙醇以损坏肾交感神经,目前已有小规模研究证实其效果[18],RCT研究正在进行中。(3)由我国自主研发的深低温冷冻消融去肾动脉交感神经系统CryoFocus,以-68 ℃以下低温可造成细胞不可逆损伤为理论基础,通过将液氮作为冷冻载体,采用环面消融(360°消融),消融更加彻底,同时通过冷冻消融的内皮损伤更小,肾血管及周围组织修复快,不易导致血栓形成[19]。目前RCT研究正在进行中。
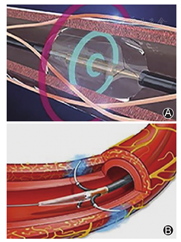

注:A图示Paradise消融导管(美国ReCor Medical公司);B图示Peregrine消融导管(美国Ablative Solutions公司)
RDN在新世纪通过微创导管手术重新面世以来,已经历了10多年的发展历程,不管是对肾神经的解剖及生理功能,还是对神经内分泌体液系统病理生理机制的认识,都已经获得了长足的进展;同时RDN手术适应证、手术原理和方法、设备以及临床试验方案的不断改进和迭代,也使得RDN的疗效越来越好,RDN的多效性也获得了越来越多的关注和研究,虽然还有种种困难和质疑,但随着众多RDN临床试验的不断开展,相信RDN的临床推广指日可待。本病例及众多临床研究显示,RDN具有明确的降压疗效,且安全性良好,将为受困于药物疗法的患者带来新的希望。



























