急性肾损伤(AKI)是一种常见的临床综合征,主要表现为肾功能快速下降及代谢废物的蓄积,其诊断有赖于血清肌酐的升高和尿量减少。目前尚无治疗AKI的特效药物,严重时需进行肾脏替代治疗,因此早期发现和早期防治成为改善患者预后的关键。为加深对AKI的理解,提高AKI的诊疗水平,本文着重介绍AKI的诊断、病理生理及治疗的相关研究进展。

版权所有,未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别申明,本刊看出的所有文章不代表中华医学会和本刊编辑委员会的观点。
本刊为电子杂志,以网刊形式出版。本册应读者需求按需印刷。
急性肾损伤(acute kidney injury,AKI),既往也称为急性肾衰竭(acute renal failure,ARF),是由多种病因导致、涉及多学科的临床常见重症,主要表现为肾功能的快速下降及代谢废物的蓄积。AKI的发病率很高,且呈逐年上升趋势,在住院患者尤其是重症患者中十分常见,增加了死亡风险。根据国际肾脏病学会急性肾损伤"0by25"项目中国地区多中心调查结果估计[1],2013年度我国约290万成年住院患者罹患AKI,其中约70万例死亡。AKI已成为我国巨大的社会和医疗负担,其临床诊疗水平亟待提高。
以往对于AKI的定义和诊断缺乏统一标准,据粗略统计其定义多达30余种,导致其发病率、病死率等流行病学结果存在很大差异,无法比较疗效判定,影响了AKI诊治水平的提高。2002年,急性透析质量倡议(acute dialysis quality initiative,ADQI)首先针对ARF提出了RIFLE分级诊断标准[2]。2005年AKI网络工作组(acute kidney injury network,AKIN)在RIFLE基础上修改制定了新的AKIN标准[3]。对于RIFLE与AKIN两种标准诊断AKI的准确性,国内外做了大量比较研究,结果显示,对于同一患者群体应用两种标准独立诊断AKI,均具有较高漏诊率。因此,改善全球肾脏病预后组织(Kidney Disease:Improving Global Outcomes,KDIGO)在RIFLE和AKIN标准的基础上对2011年2月之前发表的相关文献进行系统回顾,综合循证医学证据,于2012年3月发布了最新制定的KDIGO的AKI临床指南,确立了最新的AKI定义、诊断及分期标准[4]。
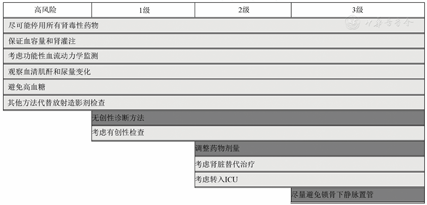
KDIGO指南融合了先前RIFLE标准和AKIN标准的各自优点,目的是能早期诊断AKI并且降低漏诊率。该标准仍采用血清肌酐(serum creatinine,Scr)和尿量作为主要指标,符合以下情况之一者即可诊断AKI:①48 h内Scr升高≥26.5 μmol/L(0.3 mg/dl);②Scr升高超过基础值的1.5倍及以上,且明确或经推断上述情况发生在7 d之内;③尿量减少<0.5 ml/(kg • h),且时间持续6 h以上。KDIGO指南将AKI分为3期(表1),当患者Scr和尿量符合不同分期时,采纳最高分期。KIDIGO标准是否能更好地指导临床工作仍有待进一步研究验证。
根据病因和发病机制的不同,可大致将 AKI分为肾前性、肾性和肾后性。肾前性AKI主要与血容量减少,有效动脉血容量减少和肾内血流动力学改变导致的肾脏灌注不足有关;肾后性AKI通常是由肾盂到尿道任一水平的急性尿路梗阻引发;肾性AKI是指肾实质损伤导致的AKI。这3大类AKI在临床上常相互混杂,使疾病更加复杂,多数情况下AKI发生可能是多种因素共同作用的结果。
主要由肾脏灌流不足引起,尽快补足血容量,改善肾灌注后,氮质潴留情况可很快消失,可逆性很强,故也称为"肾前性氮质血症"(pre-renal azotemia,PRA);但PRA若持续较久,也可因肾小管缺血导致急性肾小管坏死(acute renal necrosis,ATN),预后明显恶化。Rachoin等[5]的研究表明,ICU中伴发AKI的患者以及血尿素氮(blood urea nitrogen,BUN)/Scr比超过20:1的患者病死率较高,提示肾前性氮质血症的存在并不是患者在进入ICU后才开始出现的。
肾性AKI是肾实质损伤的直接后果,可逆性差,预后也远较其它两种类型的AKI差。根据其发病机制及病理特征又可分为四亚型,即急性肾小管堵塞(acute tubular obstruction,ATO)、急性肾小管坏死(acute tubular necrosis,ATN)、急性肾小球肾炎(acute glomerulonephritis)、急性肾间质肾炎(acute interstitial nephritis,AIN),其中ATN是肾性AKI的最常见形式,几乎达到全部AKI患者的88 %。临床上常见的类型有缺血性AKI、脓毒症性AKI、造影剂相关AKI等。
其发病与损伤机制显著不同于缺血性AKI:①脓毒症性AKI患者或动物的肾血流量(renal blood flow,RBF)并不一定减少,甚至可以见到RBF增加,提示RBF减少不是AKI发生的必要条件。这种"RBF与肾功能分离现象"可能与肾内分流和出球小动脉舒张有关[6]。②肾内血流动力学与全身血流动力学的变化并不总是保持一致。严重脓毒症状态下,全身性血管阻力降低,而脓毒症性AKI表现为肾血管阻力增加,提示全身性血流动力学参数不能反映肾内血流动力学的状况。③全身炎症反应和肾内炎症反应是脓毒症性AKI最重要的发病机制。脓毒症性AKI患者肾组织活检发现,肾小球毛细血管内皮受损、广泛的微血管栓塞和肾间质中性粒细胞浸润[7];在脓毒症性AKI动物模型中,采用超氧化物歧化酶清除剂等抗氧化剂或TLR-4拮抗剂早期阻断炎症反应,在全身性血压没有升高的情况下,肾皮质毛细血管灌注、RBF和肾小球滤过率(glomerular filtration rate,GFR)增加,实验动物生存率改善[8]。这些研究结果提示,促炎因子可致肾脏直接或间接损害,早期阻断炎症反应可预防肾损伤。因此有理由推测,部分脓毒症性AKI患者RBF的下降可能是炎症性肾小管损伤的结果。血流动力学紊乱和RBF减少可以诱发AKI,但对于没有严重血流动力学紊乱的脓毒症性AKI患者,很可能是炎性肾小管损伤发生在前,随后表现为RBF的下降。④严重脓毒症可以导致强制性毛细血管漏、腹腔内压升高和肾间质水肿,导致肾小球囊内压升高和有效滤过梯度下降,GFR随之下降,肾功能受损。⑤缺血性AKI的病理改变以ATN为主要表现,较少见到肾小管上皮细胞凋亡,而脓毒症性AKI恰好相反[9]。
尽管CI-AKI的发病机制尚不清楚,但越来越多的证据表明,其发病与肾小管酸中毒、氧化应激、缺血性损伤和肾小管梗阻等因素的综合作用有关。造影剂应用后尿量增多,使肾小管管内压力和血管周围静水压增高,导致肾髓质血流降低而致髓质缺氧;且作用于血管的物质(如腺苷和内皮素与一氧化氮和前列腺素)比例失调引发肾血管收缩而导致肾脏缺血。更值得注意的是,造影剂导致的尿量增加使肾脏处于高渗透负荷,导致肾近端小管细胞肿胀、液化可进一步加重肾损伤。CI-AKI是一项医源性并发症,有着高发生率和病死率,所以进一步明确其发病机制,对CI-AKI的治疗有着重要意义。
由于目前尚无有效药物可减轻肾脏损伤或促进组织恢复,因此AKI的病情评估和早期防治至关重要,并应根据AKI病程进行治疗调整。
AKI患者应尽可能保持血流动力学稳定,保持有效肾脏灌注,从而避免肾脏损伤的进一步进展,促进肾功能恢复。KIDGO指南建议对于存在AKI风险或已经发生AKI的患者,在没有失血性休克的证据时,应使用等张晶体补液而非胶体补液(白蛋白,羟乙基淀粉)进行扩容治疗。当然,对于一些需要大量液体才能达到容量复苏的患者,或某些特殊患者如出现自发性细菌性腹膜炎的肝硬化患者或烧伤患者,可以适当使用一些胶体液。
对存在AKI风险或已经发生 AKI的血管收缩性休克的患者,在补液同时可以联合使用升血压药物。临床上常用的升压药物包括多巴胺、去甲肾上腺素或特里加压素等,目前没有临床证据能够说明哪种血管活性药物更佳。但是,恰当的使用血管活性药物能够改善容量复苏的血管动力性休克患者的肾脏灌注。
围手术期或脓毒性休克的高危患者,建议参照既定的血流动力学和氧合参数管理方案,以避免AKI进展或恶化。2001年,Rivers等[12]首先提出了早期目标靶向治疗(early goal directed therapy,EGDT)的液体治疗方案,在感染性休克的患者中给予EGDT,预先设定治疗目标,能够预防脏器衰竭,改善患者的预后。
营养不良是AKI患者病死率的独立危险因素,AKI患者的营养治疗非常重要,建议优先选择肠内营养,给予充足的热量20~30 kcal/(kg•d),不建议为预防或延迟肾脏替代治疗(renal replace treatment,RRT)而限制蛋白摄人,无需RRT的非高分解代谢AKI患者,推荐的蛋白质摄入量为0.8~1.0 g /(kg•d);需要RRT的患者为1.0~1.5 g /(kg • d);行连续性肾脏替代治疗(continuous renal replacement therapy,CRRT)且伴高分解代谢的患者蛋白质最高摄人量为1.7 g /(kg • d);脂肪摄入量 0.8~1.0 g /(kg • d);葡萄糖摄入量3~5 g /(kg • d),对高血糖的患者建议应用胰岛素控制血糖在1 100~1 490 mg/L。CRRT治疗每日将丢失氨基酸10~15 g,应注意补充。推荐补充谷氨酰胺,促进正氮平衡,保护胃肠功能,长期禁食或使用广谱抗生素的患者应注意补充维生素K,预防凝血功能障碍。此外,RRT将导致氨基酸、支链脂肪酸及水溶性维生素的丢失,应给予适当的补充。
无尿是AKI患者的常见临床表现,因此临床上AKI患者经常使用利尿药。但是近期临床研究发现,呋塞米对AKI患者不仅没有治疗益处,反而增加患者的病死率[13,14]。因此,对于AKI患者应慎用利尿剂。除用于控制容量超负荷,不建议使用利尿剂预防或治疗AKI。
药物性肾损害是AKI的重要原因之一,中国一项10年内住院患者AKI调查结果显示,39.6 %的AKI与药物应用有关,是住院患者AKI的第一位原因[15]。许多抗生素、抗真菌药和抗病毒药均具有一定的肾毒性。因此,临床医生对于各种感染的患者,既要积极控制感染,又要兼顾药物毒性,不要顾此失彼。
建议不要使用氨基糖苷类药物治疗感染,除非没有其他可替代的、合适的、相对肾毒性更小的药物。肾功能正常且稳定的患者,氨基糖苷类药物治疗应采用每日单次剂量,而不是每日多次剂量的治疗方式。对每日多次剂量给予氨基糖苷类药物超过 24 h的患者以及每日单次剂量给予氨基糖苷类药物超过48 h的患者,应监测氨基糖苷类药血药浓度。氨基糖苷类药物应该只能用于治疗重症感染,使用时间尽可能短。
为避免两性霉素B的肾毒性,建议使用两性霉素B脂质体,而非普通两性霉素B。在同等疗效的前提下,推荐唑类抗真菌药和/(或)棘白菌素类药,治疗系统性真菌病和寄生虫感染。
①血管扩张剂:由于缺乏足够的证据显示血管扩张剂对防治AKI存在益处,为了避免血管舒张剂对于高危患者可能出现的低血压和其他害处,不推荐使用多巴胺、非诺多巴以及心房利钠肽等血管舒张剂来防治AKI。②生长因子:目前的 3项有关重组人胰岛素样生长因子的随机对照研究均显示为阴性结果,考虑到生长因子可能的副反应及昂贵费用,不推荐使用。③腺苷受体拮抗剂:目前只有在围产期缺氧的研究中显示,茶碱(非选择性腺苷受体拮抗剂)能够显著改善新生儿第1周的肾功能,但是对于肾功能的完全恢复以及患者的生存率没有显示出益处。严重围产期窒息、具有AKI高危因素的新生儿,建议给予单剂量茶碱治疗。
明确 AKI的原发疾病,并给予积极治疗是促进肾功能恢复和防治AKI转变为慢性肾衰竭的关键。在治疗AKI过程中,应积极防治严重水、电解质和酸碱平衡失调,有效控制感染,防治急性呼吸衰竭和急性心功能衰竭,这是有效降低AKI患者病死率的关键。
AKI患者RRT的目的是维护水、电解质和酸碱平衡及机体内环境稳定,提供重要脏器的功能和生命支持,促进肾脏恢复功能,并使其它治疗不受限制。目前,对于RRT的起始时机、剂量、停止标准等均没有定论,特别缺乏我国患者的证据,迫切需要开展相应的大样本临床随机对照研究。
RRT的起始时机主要取决于进行RRT的目的和预期可能获得的疗效。KDIGO指南指出,当患者出现危及生命的水、电解质及酸碱平衡紊乱时,应紧急开始RRT;如无急诊RRT指征,是否开始RRT应全面考虑患者的临床背景,是否存在能被RRT改善的病情,综合实验室检测结果的变化趋势,而不应仅仅依据血清肌酐和尿素氮的水平来决定RRT的时机。
在临床工作中,单纯AKI患者达AKI 3期、并发重症疾病的AKI患者达AKI 2期时即可行RRT治疗。如果导致AKI的基础疾病改善或者肾功能有恢复的早期迹象可暂缓RRT。脓毒症、重症急性胰腺炎、多脏器功能障碍等重症患者应及早开始RRT治疗。
CRRT和间断性血液透析(intermittent hemodialysis,IHD)均可以作为AKI患者的补充治疗手段,选择IHD还是CRRT一直是临床研究热点。相关研究显示,IHD较CRRT增加术后并发AKI患者的死亡风险[16];CRRT较IHD更有利于ICU发生AKI患者的肾功能恢复[17];与 IHD相比,CRRT治疗时患者的平均动脉压更高,需要升压药更少,更具备维持血流动力学稳定性的优势[18]。但近来临床研究发现,CRRT和 IHD治疗AKI疗效,无论是患者院内病死率、ICU中病死率,还是住院时间比较均无统计学差异[19]。
一般而言,对于单纯AKI患者可选择IHD或腹膜透析;而对于重症AKI患者推荐选择CRRT。KDIGO指南指出,对于血流动力学不稳定、伴有颅内压升高或弥漫性脑水肿的的AKI患者,建议使用CRRT。
RRT治疗剂量的设定应依据治疗目的、患者的代谢状态、营养支持的需求、患者残存肾功能、心血管状态以及血管通路和血流量状况、有效治疗时间等综合考虑。KDIGO指南指出,在每次肾脏替代治疗前都应该确定治疗剂量,并且经常评估实际的治疗剂量以便进行调整。
关于AKI的RRT治疗剂量,目前尚存争议。2000年和2006年的研究显示,增加治疗剂量可以明显改善AKI患者生存率[20,21];但后来众多大样本研究却表明强化治疗没有降低AKI患者的病死率[22,23]。近期发表的IVOIRE研究[24]共纳入了18个ICU的140例感染性休克合并AKI的患者,对比高容量血液滤过[70 ml/(kg • h)]与标准剂量血液滤过[35 ml/(kg • h)]对患者的临床疗,结果表明高容量血液滤过并不能改善患者的28 d病死率、血流动力学及器官功能。IVOIRE研究结果与先前发表的ATN研究[22]和RENAL研究[23]结果一致。目前推荐的治疗剂量为20~25 ml/(kg • h)或者Kt/V=3.9/w,而为了达到实际治疗剂量,通常需要根据患者之前的RRT情况制定更高的目标治疗剂量。
当不再需要RRT时即可停止,如内在肾脏功能已恢复至足够满足患者的求要,或RRT不再符合治疗目标。因此,如果在不应用利尿剂的前提下,患者尿量恢复至1500 ml/d以上应停止RRT;但某些重症患者虽然尿量≥1500 ml/d,但停止RRT后肾功能仍不能恢复,则此类患者应进行维持性肾脏替代治疗。此外,利尿剂可能能够提高 RRT后的尿量,但目前的证据显示其对于减少 RRT或促进肾功能恢复没有明显益处。因此,建议不要使用利尿剂来促进肾脏功能的恢复,或用以减少肾脏替代的持续时间或频率。
综上所述,AKI因其发病率和病死率均居高不下,一直是临床关注的热点。在当前缺乏有效AKI治疗药物的情况下,早期发现和早期防治成为改善患者预后的关键。近年来AKI概念和诊断标准有较大的发展,其定义和分期标准不断被更新并趋于统一,为AKI的早发现、早诊断、早干预提供了有效保障。但是,应用AKI的分期标准,包括最新的KDIGO指南来指导临床干预,还需要更多的随机对照实验研究结果来提供循证依据。目前,我国还缺乏大规模的AKI流行病学数据,国外指南是否适合中国AKI患者还需要多中心、大样本的随机对照临床研究进行验证。