
版权所有,未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别申明,本刊刊出的所有文章不代表中华医学会和本刊编辑委员会的观点。
本刊为电子杂志,以光盘形式出版。本册应读者需求按需印刷,随光盘免费赠阅,光盘如有质量问题,请向编辑部调换
男性患者,46岁。因上腹疼痛半年、加重1个月入院。患者反复发作持续性上腹胀痛半年,向后背部放射,伴恶心、腹胀、持续疼痛伴阵发加剧,外院多次查血清淀粉酶(serum amylase,AMY)偏高(具体数值不祥),腹部超声提示胰腺增大,胰腺炎可能性大,考虑急性胰腺炎,予禁食、生长抑素、营养支持等治疗后仍反复发作,且症状加重1个月。体重半年来下降10 kg。入院前外院腹部增强CT(contrast-enhanced computed tomography,CECT):胰头部可见低密度占位,边缘模糊,内有血管包绕,主胰管扩张,考虑胰腺癌可能性大。
入院后查血常规、肝、肾功能均正常,胰功血淀粉酶136 U/L,脂肪酶266 U/L。复查超敏C反应蛋白(hypersensitive C-reactive protein,hsCRP):20.14 mg/L;红细胞沉降率(erythrocyte sedimentation rate,ESR):49 mm/h,感染4项及肿瘤标志物均阴性。免疫学相关指标类风湿因子(rheumatoid factor,RF)、抗链球菌溶血素O(anti-streptolysin O,ASO)、补体3(complement 3,C3)、补体4(complement 4,C4)正常,血清免疫固定电泳(A+G+M)呈阴性,抗核抗体谱(antinuclear antibody,ANA)18项阴性,抗中性粒细胞胞浆抗体谱(antineutrophil cytoplasmic antibody,ANCA)3项:抗髓性过氧化物酶抗体(IgG型,myeloperoxidase antineutrophil cytoplasmic antibody,MPO-ANCA):61 RU/ml,抗乳铁蛋白抗体(IgG型,lactoferrin anti-neutrophil cytoplasmic antibody,IF-ANCA):(+)P1:10,抗蛋白酶3抗体(IgG型,protease 3 antibody antineutrophil cytoplasmic antibody,PR3-ANCA):阴性。免疫科会诊意见:患者虽然MPO-ANCA阳性,ESR升高,但缺乏ANCA相关小血管炎(ANCA-associated vasculitis,AAV)常见特异性临床表现,且ANCA阳性可见于肿瘤,不考虑血管炎。
超声内镜检查提示:胰头不规则低回声,内部回声不均匀,与脾静脉关系密切;胰周可见不规则肿大淋巴结。胰头占位穿刺涂片可见淋巴细胞、导管上皮细胞、腺泡细胞及纤维间质碎片,未见瘤细胞(图1)。胰腺超声检查可见胰腺头体交界处6.1 cm×5.3 cm×4.4 cm低回声区(图2,图3),形态不规则,边界不清,彩色多普勒未见明确异常血流信号;该低回声区将肠系膜上动脉包绕于内,管腔略细,血流通畅。余胰腺腺体回声不均伴钙化及胰管稍宽(图4),脾静脉闭塞。
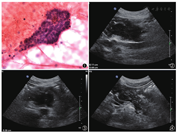

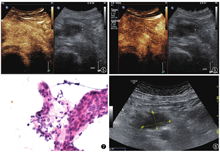
超声造影示:胰头低回声于动、静脉期均呈同步增强及减退(图5,图6),考虑炎性病变可能性大。

腹盆CECT、胰腺薄扫及重建:胰腺及胰周异常所见,可能为炎性改变,建议密切随诊除外占位性病变。门静脉主干、脾静脉闭塞,肠系膜上静脉近段闭塞;脾动脉管腔变窄,肠系膜上动脉近中段管腔明显变细;胰周、系膜上及腹膜后多发淋巴结,部分增大;胆总管下段被包绕,壁强化增高;胰管略扩张;胰体尾周围渗出物。
正电子发射型计算机断层显像(positron emission computed tomography,PET/CT):胰头区软组织肿块,代谢异常增高,胰头周围代谢增高淋巴结,双肺上叶及右肺下叶背段斑片样代谢增高,建议首先除外IgG4相关疾病;胰腺体尾部代谢增高灶,考虑炎性改变可能性大。完善患者血清IgG亚类测定(4项):IgG3:18.4 mg/dl,IgG4 188 mg/dl(正常值8~140 mg/dl)。血清IgG4偏高,但低于正常值两倍,临床意义有限,因约5%的正常对照和10%的胰腺癌患者血清IgG4水平也升高,故仍不能明确诊断自身免疫性胰腺炎(autoimmune pancreatitis,AIP)[1]。且CT复查提示该占位病变体积较前增大,因而又先后两次行超声引导下经皮胰头占位病变细胞学穿刺,病理诊断均未见瘤细胞(图7)。
鉴于胰头肿物3次穿刺病理均未见瘤细胞,且复查CA19-9(-),IgG4升高至287.9 mg/dl,随着病情进展,患者出现门静脉血栓伴门脉主干旁海绵样变性、侧支循环形成,临床诊断为肿块型自身免疫性胰腺炎可能性大,但恶性占位病变待除外,故给予激素实验性治疗后患者ESR、hsCRP下降,疼痛症状明显改善。3个月后超声复诊,肿块体积较前明显减小(图8),IgG4 63.9 mg/dl。目前随诊3年,患者一般情况较好,病灶较前明显减小。
AIP是由自身免疫介导、以胰腺肿大和胰管不规则狭窄为特征的一种特殊类型的慢性胰腺炎。其确切的发病机制尚不明确。1995年Yoshida等[2]首次提出了AIP的新概念,目前认为AIP是IgG4相关系统性疾病在胰腺的表现,胰腺外的其他器官也可受累。国际针对AIP的共识诊断标准于2011年发布,将AIP划分为两种类型:类型1,主要发生在老年男性(平均年龄60岁),常与Sjögren综合征、胆管狭窄相关,大部分IgG4水平升高;类型2,常见于较年轻患者(平均年龄约40岁),男女发病率无明显差异,常与炎性肠病相关,IgG4水平一般不升高,依赖病理诊断[3]。AIP典型的组织学表现是淋巴浆细胞浸润伴组织纤维化和免疫组化IgG4阳性细胞浸润[4]。临床表现较复杂,可表现为急性、慢性胰腺炎的症状。目前AIP患者是否更易患胰腺癌仍存争议[3]。AIP的超声表现具有一定特征性,本例基本符合其一般特点。
二维超声:AIP可为弥漫型和局灶型,前者较多见,约占AIP的70%,典型征象为"腊肠样"改变,回声减低、增粗,内部可见纤维化样高回声斑点,主胰管弥漫性变细或局限性狭窄,主胰管远端扩张。局灶型AIP也不罕见,表现为局灶型肿大,呈肿物样低回声,与胰腺癌较难鉴别。同时可能伴有胆总管壁增厚,但钙化和囊肿较罕见[5]。
超声造影:弥漫型AIP的超声造影增强早期及晚期均表现为弥漫性、中等强度的增强。局灶型AIP的超声造影多表现为肿物与胰腺实质同步增强、同步减退,且呈均匀增强或稍高增强,部分可在40 s后清晰显示肿块内血管结构及分布密度[5]。
鉴别诊断:本例患者为中年男性,胰头区实性低回声,体积较大,无囊性区域,根据形态及临床特点需与常见的胰腺癌和无功能的胰腺神经内分泌肿瘤相鉴别。胰腺导管腺癌二维超声多表现为形态不规则低回声,与周围组织分界不清,胰管突然截断、远端明显扩张,远端胰腺可以萎缩,伴肝转移及淋巴结转移等,胰周重要血管常被包绕并侵犯,失去正常形态,部分血管内可探及低回声瘤栓。超声造影大多数胰腺导管腺癌呈低增强,增强强度低于正常胰腺实质,静脉期廓清较快,这与本例病变的动、静脉期与胰腺实质同步增强与减退明显不同,可以相鉴别。神经内分泌肿瘤多边界清晰,超声造影常表现为动脉期均匀高增强,增强强度高于胰腺实质,静脉期逐步减退。部分体积较大的无功能神经内分泌肿瘤因坏死囊性变表现为不均质高增强,这与本例的超声增强模式不同,可以相鉴别[6]。
由于AIP主要依赖于激素治疗,而胰腺癌则主要通过手术治疗以及放化疗等,二者的治疗方式截然不同,因此开展非侵入性检查以区分AIP和胰腺癌具有重要的临床意义[6]。同时,超声造影可以观察AIP血管分布密度在类固醇治疗前后的变化情况,也是评价类固醇治疗是否有效的良好指标之一[5,7]。
复习此例注意到,虽然血清IgG4水平升高对于诊断AIP是特征性的[1,4],但Raina等的研究中多达7%的胰腺癌患者血清IgG4水平高于135 mg/ dl(144.1~194.0 mg/dl,平均160.9 mg/dl)[8]。在Ghazale等[1]的研究中约5%的正常对照和10%的胰腺癌患者血清IgG4水平超过140 mg/dl,约53% AIP患者和1%的胰腺癌患者IgG4水平>280 mg/dl[1]。同时也偶见胰腺癌合并AIP的病例报道[9,10]。故而AIP的临床诊断需谨慎,既不能因误诊为恶性而盲目手术,又要避免因炎性病变漏诊恶性病灶,常需依赖穿刺活检取得可靠诊断。





























