
探讨血清一氧化氮(NO)的变化和肾小管上皮细胞Bax在大鼠肾缺血再灌注(IR)损伤中表达的意义。
将Sprague-Dawley大鼠48只随机分为IR组(n=40,并根据IR时间,进一步分为IR 2 h组,IR 6 h组,IR 12 h组,IR 24 h组,IR 72 h组,每组8只)和对照组(n=8)。用无损伤动脉夹钳夹大鼠双侧肾蒂45 min制成肾IR损伤模型。对照组只暴露双肾,不钳夹肾蒂。观察IR后2 h,6 h,12 h,24 h和72 h血清NO水平变化和以上各时间点肾小管上皮细胞Bax及细胞凋亡的改变。
对照组血清NO水平较IR组低,IR 2 h组NO水平开始升高[(90.470±10.222) μmol/L],IR 12 h组达最高峰[(137.864±22.317) μmol/L],之后逐渐下降,IR 72 h组尚未降至正常水平。IR 12 h组血清NO水平与对照组比较,差异有统计学意义(P<0.01)。IR组血清肌酐(Scr)水平较对照组明显升高,以IR 12 h组Scr水平达最高峰[(120.850±22.237) μmol/L],与对照组比较,差异有统计学意义(P<0.01)。对照组肾小管上皮细胞Bax(2.450±0.639)及细胞凋亡水平[(0.900±0.385)个/视野]较低,IR 2 h后各值均逐渐升高[15.400±3.474,(8.725±1.313)个/视野],12 h达峰值[69.025±6.550,(26.850±1.476)个/视野],IR 12 h肾组织病理改变最严重。
IR后,血清NO及肾小管上皮细胞Bax水平增高,诱导肾小管上皮细胞凋亡。

版权所有,未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别申明,本刊刊出的所有文章不代表中华医学会和本刊编辑委员会的观点。
本刊为电子杂志,以光盘形式出版。本册应读者需求按需印刷,随光盘免费赠阅。光盘如有质量问题,请向编辑部调换。
缺血再灌注(ischemia reperfusion, IR)损伤是近年来备受医学界学者关注的问题。肾IR损伤是常见的组织器官损伤之一,在严重感染、创伤、休克、心肺功能不全、器官移植等疾病的病理演变过程中起重要作用。IR可使肾脏组织发生一系列代谢、结构和功能损伤,重者可致肾功能衰竭,是影响疾病预后和患者存活的主要因素之一。肾IR损伤的病理机制异常复杂,因此,探讨其病理机制具有重要的临床意义。本研究采用大鼠肾IR模型,通过检测血清一氧化氮(nitric oxide,NO)水平、肾Bax和细胞凋亡的表达,探讨肾IR损伤的发病机制。现将研究结果,报道如下。
选择健康、雄性Sprague-Dawley大鼠48只为研究对象,体重为(100~120)g(购于贵阳医学院实验动物中心),置于18℃~22℃实验室安静饲养(5~7)d,标准饮食,自由饮水。将其随机分为IR组(n=40,并继续分为IR 2 h组,IR 6 h组,IR 12 h组,IR 24 h组及IR 72 h组,每组各8只)和对照组(n=8)。
以腹腔注射2%戊巴比妥钠[中国医药(集团)上海化学试剂公司生产](30~40)mg/kg的方式麻醉两组大鼠,在无菌条件下行腹部正中线切口,钝性分离组织。对IR组大鼠使用无损伤动脉夹钳夹双侧肾蒂45 min,造成肾IR损伤动物模型(实验过程中动物体温维持在约37℃),分别于IR 2 h,6 h,12 h,24 h和72 h,于股动脉采血,处死动物后迅速摘取左侧肾脏,用中性福尔马林固定后作组织病理学切片。对照组大鼠仅暴露双侧肾脏,不钳夹肾蒂。
采用硝酸还原酶(nitrate reductase)法检测血清NO水平。NO试剂盒购于晶美生物工程有限公司,操作严格按照试剂盒说明书进行。因NO化学性质活泼,与分子氧反应生成NO2,很快转化为NO3-和NO2-,采用硝酸还原酶法可特异性地将NO3-还原为NO2-,NO2-与显色剂作用生成有色物质,通过显色深浅测定其浓度,并在721紫外分光光度计上选择530 nm波长,0.5 cm比色杯,空白管调零,读取吸光度(optical density,OD)值后,NO浓度(μmol/L)=测定管OD值/标准管OD值×100。
采用免疫组化二步法检测肾小管上皮细胞Bax表达水平。试剂盒购于北京中杉金桥生物技术有限公司,操作严格按照试剂盒说明书进行。操作步骤为,脱蜡、水化、组织切片后,置于新鲜配置3%H2O2中10 min,以阻断内源性过氧化物酶,双蒸水冲洗后将切片浸入pH值为6.0的0.01 mol/L枸橼酸盐缓冲液修复抗原,PBS冲洗,滴加一抗Bax(1∶75稀释于0.01 mol/L PBS中),37℃水浴箱孵育40 min,PBS冲洗,滴加通用型IgG抗体(Fab段)-HRP多聚体,37℃水浴箱孵育15 min,PBS冲洗,应用DAB溶液显色,苏木精复染,烘干、中性树胶封固。
采用肾组织原位细胞凋亡标记法(TUNEL)检测肾小管上皮细胞凋亡,试剂盒购于北京中杉金桥生物技术有限公司,操作严格按照试剂盒说明书进行。操作步骤为,石蜡切片常规脱蜡、脱水;蛋白酶K室温孵育20 min,PBS冲洗2次×10 min/次;滴加50 μL TUNEL反应混合溶液,37℃孵育60 min,PBS冲洗3次×10 min/次;加入50 μL POD转化剂,37℃孵育30 min,PBS冲洗3次×10 min/次;滴加100 μL DAB底物溶液,37℃孵育30 min,PBS冲洗3次×10 min/次;苏木素衬染,封片,光学显微镜下观察。Bax阳性细胞和凋亡阳性细胞着色呈棕黄色;采用Biomias99图像分析系统(四川大学图像图形研究所设计)进行图像分析。在40×10倍光学显微镜下,通过SONY摄像头(SONY公司,日本)采集实验大鼠的组织免疫组化图像,并输入该图像分析系统进行图像分析。每张切片随机选取5个区域(视野),计数阳性细胞数,最后取其平均值。
血清肌酐(serum creatinine,Scr)的检测应用Beckman全自动生化分析仪(贝克曼库尔特公司,美国)采用酶法进行检测。
本研究数据采用SPSS 12.0统计学软件包进行统计学处理,呈正态分布结果采用 ±s表示,组间差异采用单因素方差分析;方差齐性采用LSD法,方差不齐采用Games-Howell法。以P<0.05示差异有统计学意义。
±s表示,组间差异采用单因素方差分析;方差齐性采用LSD法,方差不齐采用Games-Howell法。以P<0.05示差异有统计学意义。
各组大鼠血清NO和Scr水平比较(表1)。
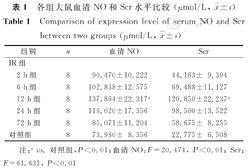
各组大鼠血清NO和Scr水平比较(μmol/L, ±s)
±s)
Comparison of expression level of serum NO and Scr between two groups(μmol/L, ±s)
±s)
各组大鼠血清NO和Scr水平比较(μmol/L, ±s)
±s)
Comparison of expression level of serum NO and Scr between two groups(μmol/L, ±s)
±s)
| 组别 | n | 血清NO | Scr | |
|---|---|---|---|---|
| IR组 | ||||
| 2 h组 | 8 | 90.470±10.222 | 44.163± 9.394 | |
| 6 h组 | 8 | 102.838±12.575 | 69.488±11.127 | |
| 12 h组 | 8 | 137.864±22.317a | 120.850±22.237a | |
| 24 h组 | 8 | 116.020±17.356 | 98.500±13.522 | |
| 72 h组 | 8 | 85.071±11.204 | 58.675± 8.255 | |
| 对照组 | 8 | 73.980± 8.356 | 22.775± 6.508 | |
注:avs.对照组,P<0.01;血清NO:F=20.474, P<0.01; Scr:F=61.631, P<0.01
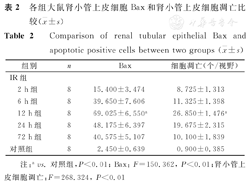
各组大鼠肾小管上皮细胞Bax和肾小管上皮细胞凋亡比较(表2)显示,对照组肾小管上皮细胞Bax仅见少量表达,IR 12 h组肾小管上皮细胞Bax水平最高,之后逐渐下降,IR 72 h组尚未降至正常水平(图1、图2)。肾小管上皮细胞凋亡在IR 12 h组最为明显(图3、图4)。
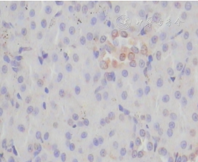
The expression of Bax protein in control group

The expression of Bax protein in control group
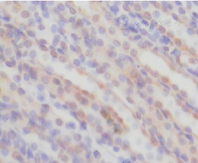
The expression of Bax protein in renal ischemia reperfusion operation group for 12 h group

The expression of Bax protein in renal ischemia reperfusion operation group for 12 h group
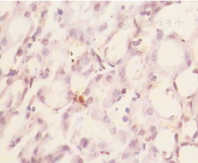
Apoptotic cells in control group

Apoptotic cells in control group
Apoptotic cells in renal ischemia reperfusion for 12 h group

Apoptotic cells in renal ischemia reperfusion for 12 h group
各组大鼠肾小管上皮细胞Bax和肾小管上皮细胞凋亡比较( ±s)
±s)
Comparison of renal tubular epithelial Bax and apoptotic positive cells between two groups ( ±s)
±s)
各组大鼠肾小管上皮细胞Bax和肾小管上皮细胞凋亡比较( ±s)
±s)
Comparison of renal tubular epithelial Bax and apoptotic positive cells between two groups ( ±s)
±s)
| 组别 | n | Bax | 细胞凋亡(个/视野) | |
|---|---|---|---|---|
| IR组 | ||||
| 2 h组 | 8 | 15.400±3.474 | 8.725±1.313 | |
| 6 h组 | 8 | 39.650±7.606 | 11.325±1.398 | |
| 12 h组 | 8 | 69.025±6.550a | 26.850±1.476a | |
| 24 h组 | 8 | 48.175±6.397 | 19.675±2.315 | |
| 72 h组 | 8 | 40.575±5.107 | 10.100±1.839 | |
| 对照组 | 8 | 2.450±0.639 | 0.900±0.385 | |
注:avs.对照组,P<0.01; Bax:F=150.362, P<0.01;肾小管上皮细胞调亡:F=268.324, P<0.01
凋亡又称为细胞程序化死亡(program cell death,PCD),是一种主动耗能的多种基因参与调控的细胞自我毁灭过程。肾IR损伤的病理机制包括肾血流动力学、肾小管损伤、继发炎症反应及其复杂的相互作用,在肾IR损伤过程晚期,肾小管上皮细胞凋亡是中心环节[1]。文献报道,肾IR损伤时,可见大量肾小管上皮细胞凋亡[2,3];另有学者进行大鼠肾IR损伤的系列研究亦证实,IR可致肾脏细胞凋亡[4,5]。在肾IR损伤动物模型中,IR通过诱导大量炎症因子的产生和黏附分子表达增加[6],导致肾功能障碍及肾小管上皮细胞凋亡[7,8]。本研究结果显示,IR后肾小管上皮细胞凋亡数量逐渐增加,以IR 12 h组细胞凋亡最为明显,与对照组比较,差异有统计学意义(P<0.01),而Scr水平亦于IR后逐渐升高,这与肾小管上皮细胞凋亡变化一致,说明肾小管上皮细胞凋亡在肾功能损害中发挥重要作用。
Bax属Bcl-2基因家族,是细胞凋亡调控的重要分子,但功能与Bcl-2相反。Bax在高浓度时可启动细胞死亡,低浓度时可使细胞器释放出某些分子,诱导细胞凋亡。Bax-Bax同源二聚体的形成,可导致线粒体细胞色素C的释放和细胞质内ATP释放,激活caspase-9,后者裂解下游凋亡执行蛋白酶caspase-3,细胞凋亡出现[9]。Berens等[10]研究病毒性脑炎的小鼠模型发现,神经元的凋亡、坏死,主要通过Bax介导的内在神经细胞凋亡通路实现。Bax-Bcl-2蛋白异二聚体的形成,可使Bcl-2蛋白失活,拮抗Bcl-2保护效应,对细胞凋亡有促进作用。Zeng等[11]在阿尔茨海默病的研究中发现,神经退行性变,Bax通路导致的神经细胞凋亡是必备条件。Whelan等[12]研究表明,Bax缺失,可极大减少心肌梗死的心肌细胞凋亡和心肌坏死。岳屹囡等[13]研究表明,肾组织Bax被IR诱导后逐渐增加,以IR 12 h肾组织水平最高,之后逐渐下降,72 h尚未降至正常水平。
研究表明,NO在肾小球、肾血管和肾小管功能稳态调节中发挥重要作用,不同水平、不同部位的一氧化氮合酶(nitric oxide synthases,NOS)被阻断,对肾脏生理将产生不同影响。IR对诱生型NOS(inducible nitric oxide synthase,iNOS)具有明显的诱导作用,而iNOS的高表达可加重肾脏损伤[14]。在环孢素A肾病模型中[15],环孢素A可减少内皮型NOS,增加iNOS和Bax,导致细胞凋亡和肾纤维化。iNOS被诱导后将催化产生大量NO,NO与O2迅速反应生成大量氧自由基,引起脂质过氧化反应,导致膜脂质损伤。且NO可诱导血管平滑肌细胞的细胞凋亡[16]。NO与超氧阴离子还可生成过氧亚硝酸阴离子(peroxynitrite anion, ONOO-),高浓度的ONOO-可抑制细胞膜的Na+-K+ATP,具有更强的氧化和损伤作用[17,18]。NO/ONOO-可通过增加促凋亡蛋白Bax的表达诱导凋亡。Du等[19]研究证实,NO可通过活化caspase-8使核酸内切酶激活诱导肾小管上皮细胞凋亡。Zhou等[20]研究发现,在完整无损的小静脉,微摩尔浓度级别的H2O2即能诱发大量NO,从而导致半胱天冬酶(caspase)激活介导内皮Ca2+积聚,导致细胞凋亡,血管通透性增加。Grossini等[21]对猪肾IR损伤模型的研究发现,肾内NOS增高,诱导产生大量NO,导致肾组织细胞凋亡。本研究结果显示,IR后血清NO水平逐渐升高,以IR 12 h组水平最高,之后逐渐下降。血清NO与肾小管上皮细胞Bax和细胞凋亡及肾功能表现出变化一致性,这表明细胞凋亡是IR所致急性肾功能衰竭中肾小管上皮细胞凋亡的重要方式。而IR后血清NO和肾小管上皮细胞Bax的显著上调,是诱导肾小管上皮细胞凋亡的重要因子。
IR所致急性肾功能衰竭动物模型中,确实存在细胞凋亡的病理学改变。缺血性急性肾功能衰竭中,细胞凋亡的部分机制与血清NO和促凋亡蛋白Bax增多有关。血清NO大量释放后通过上调肾小管上皮细胞Bax表达,对细胞凋亡的执行具有重要意义。因为IR后机体可产生多种炎症因子和细胞因子瀑布现象,可致脏器损伤,IR所致肾小管上皮细胞凋亡可被多种细胞因子诱导,故肾小管上皮细胞凋亡的确切发生机制,需进一步严格的实验设计加以研究。






























