
宫颈癌发病率居我国女性生殖道恶性肿瘤之首,约80%宫颈癌患者在治疗过程中需要接受放射治疗,包括术后辅助放疗、根治性放疗和复发宫颈癌放疗。笔者拟分别对体外放射治疗(EBRT)和近距离放射治疗(BT)的研究进展、靶区勾画、实施方式、优势和不足进行阐述如下。

版权所有,未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别申明,本刊刊出的所有文章不代表中华医学会和本刊编辑委员会的观点。
本刊为电子杂志,以光盘形式出版。本册应读者需求按需印刷,随光盘免费赠阅。光盘如有质量问题,请向编辑部调换。
宫颈癌是最常见的女性生殖道恶性肿瘤之一,我国每年宫颈癌新发病例约为10万例,居我国女性生殖道恶性肿瘤之首。近80%宫颈癌患者在治疗过程中需要接受放射治疗。对于宫颈癌国际妇产科联盟(Federation International of Gynecology and Obstetrics,FIGO)临床分期为ⅠA1~ⅡA2期患者,单纯根治性手术与根治性放、化疗效果相当;而对于术后具有宫旁浸润、切缘呈阳性、淋巴结转移者,需辅助同步放、化疗;术后具有脉管浸润、局部肿瘤巨大、深部间质浸润者,则需辅助放疗或同步放、化疗。对于FIGO临床分期为ⅡB~ⅣA期宫颈癌患者,根治性同步放、化疗为首要治疗手段。放射治疗同样适用于复发的宫颈癌。
放射治疗用于宫颈癌治疗已有超过100年的历史,包括体外放射治疗(external beam radiotherapy,EBRT)及近距离放射治疗(brachytherapy,BT)。EBRT主要针对宫旁区域和淋巴引流区域的宫颈癌照射;BT主要针对宫颈癌原发病灶照射,二者有效结合,才能达到较高的肿瘤控制率。
随着计算机、医学影像学、放射生物及物理技术水平的快速发展,临床对宫颈癌放射治疗从原来的二维放射治疗,全面向以CT、MRI及PET-CT影像为基础的三维放射治疗技术发展。对于宫颈癌的精确放射治疗,则是在尽量保证靶区受照射剂量足够的前提下,显著降低危及器官(organ at risk,OAR)的受照射剂量,最大程度实现二者平衡,在提高肿瘤局部控制率的同时,降低放射治疗相关并发症的发生率,使患者长期获益。宫颈癌精确放射治疗包括精确定位、计划设计及照射。需强调的是,任何精确放射治疗技术的成功实施,均基于治疗准确性的控制,包括靶区的准确定义、治疗中靶区变化和器官移动的应对、摆位及质量控制等。其中,对于宫颈癌进行合理的靶区勾画,不仅是决定宫颈癌精确放射治疗成败的重要因素,也是直接影响宫颈癌精确放射治疗相关并发症发生率的重要因素。
2011年,美国国家癌症综合网络(National Comprehensive Cancer Network,NCCN)指南新增加了宫颈癌放射治疗靶区范围。2012年版NCCN指南明确适形调强放疗(intensity modulated radiotherapy,IMRT)在宫颈癌放射治疗中的地位。对于接受子宫切除宫颈癌患者,以及需要接受腹主动脉旁淋巴结放疗的宫颈癌患者,IMRT和其他调强放疗技术,有助于减少患者肠管及其他重要器官的受照射剂量。对于因局部淋巴结肿大而需要接受大剂量放疗的宫颈癌患者,这些技术同样有效。但是,对于宫颈未切除,并且伴有中心性病变的宫颈癌患者,中心病变区不应将调强放疗等技术作为首选,仍应选择BT作为主要治疗方法。2013年,NCCN指南又进一步阐明,以三维影像为基础的EBRT,是宫颈癌根治性放疗的标准模式,推荐联合应用MRI与PET-CT,以保证放疗靶区覆盖受侵宫旁及转移淋巴结组织。
传统的宫颈癌EBRT多采用二维前后野或四野箱式盆腔照射。其优点是靶区内照射剂量分布均匀,而缺点则是肿瘤组织与正常组织接受的放射剂量相同。由于靶区放射剂量的提高,受到正常组织放射耐受性的制约,因此可导致肿瘤局部扩大、淋巴结转移。因为靶区放射剂量受限,可影响宫颈癌放射治疗的疗效,所以对于腹主动脉旁淋巴结转移进行延伸野放疗时,难以达到根治剂量,而且可导致放射治疗的毒副反应增加。Warrend等[1]报道,宫颈癌术后全盆腔IMRT照射剂量可增加至54 Gy,有助于控制肿瘤复发,而且放射相关并发症无明显增加。Poorvu等[2]对46例宫颈癌患者采用IMRT技术进行腹主动脉旁淋巴结放疗的研究结果显示,消化道(gastrointestinal,GI)不良反应发生率低,仅3例出现>3级近期GI不良反应,3例出现>3级远期GI不良反应,46例均未出现十二指肠特异性不良反应。该研究结果提示,应用IMRT技术进行腹主动脉旁淋巴结放疗,可充分保护肠道,放射剂量可提高至65 Gy。Jensen等[3]对21例宫颈癌患者采用IMRT技术进行腹主动脉旁淋巴结放疗的研究结果提示,IMRT技术不会导致远期GI不良反应增加,肿瘤局部复发率也较低。Albuquerque等[4]研究报道,由于盆腔内OAR的照射剂量及体积限制,盆腔骨髓V20>80%时,接受治疗的宫颈癌患者发生中、重度造血系统不良反应的相对危险度为4.5,故在制定IMRT计划时,应将骨髓定义为OAR,单独进行放射剂量限量,通过减少骨髓受照射体积,降低放疗对患者造血系统的不良反应发生率。Igdem等[5]研究结果显示,IMRT对于保护小肠、直肠、膀胱等器官具有优势,尤其对于骨髓的保护,效果突出。Chen等[6]对术后分别接受IMRT与传统四野放疗的68例宫颈癌患者的对比研究发现,两组均给予顺铂50 mg/m2同步化疗6个周期后,IMRT组GI不良反应与泌尿系不良反应发生率均明显降低,可见该治疗方案可有效提高患者对同步化疗的耐受性,同时对病灶的局部控制率与传统四野放疗相似。Mundt等[7]报道,IMRT技术可有效降低宫颈癌患者的近期和远期GI不良反应发生率,提高患者长期生存质量。
精确放疗技术的共同优势是,可提高靶区照射剂量和减少正常组织照射受量,但各种技术之间仍存在差异。最先应用于临床的固定野IMRT,是在三维影像基础上发展的体外立体照射技术,其适形度及均匀度,均明显优于传统EBRT。IMRT的缺点为占机时间过长。旋转调强放疗(intensity modulated arc therapy,IMAT),则可弥补这一缺陷。IMAT可通过动态多叶准直器(multi-diaphragm collimator,MLC)的连续运动,不断改变照射野的大小和形状,实施调强治疗,从而缩短放射治疗时间,并且照射剂量分布较IMRT更优化,更适合于生理运动度较小部位的放疗。但对IMAT治疗计划的优化更复杂,难度更大,计划设计所需时间明显长于IMRT。无论是IMRT或IMAT,均不适用于超长范围宫颈癌病灶治疗,而螺旋断层放射治疗(helical tomotherapy,HT)的优势,恰可实现超长范围放射治疗,同时具有图像引导放射治疗(image guided radiation therapy,IGRT)和剂量引导放射治疗(dose guide radiotherapy,DGRT)的优势。
精确放疗技术的成功实施,是基于治疗准确性的控制,包括靶区的准确定义,治疗中靶区变化与器官移动的应对,摆位及质量控制,以及靶区勾画等精确放疗的核心技术。合理的靶区勾画,不仅可决定宫颈癌放射治疗的成败,也直接影响放射治疗相关并发症的发生率。
大体肿瘤体积(gross tumor volume,GTV)是指临床上肉眼可见或可触及的,可通过检查手段证实的肿瘤区域。接受术后辅助放疗的宫颈癌患者若无GTV,靶区勾画可为术中标记的肿大淋巴结和残存肿瘤。接受术后辅助放疗的宫颈癌患者,若存在GTV,则对于GTV的勾画,应结合妇科检查、CT、MRI及PET-CT等多种检查结果确定。盆腔MRI是确定软组织及宫旁受侵较理想的方法,常以T2序列显示的高-中信号区域勾画GTV;全身PET-CT对转移淋巴结识别的敏感度和特异度,均高于CT和MRI。对于腹膜后淋巴结转移者,加大淋巴结照射剂量时,需单独勾画转移淋巴结靶区为GTV。
临床靶体积(clinical target volume,CTV)放疗技术,包括对GTV及显微镜下可见的亚临床肿瘤病变进行放射治疗。对于宫颈癌根治性放疗,CTV放疗技术包括对宫颈、宫体、宫旁、部分阴道及淋巴结引流区进行放射治疗。对于宫颈癌的术后辅助放疗,CTV放疗技术则包括对阴道残端、部分阴道及淋巴结引流区进行放射治疗。CTV的勾画与放疗医师的经验等多方面有关。根据2015年版NCCN指南推荐,宫颈癌放射治疗的CTV勾画时,前界应包括肿瘤可能向子宫体扩散的区域,后界应包括肿瘤可能向宫骶韧带扩散的区域和骶前淋巴结,侧界应包括足够范围的盆腔淋巴结。对肿瘤侵及阴道下1/3的宫颈癌患者,腹股沟淋巴结应包括在放射治疗范围之内。对隐匿性或肉眼可见的腹主动脉旁淋巴结肿大进行延伸野放疗时,应进行详细的计划设计及评估,以保证肿瘤靶区有效照射剂量(显微镜下对病变的照射剂量应达45 Gy),同时应保证肠道、脊髓或肾脏等照射受量在安全照射剂量范围内。2005年,Taylor等[8]研究20例宫颈癌患者在增强MRI勾画CTV情况下,CTV淋巴结包含情况发现,CTV包含的淋巴结数量与围绕血管的边界大小呈正比,沿血管周围外放3、5、7、10和15 mm边界勾画CTV时,包含的淋巴结比例分别为56%、76%、88%、94%和99%。2015年版NCCN指南推荐的沿血管周围外放7 mm边界勾画CTV,可较好地包括淋巴结,通过适当调整CTV勾画范围,可包括各组淋巴结,并降低对正常组织的照射受量。2008年,Small等[9]总结放射治疗肿瘤学组(Radiation Therapy Oncology Group,RTOG),美国妇科肿瘤学组(Gynecologic Oncology Group,GOG),加拿大国家癌症研究所(National Cancer Institute Of Canada,NCIC),以及欧洲放射肿瘤学会(European Society Therapeutic Radiation Oncology,ESTRO)等专家组对宫颈癌、宫颈内膜癌术后CTV勾画意见达成的共识,推荐CTV勾画应包括髂总、髂内、髂外淋巴结区,对于宫颈间质受侵患者,CTV勾画应包括骶前淋巴结区。该研究还特别指出,CTV勾画应建立考虑膀胱体积变化的内靶区(internal target volume,ITV),若在模拟定位CT检查计划中发现直肠过度扩张,则应考虑再次制定模拟定位CT检查计划。该研究提出的具体方案如下,髂总动脉CTV:L4~5下7 mm至髂总动脉分叉水平;髂外动脉CTV:髂总动脉分出髂外动脉水平至股骨头上方水平;髂内动脉CTV:髂总动脉分髂内水平,沿其分支走向,至阴道旁水平及阴道残端上方水平;阴道上部CTV:阴道残端及残端下3 cm;宫旁/阴道旁CTV:阴道残端至闭孔内肌中间/坐骨分支;骶前动脉CTV:S1~2区域前淋巴结区域。2011年,Lim等[10]总结RTOG专家组对根治性放射治疗的宫颈癌CTV勾画意见达成共识,推荐CTV勾画应包括GTV及显微镜下可见的亚临床肿瘤病变。宫颈肿瘤局部CTV勾画应包括宫颈、宫体、宫旁、部分阴道及盆腔淋巴结引流区。盆腔淋巴结引流区可采用2005年Taylor等[8]、2008年Small等[9]和2011年Lim等[10]报道的CTV勾画方法。Lim等[10]对于原发肿瘤区CTV勾画建议如下,宫颈:勾画全部宫颈;宫体:勾画全部宫体;宫旁:勾画上界至乙状结肠跨过子宫及输卵管处,下界至泌尿生殖膈开始,前界至膀胱后壁/髂外血管后缘,如果子宫前倾明显,子宫前界为宫旁前界,后界宫骶韧带和直肠系膜前缘,内界至子宫颈阴道,外界至骨盆壁,不包括肌肉和骨。值得注意的是,若宫骶韧带受累,则需将整个宫骶韧带全部包括在CTV勾画范围内,此时直肠系膜淋巴结及直肠周淋巴结均应包括在CTV内。对FIGO临床分期为ⅢB期及以上宫颈癌患者,应将直肠周淋巴结勾画在CTV内,宫旁靶区常与髂淋巴结及闭孔淋巴结区重叠,阴道:若无受侵,CTV应勾画阴道上段1/2,若上段受侵,则应包括阴道上段2/3;若广泛浸润,则应包括全阴道。2012年,Gay等[11]总结RTOG专家组对OAR的CTV勾画意见达成的共识,推荐如下,膀胱:治疗计划系统(treatment planning system,TPS)标准名称为bladder,CTV勾画包括膀胱底至膀胱顶的完整膀胱;直肠:TPS标准名称为anorectum,将直肠和肛门放在一起勾画,上界至直肠和乙状结肠交接处,即止于直肠失去圆形外观处,下界至肛外缘标记处(定位时放置);乙状结肠:TPS标准名称为sigmoid,CTV勾画下界始于直肠和乙状结肠交界处及anorectum结束处,上界止于降结肠起始处,包括临近或位于子宫或BT施源器之上的乙状结肠部分;肠管:TPS标准名称为bowelbag,CTV勾画包括全部小肠、大肠,除去anorectum部分,上界至计划靶体积(planning target volume,PTV)上1 cm,下界至PTV下1 cm(当下部没有肠管时,则不勾画),采用断层放射治疗(tomotherapy)技术时,在PTV上界和下界外放1~5 cm,通常为2.5 cm,CTV勾画包括肠管及腹膜腔,不包括其他OAR及肌肉和骨;近端股骨:TPS标准名称为femur_R与_L,下界至坐骨结节,上界至股骨头顶端,包括股骨转子。值得注意的是,乙状结肠是包含在肠管之中的,为的是联合BT评价乙状结肠的总体受照剂量。若照射平面涉及脊髓、肾脏、肝脏,则CTV应分别勾画,并且按照实体器官勾画全部肾脏(分为左、右)及肝脏。
笔者所在科室对于FIGO临床分期为ⅡB期宫颈癌(阴道穹窿受侵、宫旁受侵近盆壁)的调强放疗流程及靶区CTV勾画范围建议如下。对其定位前准备工作包括:患者于定位前30~40 min排空膀胱,再饮水500 mL(含造影剂碘化醇10 mL),显影小肠。对其靶区CTV勾画具体操作步骤为:让患者取仰卧位,身下垫胸、腹平板,双手抱肘并上抬置于额头,热塑体膜固定(上腹至大腿上约1/3处);待热塑体膜冷却成形后,激光灯下于体前正中和两侧分别置铅点(尽可能靠近靶区中心)。此时尽可能行CT增强扫描,以更清楚显示解剖位置;对造影剂过敏、高龄、伴有严重并发症等不适合行CT增强扫描者,仅进行平扫。CT检查的扫描范围为:第一腰椎体上缘至坐骨结节下2 cm,层厚为5 mm,若腹主动脉旁淋巴结转移,则上移至隔顶;若全阴道浸润、腹股沟淋巴结转移,则下移至外阴下4 cm。其中,对靶区CTV勾画:放疗前,应常规实施CT、MRI或PET-CT检查,以明确肿瘤靶区范围及是否存在远处转移(部分远处转移病变,可与原发部位同时进行放疗)。对于其GTV勾画,则包括临床肉眼可见或可触及的,或可通过检查手段证实的肿瘤区域,具体包括宫颈肿瘤、受侵宫旁及阴道组织。MRI检查是确定软组织及宫旁受侵的较理想方法。若腹膜后淋巴结转移,需对淋巴结照射剂量进行加量时,CTV则应单独勾画转移淋巴结靶区。CTV勾画分为局部肿瘤区域和淋巴引流区域。局部肿瘤区域CTV勾画,包括局部肿瘤GTV及显微镜下可见的亚临床肿瘤病变,首先为宫颈、宫体、宫旁和阴道CTV勾画。①宫颈CTV:勾画全部宫颈。②宫体CTV:勾画全部宫体。③宫旁CTV:勾画上界为乙状结肠跨过子宫及输卵管处,下界为泌尿生殖膈,前界为膀胱后壁/髂外血管后缘。若子宫前倾明显,则子宫前界为宫旁前界,后界为宫骶韧带和直肠系膜前缘,内侧界为子宫颈阴道,外测界为骨盆壁,不包括肌肉和骨。值得注意的是:若宫骶韧带受累,CTV勾画则需将整个宫骶韧带全部包括在内,此时直肠系膜淋巴结及直肠周淋巴结均应包括在内。对于FIGO临床分期为ⅢB期及以上者,CTV应将直肠周淋巴结勾画在内,宫旁靶区与髂淋巴结及闭孔淋巴结区重叠。④阴道CTV:若阴道无受侵,则勾画阴道上段1/2,若上段受侵,则勾画阴道上段2/3,若阴道广泛浸润,则勾画全阴道。其次,盆腔淋巴结引流区包括宫颈旁、宫旁、闭孔、髂内、髂外、骶前及髂总淋巴结CTV勾画,依照其血管走行进行勾画。①髂总动脉CTV:上界为腹主动脉分叉下缘,下界为髂总动脉分叉下缘;前界为血管前7 mm,后界为血管后7 mm;内侧界为血管内侧7 mm,外侧界为血管外7 mm,腰大肌内侧缘,包括腰大肌与椎体旁间隙。②髂外动脉CTV:上界为髂总动脉分叉下缘,下界为股骨头上缘即股动脉;前界为血管前7 mm,后界为血管后7 mm;内侧界为血管内侧7 mm,以子宫、卵巢、肠管、输尿管及膀胱为界,外侧界为血管外7 mm,腰大肌及髂腰肌内侧缘。③髂内动脉CTV:紧邻髂内血管及其分支,上界为髂总动脉分叉下缘,下界为尾骨肌上缘、坐骨棘或子宫动静脉上端;前界为血管外7 mm,后界为上部以骶骨翼为准,中下部至梨状肌前缘或臀下动静脉;内侧界为血管外7 mm,外侧界为头侧髂腰肌、髂肌或骶髂关节外侧,中间为髂骨、髂腰肌或髂肌内侧缘;尾侧界为闭孔内肌或梨状肌内侧。④闭孔淋巴结CTV:上界为骶髂关节下缘连接至髂内淋巴结,下界为闭孔上缘;前界为上中部分连接到髂外,下部至耻骨后缘,后界上中部连接到髂内,下部至闭孔内肌后缘;内侧界至膀胱、子宫及肠管,沿骨盆壁向内扩18 mm,外侧界至闭孔内肌、髂肌、髂腰肌或髂骨。⑤骶前淋巴结CTV:上界为髂总分勾画范围,见图1,图2,图3,图4,图5,图6。
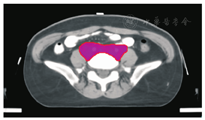

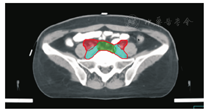

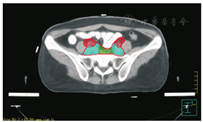

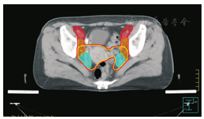

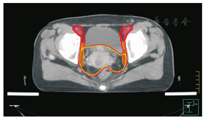

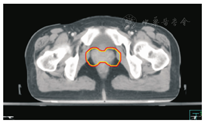

PTV为确保CTV得到足够照射剂量而设定的靶区。PTV需包括与肿瘤退缩、器官运动和形变、摆位误差等因素造成的位置移动范围。放射治叉,下界为S2下缘或梨状肌上缘;前界为骶骨前10 mm,后界为L5至骶骨前缘;外侧界为连接髂内外区域。2012年,Gay等[11]报道OAR勾画(将肠管分为小肠、结肠分别勾画),具体区疗时对于CTV如何外放形成PTV的标准,差异较大,推荐的外放边界范围为5~40 mm,目前尚无统一标准推荐。黄曼妮等[12]对宫颈癌调强放射治疗靶区设计时,以上界至腹主动脉分叉处,下界至闭孔下缘,以实体肿瘤或子宫体、子宫颈或淋巴结为标准,无实体肿瘤或淋巴结的层面以髂总、髂内外动脉为标准,旁开7~10 mm作为前、后及左、右侧界勾画CTV,以不同方法外放形成PTV并进行比较的结果显示,CTV向前外放10 mm,其余各方向外放5 mm,更能体现IMRT提高肿瘤剂量及保护OAR的优势。Khan等[13]分析50例宫颈癌患者每次治疗前的CT检查结果,以统一标准勾画CTV,通过设置标记,优化CTV外放或均匀/不均匀外放形成PTV的结果发现,若CTV向各个方向均匀外放13 mm形成PTV,则可覆盖95% CTV;若不均匀向前外放20 mm,向后、下及左、右侧外放10 mm,亦可覆盖95% CTV。根据解剖标记外放覆盖95% CTV的PTV(1 470 cm3),明显低于均匀外放(2 110 cm3)及不均匀外放(2 220 cm3)。其研究结果认为,若根据解剖标记外放PTV,可更好地覆盖CTV,并可减少PTV。Harris等[14]对22例宫颈癌术后患者通过在阴道顶端设置标记,研究其分次间位移的研究结果显示,CTV外放16 mm形成PTV,可最大限度包括阴道位移,左、右侧界外放3.1 mm,上、下侧界外放9.5 mm,前、后侧界外放12.1 mm,可包括95%阴道位移。
随着精确放疗技术的发展和靶区勾画标准的完善,对放射剂量的评估方法,也提出新的要求。国际辐射单位与测量委员会(International Commission on Radiation Units and Measurements,ICRU)发表EBRT指导性文件,对靶区和OAR定义、处方剂量、计划报告和记录等内容制定全面推荐标准,迄今已建立3个水平的剂量描述和报告标准。ICRU-29号文件提出,第1水平剂量报告方法,是基于点剂量的评估方法,适用于对宫颈癌的简单放射治疗。ICRU-50与-62号文件提出并完善第2水平剂量报告方法,是基于剂量容积直方图(dose-volume histogram,DVH)得到的吸收剂量和体积,并提出有关宫颈癌的GTV、CTV及PTV等剂量评估概念。2010年,ICRU-83号文件[15]对IMRT的处方、记录和报告提出第3水平剂量的要求,提出肿瘤控制率、正常组织并发症发生率、生物等效均衡剂量及其他危及体积等新概念,并推荐使用中位剂量D50%(50%体积所接受的最低吸收剂量)、D98%(98%体积所接受的最低吸收剂量)及D2%(2%体积所接受的最低吸收剂量),用于评估PTV和OAR接受的剂量。目前,第3水平剂量的评估标准,正逐渐应用于宫颈癌的放射治疗,有关其合理性、如何与以往的处方剂量和剂量评估方法相衔接,尚待更多临床资料的积累及验证来完善。
传统的宫颈癌BT剂量学体系,均建立在二维空间基础上进行剂量分析,并以ICRU-38号报告剂量参考点为基础,进行二维空间剂量评估,无法针对患者进行个体化治疗。其不足之处主要包括:对于体积较大的局部肿瘤(直径>5 cm),处方剂量线无法完全包绕肿瘤靶区,导致肿瘤靶区剂量不足;对于体积较小的局部肿瘤(直径≤5 cm),处方剂量线包括部分OAR,导致放射性损伤增加。该体系的报告剂量设定的A点是一个不确定参考点,因为在治疗过程中肿瘤的变化及每次施源器位置的差异,均可导致A点无法重合,造成A点剂量不确定,而且对OAR照射剂量监测存在不准确性。BT也正向精确化的三维近距离治疗(image-guided adaptive brachytherapy,IGABT)发展,近年各国迅速成立工作组,为宫颈癌BT剂量学体系研究提供学术交流平台。2000年,欧洲肿瘤放射治疗协会妇科肿瘤工作组(Groupe Européen de Curiethérapie-European Society for Therapeutic Radiology and Oncology,GEC-ESTRO)成立妇科工作组(Gynaecological Working Group,GWG),2005年GWG成立欧洲妇科介入治疗三维网络(European Network for 3D Gynaecological Brachy Therapy)开展BT剂量学体系研究,并引入有关宫颈癌的GTV、CTV等概念。
21世纪初,基于三维影像的BT开始应用于宫颈癌治疗,在高剂量率(high-dose-rate,HDR)后装的基础上,加入三维计划系统,将三维断层影像,如CT、MRI等与腔内治疗计划相联合。其优势在于将传统的梨形剂量线,改变为根据治疗靶区的形态和体积及与OAR关系而设计的剂量曲线,从而强调个体化治疗。
2005年,Haie-Meder等[16]推荐三维后装治疗,引入有关宫颈癌的GTV、CTV等概念,并推荐应用MRI勾画靶区,以T2WI序列所示的肿瘤范围为GTV,区分诊断时的GTV、CTV与BT时的GTV、CTV;并将CTV按照肿瘤负荷和复发危险程度分为以下3类:①高危CTV(high risk CTV,HR-CTV):包括宫颈与BT时肿瘤侵犯的范围;②中危CTV(intermediate risk CTV,IR-CTV):是指显微镜下可见的肿瘤区,推荐包括EBRT开始前的肿瘤范围,BT时需描述HR-CTV及IR-CTV;③低危CTV(low risk CTV,LR-CTV):是指显微镜下可能的播散区,一般采用手术或EBRT进行处理。目前,根据肿瘤消退直径定义IR-CTV,如肿瘤完全消退或消退直径≥10 mm,则IR-CTV应包括HR-CTV和最初诊断时肉眼可见的肿瘤区,不增设安全边缘;若肿瘤消退直径<10 mm,则IR-CTV应包括超过宫颈的残存病灶,并向可能扩散的方向外放10 mm的安全边界;若肿瘤无明显消退,则IR-CTV应包括最初的肿瘤范围,再向外放10 mm的安全边界。
2006年,GEC-ESTRO对IGABT实施的剂量评估推荐统一标准,建议以D90(90%体积接受的最低吸收剂量)与D100(100%体积接受的最低吸收剂量)评估有关宫颈癌的GTV、HR-CTV和IR-CTV剂量,以V150(接受150%处方剂量的体积)、V200(接受200%处方剂量的体积)评估高剂量体积;以D0.1cc(0.1 cc体积接受的最大剂量)、D1cc(1 cc体积接受的最大剂量)、D2cc(2 cc体积接受的最大剂量)或D5cc(5 cc体积接受的最大剂量)、D10cc(10 cc体积接受的最大剂量)评估OAR照射受量[17]。Potter等[18]、Dimopoulos等[19]及Dimopoulos[20]等多项研究结果证实,HR-CTV的平均D90是预测局部复发率最重要的参数。对于平均D90≥87 Gy的宫颈癌患者,局部复发率为4%,而对于平均D90<87 Gy的宫颈癌患者,局部复发率为20%。Schmid等[21]研究结果显示,局部复发宫颈癌患者HR-CTV的平均D90为77 Gy,未复发患者HR-CTV的平均D90为95 Gy。然而,即使HR-CTV的平均D90≥87 Gy,若存在低剂量区,仍可能导致局部复发。该研究结果还显示,85%局部复发宫颈癌患者的HR-CTV内存在低剂量区(<87 Gy)。因此,除了DVH参数的评估外,尚需仔细检查每一层面的剂量分布,尽量减少低剂量区。
针对传统的宫颈癌BT剂量点(A点、膀胱参考点、直肠点等)是否可沿用的问题,2009年美国近距离放射治疗协会(American Brachytherapy Society,ABS)建议,将A点剂量与DVH参数一起报告,以便与传统的二维BT进行比较。文献报道,传统的膀胱参考点剂量,并不能代表膀胱的最高照射受量,通常膀胱照射受量最高点位于传统的膀胱参考点上方约2 cm处;直肠参考点剂量尚能基本代表直肠的最高照射受量,仍可沿用[22]。BT剂量梯度大,因此,需对可能产生系统误差的布源和施源器重建进行控制。2010年,GEC-ESTRO对布源和施源器重建的基本方式进行了规定[23]。CT对放射源路径显示最好,MRI有利于靶区勾画。但MRI成像过程中钛合金施源器可产生伪影,故需选择合适的MRI序列,目前推荐层厚≤5 mm的薄层MRI序列或体素同向的3D MRI序列,并建议施源器重建和靶区勾画在同一影像序列上进行,以减少融合的误差。通过采用合理的施源器重建方式,可保证施源器重建产生的误差对实际剂量的影响降至最低。
2012年,GEC-ESTRO完善MRI引导的IGABT实施规范,推荐通过盆腔表面线圈获得多平面(横轴位、矢状面、冠状面和斜位)T2加权影像,为肿瘤和重要器官可视化的金标准[24]。放疗前及放疗过程中,应进行MRI检查作为对照。
BT的不良反应发生率与OAR受照剂量相关。Potter等[25]对156例FIGO临床分期为ⅠB~ⅣA的宫颈癌患者进行根治性放疗的研究结果显示,膀胱的D2cc剂量平均为(86±17)Gy,直肠的D2cc为(65±9)Gy,乙状结肠的D2cc为(64±9)Gy;其G3~4膀胱不良反应发生率为1.28%(2/156),G3~4直肠不良反应发生率为2.56%(4/156),G3~4阴道不良反应发生率为1.28%(2/156),无严重的小肠、乙状结肠相关不良反应,但G1~2阴道不良反应发生率达82.05%(128/156),可使中、重度泌尿系统及GI不良反应发生率明显降低。Kang等[26]回顾性分析97例应用CT引导的腔内放疗治疗的宫颈癌患者,对照组纳入133例宫颈癌患者,对其采用二维BT治疗的研究结果发现,CT引导的腔内放疗,使严重的远期直肠出血发生率由13%降至2%,并且对于肿瘤直径>4 cm的宫颈癌患者,IGABT的优势为明显。
因BT剂量梯度大,距离放射源1~3 cm的剂量变化为每毫米5%~12%,而且随着治疗精确度的增加,任何位置和形态变化,均可能导致剂量不确定。在IGABT治疗中,应用DVH参数进行剂量评估发现,上述不确定因素可对肿瘤靶区(HR-CTV D90)和OAR(D2cc)分别造成12%和21%~26%的剂量误差[27]。
放射治疗若要实现精确的IGABT,则需改变剂量线覆盖的靶区形状,从而对施源器和布源设计提出更高要求。目前施源器种类多样,BT施源器的选择,也对放射的处方剂量有很大影响。文献报道,多通道施源器可降低OAR照射受量,并减少黏膜热点[28]。对于体积较大、形状不规则肿瘤,单纯的腔内放疗仍无法满足足够的靶区覆盖范围,可由有经验的专家进行组织间插植治疗,插植治疗与腔内施源器相结合的方式相比于单纯使用腔内施源器,可产生更高的靶区照射剂量,尤其有利于治疗体积较大、位置偏离而不对称肿瘤[29]。
与EBRT方式不同,腔内放疗单次照射剂量较高。目前对于腔内放疗剂量分割方式尚无明确标准。2015年版NCCN指南总结既往经验,建议HDR BT推荐照射剂量为30 Gy/6 Gy*5f,即相当于低剂量BT时A点剂量为40 Gy。在一项前瞻性队列研究中,台湾学者纳入267例根治性放、化疗宫颈癌患者,BT采用HDR,2次/周,根据照射剂量分割方式分为HDR-4组(A点剂量为6 Gy*4f,n=144)和HDR-4组(A点剂量为4.5 Gy*6f,n=123)的研究结果显示,两组患者5年直肠炎发生率比较,差异无统计学意义(P>0.05);但再根据年龄分组进行分析的结果却显示,对于>62岁患者,HDR-4组2级以上直肠炎发生率,显著高于HDR-6组,且差异有统计学意义(P=0.012),而≤62岁患者的2级以上直肠炎发生率,两组比较,则差异无统计学意义(P>0.05)[30]。两组患者的总生存率、肿瘤局部控制率与远处转移率、膀胱炎和小肠炎发生率比较,差异均无统计学意义(P>0.05)。这提示,对于可耐受多次BT的年龄较大患者,应用小分割BT,可降低2级以上直肠炎发生率,并且不影响预后[30]。
目前对宫颈癌放射治疗中,IGABT相对于A点剂量系统推荐剂量,通过影像技术指导下的BT改进剂量设定的尝试,仍需谨慎,尤其与体外精确放疗相结合时,可能造成肿瘤照射受量不足或OAR照射受量过高。目前因器官形变和位移较大,尚无法实现体素对应的精确融合,而且相关研究多以GEC-ESTRO推荐的L-Q模型计算生物等效剂量进行叠加,但该指标只能用于治疗结束后所有分次叠加进行计算。对于靶区作为早反应组织,采用α/β=10评估远期不良反应;OAR作为晚反应组织,采用α/β=3评估远期不良反应。但是该模型尚不完善,尤其对于剂量分割较大(超过7 Gy/f)时,远期不良反应评估结果并不准确,尚需进一步研究完善。新的ICRU GEC-ESTRO标准即将推出,基于目前研究,有望使宫颈癌的EBRT和IGABT更加规范。宫颈癌放射治疗的靶区勾画方面,建议在体外精确放疗中单独勾画乙状结肠,从而用于与IGABT结合时,乙状结肠的照射受量再进行叠加[30]。
ICRU-83号报告指出,自传统EBRT向调强放疗过渡以来,虽然二者照射处方剂量相同,但因处方方式不同,实际靶区照射剂量有所提高。IGABT的实施也可导致靶区照射剂量增加,而靶区照射剂量提高,对局部控制率提高的意义及其对周围组织的影响,尚待进一步评估。日本的一项前瞻性、多中心研究结果显示,对FIGO临床分期为Ⅰ~Ⅱ、直径<4 cm的宫颈癌患者,采取根治性放疗中,应用IGABT给予低累积剂量计划(A点剂量为62 Gy,α/β=10),患者可达到很好的局部控制率,而且无严重不良反应[31]。该研究纳入60例宫颈癌患者,中位随访时间为49个月,7例患者复发:其中3例为盆腔复发(2例为中心型复发,1例为区域淋巴结复发),4例发生远处转移[31]。对其进行分组分析的结果显示,48~77 Gy,α/β=10的3年盆腔局部控制率可达96%。生物等效剂量为48 Gy,α/β=10的盆腔局部控制率为5/5,62 Gy,α/β=10的盆腔局部控制率为7/7,68 Gy,α/β=10的盆腔局部控制率为2/2,77 Gy,α/β=10的盆腔局部控制率为8/9,各剂量的盆腔局部控制率比较,差异均无统计学意义(P>0.05),提示对于部分较早期的宫颈癌病变,提高局部照射剂量,并不能显著提高肿瘤的局部控制率。因此,可考虑应用精确放疗技术的同时,适当降低照射处方剂量,这样有可能降低不良反应发生率。
随着精确放疗技术的进步,对接受放疗肿瘤的局部控制率已取得较大提高,但远处转移所占的复发比例亦相应地增加。因此,临床实践中应重视对远处转移的控制。文献报道,精确放疗中同步化疗的疗程数与宫颈癌远处转移控制率呈正比,同步化疗可使远处转移率从31%降至18%[32]。故在精确放疗治疗过程中,应关注同步化疗的并发症,并予以及时处理,尽量使患者完成同步化疗。一项对189例FIGO临床分期为ⅠB~ⅣA期宫颈癌患者进行根治性放、化疗的回顾性研究结果显示:中位随访时间为54个月,49例患者发生远处转移,全组无远处转移者的5年生存率为73%;低危组(FIGO临床分期为ⅠB~ⅢA、淋巴结呈阴性)和高危组(FIGO临床分期为ⅢB~ⅣA或淋巴结呈阳性)无远处转移者的5年生存率分别为90%和60%,增加同步化疗的疗程数,可降低高危组的远处转移率(P=0.022),而对低危组患者的远处转移率无影响(P>0.05)[33]。为控制远处转移,对于具有预后高危因素的宫颈癌者,是否需采用联合治疗方案、增加同步化疗的疗程数或进行巩固化疗,仍有待进一步研究证实。






























