
白三烯是花生四烯酸经5-脂氧合酶代谢途径形成的具有高度生物活性的代谢产物,是重要的炎症介质。研究结果表明,白三烯参与了支气管哮喘、慢性阻塞性肺疾病(COPD)、毛细支气管炎、支气管肺发育不良(BPD)及急性肺损伤(ALI)等多种肺部疾病的病理生理过程。白三烯通过与靶细胞膜上的受体结合而发挥致炎作用,故白三烯受体拮抗剂(LTRA)可通过与白三烯受体竞争性结合而起到抗炎作用,在改善肺功能、降低气道高反应性、抑制气道重塑及抗肺纤维化中发挥重要作用。近年研究结果显示,LTRA还具有重要的非受体依赖性抗炎作用。笔者拟就白三烯和LTRA在肺部疾病中作用的研究进展进行综述,为肺部疾病的治疗提供新思路。

版权所有,未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别申明,本刊刊出的所有文章不代表中华医学会和本刊编辑委员会的观点。
本刊为电子杂志,以光盘形式出版。本册应读者需求按需印刷,随光盘免费赠阅。光盘如有质量问题,请向编辑部调换。
白三烯(leukotrienes)是花生四烯酸经5-脂氧酶代谢途径形成的代谢产物,由Samuelssonh和Bergström等于1982年首次发现,并因此获得诺贝尔医学生理学奖[1]。1990年,白三烯的成功合成再次作为重大成就,使得Elias James获得诺贝尔化学奖。时至今日,白三烯仍是国内外学者研究的热点。文献报道,白三烯作为重要的炎症介质参与了呼吸系统、心血管系统、变态反应性疾病等的发病过程[1]。全球哮喘防治创议(Global Initiative for Asthma,GINA)明确指出,半胱氨酰白三烯(cysteinyl leukotrienes,CysLTs)是哮喘的关键炎症介质之一,是唯一一类被抑制后与肺功能和哮喘症状改善相关的炎症介质[2]。白三烯受体拮抗剂(leukotriene receptor antagonists,LTRA)由默沙东研究所(Merck Sharp & Dohme Research Laboratory)成功研发并于1998年获得美国食品药品监督管理局(Food and Drug Administration,FDA)批准上市,2000年进入中国。迄今为止,LTRA被广泛应用于哮喘及其他肺部疾病的治疗。越来越多的研究结果发现,LTRA除与CysLTs受体竞争性结合外,还具有广谱的、CysLTs受体非依赖性抗炎作用和一定的免疫调节作用。笔者拟就白三烯和LTRA在支气管哮喘,慢性阻,塞性肺疾病(chronic obstructive pulmonary disease,COPD),毛细支气管炎,支气管肺发育不良(bronchopulmonary dysplasia,BPD),急性肺损伤(acute lung injury,ALI)及阻塞性睡眠呼吸暂停综合征(obstructive sleep apnea hyponea syndrome,OSAS)等肺部疾病中的研究进展进行综述,为肺部疾病的临床治疗提供参考。
白三烯是花生四烯酸代谢产生的重要炎症介质,因为其最初来源于白细胞,并且碳链中含3个不饱和双键, 故称为白三烯。白三烯的生物合成途径,见图1。白三烯可分为白三烯A4(leukotriene A4)、白三烯B4(leukotriene B4)和CysLTs,CysLTs包括白三烯C4(leukotriene C4)、白三烯D4(leukotriene D4)、白三烯E4(leukotriene E4),因其化学结构中均含有半胱氨酰基故合称为半胱氨酸白三烯。白三烯主要由炎症细胞合成[1],白三烯A4性质不稳定,白三烯B4主要由中性粒细胞产生,白三烯C4由肥大细胞、嗜酸性粒细胞、嗜碱性粒细胞产生,而单核细胞和巨噬细胞既可产生白三烯B4,又可产生白三烯C4。白三烯的半衰期短,在体内代谢快,主要通过胆汁和尿液排出。由于尿白三烯E4在体内以4%~7%的相对恒定比例排泄,故可通过检测尿白三烯E4水平来反映体内白三烯的代谢情况[3]。
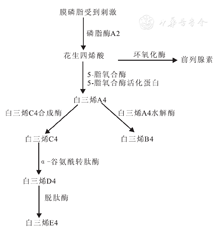

白三烯是白细胞重要的趋化剂和激动剂,是哮喘发病机制中重要的炎症介质[1],可引起气道平滑肌收缩,增加血管通透性及黏液分泌,促进炎症细胞在气道聚集,同时能促进气道结构细胞(上皮细胞、成纤维细胞、血管平滑肌细胞等)的增殖,从而参与气道重塑。白三烯B4是重要的白细胞活化物质,刺激白细胞的趋化、聚集、释放氧自由基及溶酶体酶,可增加血管壁通透性,刺激支气管平滑肌细胞分泌黏液。
Peters-Golden和Sampson[4]研究发现,CysLTs可调节白细胞介素(interleukin,IL)-4,IL-5,粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor,GM-CSF)及肿瘤坏死因子(tumor necrosis factor,TNF)-α等炎症介质的活性,而IL-4、-5、-13及转化生长因子(transforming growth factor,TGF)-β等炎症介质亦可调节CysLTs的活性。因此,CysLTs通过与其他炎症介质的相互作用、相互促进,可引起炎症反应级联放大,推动疾病进展。
白三烯生物效应的发挥依赖于靶细胞膜上相应的G蛋白偶联受体,包括分别由白三烯B4和CysLTs激活的白三烯B4受体新亚型BLT受体和CysLTs受体(cysteinyl leukotriene receptor)。BLT受体包括BLT1受体和BLT2受体,BLT1为高亲和力受体,主要表达于白细胞,尤其是中性粒细胞、嗜酸性粒细胞和巨噬细胞,参与白细胞尤其是中性粒细胞的化学趋化过程;BLT2则为低亲和力受体,高表达于小肠、肝、脾和白细胞,功能尚不清楚[1]。根据CysLTs受体对经典拮抗剂的敏感度不同,分为能够被拮抗的CysLT1受体和不能被拮抗的CysLT2受体,二者分布各不相同[1,5]。CysLT1受体广泛分布于巨噬细胞、嗜酸性粒细胞、肥大细胞、嗜碱性粒细胞、中性粒细胞、T淋巴细胞和B淋巴细胞中,与炎症反应密切相关,其可识别白三烯C4、白三烯D4和白三烯E4,其中与白三烯E4的亲和力最弱。CysLT2受体则主要分布在粒细胞,以及脾、脑、脊髓、心脏等,肾上腺中也有少量分布。因为目前没有特异性的拮抗剂,CysLT2受体在哮喘中的作用仍然未知。Liu和Yokomizo[5]研究结果显示,内皮细胞过表达人CysLT2受体的转基因小鼠用于研究CysLT2对内皮完整性和血压的调节,结果显示暴露于CysLTs后血管通透性增加。此外,该研究结果亦显示,嗜酸性粒细胞来源的白三烯C4和CysLT2对于促进皮肤纤维化和阿尔茨海默病(Alzheimer′s disease)小鼠模型胶原沉积的增加非常重要[5]。
目前已知的白三烯受体调节剂包括LTRA和5-脂氧合酶抑制剂,后者由于存在肝损害而在临床应用较少,LTRA作为拮抗白三烯受体的经典药物已广泛应用于各种疾病的治疗,尤其是哮喘和变态反应性鼻炎(allergic rhinitis,AR),此类药物主要有扎鲁司特、普司斯特、孟鲁司特,其中以选择性CysLT1受体拮抗剂孟鲁司特应用最广。LTRA通过与白三烯受体竞争性结合,阻断白三烯的生物学效应。然而LTRA的作用并非完全受体依赖性,Woszczek等[6]研究结果显示,孟鲁司特能够通过抑制5-脂氧合酶的活性从而减少白三烯B4的合成。Anderson等[7]研究结果显示,孟鲁司特对中性粒细胞趋化因子的抑制作用可能与抑制环核苷酸磷酸二酯酶而引起细胞内环磷酸腺苷(cyclic adenosine monophosphate,cAMP)水平升高、降低Ca2+水平有关。上述研究结果均提示,孟鲁司特具有广谱的、CysLTs受体非依赖性抗炎作用。
由于抗炎、平喘的治疗需要长期用药,此类药物应具有良好的安全性和耐受性。文献报道,LTRA的安全性和耐受性较好,其不良事件发生率与安慰剂相似,哮喘患儿服用孟鲁司特和其神经、精神事件的发生无正相关关系,并且哮喘患儿服用孟鲁司特与自杀风险之间亦无相关性[8]。Sarkar等[9]报道,孟鲁司特的安全范围较大,儿童服用超过1 000 mg的剂量仍较安全[9]。文献报道,与使用激素或β受体阻滞的哮喘孕妇和未接触有害物质的健康孕妇相比,服用孟鲁司特的哮喘孕妇,其胎儿不良预后发生率未增加,并且差异无统计学意义(P>0.05)[10,11,12]。LTRA作为新型非类固醇类抗炎药,具有不良反应少、依从性好、安全性高、疗效确切等优点,应用前景良好。
自1982年首次发现以来,白三烯已经逐渐被证实参与体内多个系统疾病的发生、发展,包括BPD、COPD、哮喘、动脉粥样硬化、AR等,尤其是白三烯与肺部疾病的相关研究,成为国内外研究热点。
支气管哮喘是多种炎症细胞、炎症介质参与的慢性气道炎症性疾病,气道炎症、气道高反应性和气道重塑是支气管哮喘的重要特征。大量研究结果表明,CysLTs是支气管哮喘发病过程中最重要的炎症介质之一。CysLTs能够收缩气管平滑肌、增加血管通透性、促进黏液分泌及炎性细胞募集、引起气道重塑、加重病情,并与其他炎症介质相互作用引起炎症级联反应放大,参与支气管哮喘发生、发展全过程[1,3,4,5]。已有临床研究结果证明,LTRA对哮喘有良好的治疗效果,LTRA已经广泛应用于临床并取得良好的疗效。Hung[13]研究结果显示,孟鲁司特能够阻止甚至逆转气道重塑。激素是治疗支气管哮喘的一线药物,但其是否能特异性阻断和逆转气道重塑,以及其作用机制,仍待进一步研究证实。Bérubé等[14]进行的一项为期12周的开放性、观察性、前瞻性研究结果显示,症状未控制的支气管哮喘患儿单独或与激素联合应用孟鲁司特治疗12周后,>70%患儿哮喘症状可以得到控制。体外实验结果表明,孟鲁司特可通过抑制Toll样受体介导的TNF-α表达和IL-10表达等多种途径,影响与哮喘发病密切相关的髓系树突状细胞(myeloid dendritic cell,mDC),从而发挥重要的抗炎作用,LTRA的受体非依赖性抗炎作用也被进一步证实[15]。新近研究结果发现,孟鲁司特还能降低支气管哮喘患者罹患癌症的风险[16]。
我国《儿童支气管哮喘诊断与防治指南》(2016年版)推荐,LTRA可作为支气管哮喘诊断性治疗药物,可单独应用于轻度持续性哮喘的治疗,尤其适用于无法应用、不愿使用吸入性糖皮质激素(inhaled corticosteroid,ICS)或合并AR的哮喘患儿;可部分预防运动诱发性痉挛;LTRA与ICS联合治疗中至重度持续性哮喘患儿,可减少ICS的使用剂量,并提高ICS的疗效,是年龄<6岁儿童哮喘的长期治疗方案中第4级治疗的优选方案;对年龄<6岁儿童持续性喘息、反复病毒诱发性喘息及间歇性喘息部分有效,并可降低气道高反应性[17]。2006年修订的GINA指南就明确指出,LTRA是作为除ICS外,唯一可单独应用的哮喘长期控制药物。支气管哮喘急性期、慢性持续期、临床缓解期的治疗和季节性预防均可使用孟鲁司特[8]。由此可见,LTRA在支气管哮喘的治疗中占有十分重要的地位。
毛细支气管炎是婴幼儿常见的下呼吸道感染性疾病,多见于2岁以下婴幼儿,主要由呼吸道合胞病毒(respiratory syncytial virus,RSV)引起,临床上常表现为喘憋、三凹征和肺部哮鸣音等。毛细支气管炎与遗传因素、环境因素及免疫机制等有关,其发病机制与支气管哮喘相似,白三烯是其中重要的炎症介质。陈秋芳等[18]通过检测毛细支气管炎患儿鼻咽分泌物嗜酸粒细胞阳离子蛋白(eosinophil cationic protein in nasopharyngeal aspiration,NPS-ECP)和尿白三烯E4水平,发现RSV毛细支气管炎患儿鼻咽分泌物嗜酸粒细胞阳离子蛋白(eosinophil cationic protein,ECP)水平和尿白三烯E4水平较健康儿童均明显升高,表明CysLTs参与了RSV毛细支气管炎的发病过程,与Oh等[19]文献报道一致。
目前,对于毛细支气管炎无特殊治疗方法,多采用对症治疗,但仍有部分患儿反复发作,最终发展为支气管哮喘,因此,毛细支气管炎可视为部分哮喘儿童的首次发作。李洁和潘家华[20]研究结果表明,CysLTs参与了毛细支气管炎的发生、发展,LTRA应用于毛细支气管炎的治疗取得较好疗效。在常规治疗的基础上服用孟鲁司特后,患儿血清及尿白三烯E4水平下降程度、临床症状缓解情况均优于仅接受常规综合治疗的对照组,并且差异有统计学意义(P<0.05)。Kearns等[21]研究结果发现,孟鲁司特可改善1~3个月龄的毛细支气管炎患儿临床症状与结局,并且患儿耐受性好。《白三烯受体拮抗剂在儿童常见呼吸系统疾病中的临床应用专家共识》中明确也指出,毛细支气管炎发作期短程服用孟鲁司特可减轻急性期症状,恢复期持续服用孟鲁司特可减少喘息次数,并且无明显不良反应[8]。上述研究结果均提示孟鲁司特治疗毛细支气管炎临床疗效确切,值得进一步深入研究。
COPD系具有气流阻塞特征的慢性支气管炎和(或)肺气肿,可进一步发展为肺心病和呼吸衰竭,致残率和病死率高。C反应蛋白、白三烯、TNF-α、IL-6、中性粒细胞、嗜酸性粒细胞等多种炎症介质和炎症细胞参与COPD的发病过程[22],参与其中的白三烯主要包括白三烯B4和CysLTs。Tufvesson等[23]研究结果发现,COPD发作前患儿痰白三烯B4水平较稳定期明显升高,痰白三烯B4水平可作为COPD发作及恶化的标志。Rubinstein[24]等进行的一项回顾性研究结果发现,长期使用孟鲁司特对中至重度COPD患儿病情控制疗效较好。雷震和左莹[25]研究结果也发现,加用孟鲁司特组与常规治疗组相比,加用孟鲁司特治疗后患儿的血气分析指标中,动脉血氧分压(partial pressure of oxygen in artery,PaO2),动脉二氧化碳分压(partial pressure of carbon dioxide,PaCO2),肺功能一秒钟用力呼气量(forced expiratory volume in one second,FEV1)及FEV1/用力肺活量(forced vital capacity,FVC)的改善情况,明显优于常规治疗组,并且差异有统计学意义(P<0.05),这说明孟鲁司特治疗COPD效果确切。运用孟鲁司特治疗COPD雄性豚鼠的动物试验结果发现,使用孟鲁司特治疗COPD雄性豚鼠对激素不敏感型COPD也具有显著疗效[26]。上述研究结果均为COPD的治疗带来新的曙光。虽然部分研究已证实LTRA能有效改善COPD患儿的临床症状及结局,但是尚缺乏有力证据支持,仍需要多中心、大样本的临床研究进一步证实[27]。
BPD是早产儿常见的慢性呼吸系统疾病,病死率高,少数存活儿常遗留严重的并发症。近年来随着医学技术的革新,早产儿存活率升高,BPD发病率亦呈上升趋势。迄今为止,BPD的发病机制仍未阐明,但已得到证实的BPD相关危险因素包括早产、低出生体重、宫内感染、机械通气、高浓度吸氧、胎膜早破等,炎症反应是BPD发病的重要环节[28]。文献报道,BPD患儿血浆和肺泡灌洗液中TNF-α和IL-1β、-6、-8等促炎症因子水平显著升高;血小板活化因子(platelet active factor,PAF)及白三烯等脂质炎性介质水平上调,与细胞因子相互作用、相互促进[4,29]。这些异常上调的炎性因子阻碍了正常的肺发育进程,导致肺泡形成障碍和肺泡微血管成熟延迟;加之高浓度吸氧和机械通气所致肺损伤,最终导致BPD。对新生儿生后3 d尿白三烯E4水平检测结果发现,BPD组患儿生后3 d内尿白三烯E4水平较早产非BPD组和足月非BPD组均显著上升,并且差异均有统计学意义(P<0.05)[30]。这与Mirro等[30]研究结果一致。这为运用LTRA治疗BPD提供了理论依据。Rupprecht等[32]进行的一项前瞻性研究结果发现,孟鲁司特可降低孕龄为23~27孕周重度BPD早产儿的死亡率和肺部严重程度评分(pulmonary severity score,PSC);而Kim等[33]对生后可能发生BPD的早产儿预防性应用孟鲁司特,结果表明孟鲁司特对中至重度BPD无预防作用,也未见药物相关不良反应。鉴于孟鲁司特安全性高、不良反应少、早产儿及婴幼儿耐受性好,LTRA有望成为治疗BPD的有效药物。
ALI是由感染、创伤、缺氧等多因素联合作用所致的肺部弥漫性、炎症性损害,进展到严重阶段即称为急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS),炎症反应在ALI的发生、发展中扮演重要角色,多种炎症介质、细胞因子相互作用,介导炎症反应级联放大,造成肺损伤。Auner等[34]采用酶联免疫吸附试验 (enzyme-linked immuosorbent assay,ELISA)法连续5 d检测严重创伤患者血浆白三烯B4水平,结果显示出现肺部并发症者血浆白三烯B4水平明显高于健康个体和无并发症者,并且差异有统计学意义(P<0.05)。近年多项研究结果发现,ALI患者血清PAF水平明显升高,而PAF能促进花生四烯酸的代谢,与白三烯协同作用,造成肺部炎症级联放大,从而引起肺损伤[35,36,37]。此外,IL-1、-6、-8及TNF-α等多种细胞因子参与了ALI的发生、发展[36,37,38],而白三烯作为强有力的炎症介质,与IL-4、-5及GM-CSF、TNF-α等细胞因子相互诱导合成与释放[4],引起炎症反应级联放大,推动ALI的进展。尽管多项研究证实,白三烯与ALI的病理生理关系密切,LTRA治疗ALI具备一定的理论依据,但尚无LTRA治疗ALI的相关文献报道,相关基础实验和临床试验仍尚待开展以探讨其有效性及安全性。
儿童OSAS是以睡眠时部分或完全性上呼吸道阻塞的发作为特征的常见睡眠呼吸疾病,通常伴血氧饱和度下降和(或)高碳酸血症,严重扰乱儿童正常通气、睡眠以及颌面部发育,严重OSAS可致儿童猝死。腺样体肥大、扁桃体肥大是儿童OSAS的重要病因[39],手术切除腺样体和扁桃体治疗儿童OSAS的有效率高(约为90%),同时复发率亦较高(约为30%),故亟待寻找有效的药物治疗方法。文献报道,OSAS患儿扁桃体组织CysLTs水平及其受体表达均较健康儿童明显升高[40,41],腺样体组织和外周血中白三烯B4水平与腺样体肥大程度呈正相关关系[42]。孟鲁司特作为唯一被批准用于治疗儿童呼吸系统疾病的LTRA,目前已有较多关于孟鲁司特治疗儿童OSAS的文献报道。Shokouhi等[43]研究结果显示,口服孟鲁司特治疗OSAS患儿12周后,与治疗前相比,腺样体肥大患儿的临床症状、睡眠参数及腺样体大小均较治疗前有明显改善,并且差异有统计学意义(P<0.05)。Goldbart等[44]进行的一项前瞻性、双盲、随机对照试验结果显示,与安慰剂组比较,孟鲁斯特组OSAS患儿口服孟鲁司特16周后,患儿睡眠呼吸暂停低通气指数(apnea-hypopnea index,AHI)显著下降。此外,对于手术切除腺样体后腺样体残留的OSAS患儿,采用孟鲁司特和鼻内激素联合治疗疗效确切[45],因此联合用药有望开辟治疗儿童OSAS的新途径。
综上所述,白三烯作为强有力的炎症介质,与多种细胞因子、炎症介质相互作用,在多种肺部疾病中扮演重要角色。以孟鲁司特为代表的LTRA已广泛应用于多种肺部疾病的预防与治疗,疗效确切。作为新型的非激素类治疗药物,LTRA具有广阔的应用前景,与传统ICS治疗儿童喘息性肺部疾病相比,孟鲁司特具有不良反应少、安全性高、患儿依从性好、长期用药耐受性好,故患儿家属更倾向于使用口服孟鲁司特。目前,有关LTRA与肺部疾病的研究主要集中在肺部炎症性疾病,更多关于LTRA受体非依赖性抗炎作用的研究尚有待开展。此外,白三烯受体基因的多态性将直接影响患儿对药物的反应性,而在肺部疾病相关基因研究中,白三烯受体基因相关研究较少,具有潜在的研究价值。随着分子生物学技术的飞速发展,通过敲除与白三烯致病的有关基因以切断其致病途径的基因治疗方法有望成为肺部疾病治疗的新篇章。






























