
探讨Yes相关蛋白(YAP)在蜕膜组织中的表达强度与小鼠流产的关系。
2013年6月至2015年1月,选择无特殊病原体(SPF)级21只雌性CBA/J小鼠、5只雌性DBA/2J小鼠和6只雄性BLAB/c小鼠为研究对象。21只雌性CBA/J小鼠按照随机数字表法,随机分成2组,将10只雌性CBA/J小鼠与5只雄性DBA/2J小鼠合笼,建立雌性(♀)CBA/J×雄性(♂)DBA/2J流产模型,纳入流产组,将11只雌性CBA/J小鼠与6只雄性BALB/c小鼠合笼,建立♀CBA/J×♂BALB/c正常妊娠模型,纳入对照组。记录2组雌性CBA/J小鼠存活胚胎数及流产率,随后采用苏木精-伊红(HE)染色观察蜕膜组织,并采用免疫组织化学染色法检测YAP在蜕膜组织中的分布,以及YAP表达强度。采用统计学方法比较2组小鼠存活胚胎数、流产率及不同YAP表达强度的小鼠数。实验过程中对动物的处置符合动物伦理学要求。
①流产组小鼠存活胚胎数的中位数(5.0个)低于对照组小鼠存活胚胎数的中位数(7.5个),2组比较,差异有统计学意义(Z=-2.678,P=0.007)。流产组小鼠流产率的中位数(33.3%)高于对照组小鼠流产率的中位数(5.6%),2组比较,差异亦有统计学意义(Z=-3.797,P<0.001)。②YAP主要表达于小鼠蜕膜细胞的细胞质中,将免疫组织化学结果进行半定量评分的结果显示,流产组YAP表达水平较对照组降低,并且差异有统计学意义(Z=-2.445,P=0.014)。
♀CBA/J×♂DBA/2J小鼠流产模型中的胚胎丢失具有高度重复性,流产率较高且相对恒定。YAP可能参与流产的发生、发展。

版权所有,未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别申明,本刊刊出的所有文章不代表中华医学会和本刊编辑委员会的观点。
本刊为电子杂志,以光盘形式出版。本册应读者需求按需印刷,随光盘免费赠阅。光盘如有质量问题,请向编辑部调换。
自然流产是妇产科常见的病理性妊娠之一,其病因涉及遗传、内分泌和免疫等诸多因素。自然流产的发生率为10%~20%,而80%自然流产发生在早孕期[1]。自然流产的发生机制十分复杂,迄今尚未完全阐明。导致自然流产的已知因素中最主要的因素为胎儿因素[2],其次为母体因素,而导致自然流产的常见母体因素包括母体免疫异常、内分泌紊乱、生殖系统解剖异常、生殖道及全身感染、精神心理因素、严重的全身合并症及并发症等[3,4,5]。蜕膜作为母胎界面的重要组成部分,在妊娠的建立及维持中起至关重要的作用。蜕膜组织可以限定滋养细胞的侵入程度,一方面保证胎儿从母体获得充足血供,另一方面避免母体因滋养细胞过度侵袭而受损[6]。蜕膜细胞分泌的大量脂滴、糖原及生长因子能够为胚胎提供营养,影响其生长及发育。蜕膜化同时伴随大量血管形成及重塑,这些血管为胚胎生长发育提供了充分的血供及营养[6,7]。此外,蜕膜组织还参与协调母胎免疫应答,使胎儿免受母体排斥,维持正常妊娠[8]。因此,子宫内膜蜕膜化异常不仅可导致流产,而且与许多妊娠合并症的发生有关。
建立尽可能排除胎儿因素且稳定的流产动物模型是研究母体因素所致流产的基础。Clark等[9]于1980年构建了经典的雌性(♀)CBA/J×雄性(♂)DBA/2J小鼠流产模型,该模型流产率较高(20%~45%)且相对恒定[9,10]。Chen等[11]研究结果发现,Yes相关蛋白(Yes-associated protein,YAP)参与调节子宫内膜基质细胞蜕膜化。本研究在经典的♀CBA/J×♂DBA/2J小鼠流产模型基础上,采用免疫组织化学方法检测YAP在蜕膜组织中的表达水平及分布,初步探讨YAP表达水平与小鼠流产的关系。现将研究结果报道如下。
2013年6月至2015年1月,选择无特殊病原体(specific pathogen free,SPF)级21只雌性CBA/J小鼠、5只雄性DBA/2J小鼠和6只雄性BLAB/c小鼠为研究对象。本研究纳入标准:周龄为7~8周的性成熟小鼠,体重为20~30 g。21只雌性CBA/J小鼠及5只雄性DBA/2J小鼠购于北京华阜康生物科技股份有限公司[许可证号:SCXK(京)2013-0019],6只雄性BLAB/c小鼠购于四川大学华西实验动物中心[许可证号:SCHX (川)2013-026]。实验动物饲养于四川大学华西实验动物中心,饲养条件:每日自由饮水、摄食,自然明暗环境,室温为20~26 ℃,湿度为40%~60%,独立通气笼盒(individual ventilated cages,IVC)饲养,适应环境为1~2周。本实验遵照四川大学华西第二医院关于实验动物使用及管理相关规定进行,实验过程中对动物的处置符合动物伦理学标准。
兔抗鼠TEF1抗体[EPR3967(2),批号:ab133533,英国Abcam公司]。兔抗鼠YAP1抗体(EP1674Y,批号:ab52771,英国Abcam公司)。辣根过氧化酶标记的羊抗兔免疫球蛋白(immunoglobulin, Ig)G (批号:ZB-2301,中国中杉金桥公司)。苏木精-伊红(hematoxylin-eosin, HE)染色试剂盒(批号:L9406,上海圻明生物科技有限公司)。免疫组织化学链霉菌抗生物素蛋白-过氧化物酶连结(streptavidin-perosidase,SP)法染色试剂盒(批号:sp-9000,中国中杉金桥公司)。光学显微镜(日本Olympus公司)。
小鼠流产模型的建立,参照文献[9,10,12]。以苦味酸涂抹于小鼠不同部位来标记不同种系的小鼠。采用随机数字表法,将21只雌性CBA/J小鼠随机分成2组,10只雌性CBA/J小鼠与5只雄性DBA/2J小鼠合笼,建立流产模型,纳入流产组;另11只雌性CBA/J小鼠与6只雄性BALB/c小鼠合笼,建立正常妊娠模型,纳入对照组。
将2组小鼠第1次合笼4 d内未检出阴栓、可疑阴栓的雌性小鼠,2 d后交换雄性小鼠进行第2次合笼,第2次合笼后根据可疑阴栓及体重变化估计孕龄。
根据阴栓判断是否妊娠[9,10]。每日早、晚分别观察1次,检出阴栓时则判断为妊娠第0天。每日测量小鼠体重,未检出可疑阴栓的小鼠则根据体重变化来估计孕龄(从总体重增加8~10 g为孕龄为13~15 d,或孕龄为10 d后每日体重增加1~2 g)。
确定妊娠后,于妊娠第13~15天采用颈椎脱臼法处死小鼠。存活胚胎及吸收胚胎的判断见文献[9]。存活胚胎:子宫内无淤血,胚胎发育良好,个体较大,呈淡红色。吸收胚胎:剖视时子宫呈"竹节状",胎盘体积明显缩小,胚胎呈黑褐色,胎儿及胎盘明显出血坏死。记录流产组和对照组的存活胚胎数、吸收胚胎数,并计算2组小鼠流产率。流产率(%)=吸收胚胎数/(吸收胚胎数+存活胚胎数)×100%[9,10]。
采用随机数字表法,随机选取10个流产组新鲜吸收胚胎邻近蜕膜组织,同样方法选取10个对照组新鲜存活胚胎邻近蜕膜组织。将胎鼠胎盘单位连同蜕膜与子宫壁分离,采集蜕膜组织,面积为4 mm×4 mm,置于10%中性甲醛溶液中固定24 h后脱水,常规石蜡包埋、切片以备免疫组织化学检测。
按常规步骤进行HE染色和免疫组织化学SP法染色。HE染色步骤如下:石蜡切片脱蜡水化,双蒸水及磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗;苏木精染色3 min,1%盐酸酒精分色,流水冲洗返蓝,伊红染色10 s;最后脱水、透明、中性树胶封片。免疫组织化学SP法染色步骤如下:切片于孵箱中孵育20 min,二甲苯脱蜡,浓度梯度的乙醇水化,去离子水振荡洗涤,抗原修复,3%H2O2溶液室温避光浸泡,室温滴加山羊血清封闭15 min,滴加兔抗鼠TEF1抗体或兔抗鼠YAP1抗体(均为1∶200稀释),4 ℃冰箱过夜;滴加辣根过氧化酶标记的羊抗兔IgG(1∶50稀释),常温孵育30 min;PBS洗涤,DAB试剂盒显色,苏木精复染2 min,流水冲洗返蓝;浓度梯度乙醇脱水;中性树胶封片。
每张切片于正置光学显微镜高倍视野下观察,随机选取10个视野,综合染色强度和染色结果呈阳性细胞数量进行判定:①按切片中细胞着色深浅程度进行评分:细胞无显色为0分,呈淡黄色为1分,呈棕黄色为2分,呈棕褐色为3分。②按阳性细胞占同类细胞的百分比进行评分:呈阴性为0分,阳性细胞占同类细胞百分比≤20%为1分,20%<阳性细胞占同类细胞百分比≤50%为2分,50%<阳性细胞占同类细胞百分比≤75%为3分;阳性细胞占同类细胞百分比>75%为4分。取①、②项评分的乘积作为总积分:总积分为0~3分,则判断为低表达;3分<总积分≤7分,则判断为中表达;7分<总积分≤12分,则判断为高表达[13]。分别记录2组低表达、中表达及高表达的小鼠数。
本研究所得数据采用SPSS 19.0统计学软件进行统计学分析。首先对计量资料进行分布状态分析,对呈非正态分布的计量资料,如胚胎植入数及流产率,采用M(P25~P75)表示,组间比较采用Mann-Whitney U检验。组间小鼠蜕膜组织不同YAP表达强度的小鼠数比较,采用等级资料的秩和检验。以P<0.05表示差异有统计学意义。
第1次合笼4 d内4只雌性小鼠检出明显阴栓,余7只雌性小鼠未检出明显阴栓。第2次合笼,3只雌性小鼠检出明显阴栓,另4只雌性小鼠检出可疑阴栓。流产组小鼠合笼后妊娠情况,见表1。
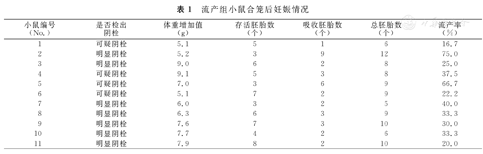
流产组小鼠合笼后妊娠情况
流产组小鼠合笼后妊娠情况
| 小鼠编号(No.) | 是否检出阴栓 | 体重增加值(g) | 存活胚胎数(个) | 吸收胚胎数(个) | 总胚胎数(个) | 流产率(%) |
|---|---|---|---|---|---|---|
| 1 | 可疑阴栓 | 5.1 | 5 | 1 | 6 | 16.7 |
| 2 | 明显阴栓 | 5.2 | 3 | 9 | 12 | 75.0 |
| 3 | 明显阴栓 | 9.0 | 6 | 2 | 8 | 25.0 |
| 4 | 可疑阴栓 | 9.1 | 5 | 3 | 8 | 37.5 |
| 5 | 可疑阴栓 | 7.0 | 3 | 6 | 9 | 66.7 |
| 6 | 可疑阴栓 | 5.1 | 7 | 2 | 9 | 22.2 |
| 7 | 明显阴栓 | 6.0 | 3 | 2 | 5 | 40.0 |
| 8 | 明显阴栓 | 6.3 | 6 | 3 | 9 | 33.3 |
| 9 | 明显阴栓 | 7.6 | 7 | 3 | 10 | 30.0 |
| 10 | 明显阴栓 | 7.7 | 4 | 2 | 6 | 33.3 |
| 11 | 明显阴栓 | 7.9 | 8 | 2 | 10 | 20.0 |
第1次合笼4 d内8只雌性小鼠检出明显阴栓,2只雌性小鼠出现可疑阴栓。对照组小鼠合笼后妊娠情况,见表2。
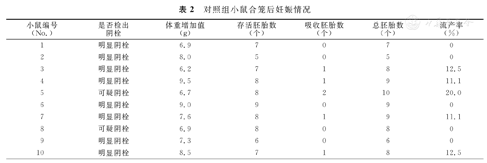
对照组小鼠合笼后妊娠情况
对照组小鼠合笼后妊娠情况
| 小鼠编号(No.) | 是否检出阴栓 | 体重增加值(g) | 存活胚胎数(个) | 吸收胚胎数(个) | 总胚胎数(个) | 流产率(%) |
|---|---|---|---|---|---|---|
| 1 | 明显阴栓 | 6.9 | 7 | 0 | 7 | 0 |
| 2 | 明显阴栓 | 8.0 | 5 | 0 | 5 | 0 |
| 3 | 明显阴栓 | 6.2 | 7 | 1 | 8 | 12.5 |
| 4 | 明显阴栓 | 9.5 | 8 | 1 | 9 | 11.1 |
| 5 | 可疑阴栓 | 6.7 | 8 | 2 | 10 | 20.0 |
| 6 | 明显阴栓 | 9.0 | 9 | 0 | 9 | 0 |
| 7 | 明显阴栓 | 7.6 | 8 | 1 | 9 | 11.1 |
| 8 | 可疑阴栓 | 6.9 | 8 | 0 | 8 | 0 |
| 9 | 明显阴栓 | 7.3 | 6 | 0 | 6 | 0 |
| 10 | 明显阴栓 | 8.5 | 7 | 1 | 8 | 12.5 |
流产组小鼠存活胚胎数的中位数为5.0个(3.0~7.0个),低于对照组小鼠存活胚胎数的中位数7.5个(6.8~8.0个),2组比较,差异有统计学意义(Z=-2.678,P=0.007)。流产组小鼠流产率的中位数为33.3%(22.2%~40.0%),高于对照组小鼠流产率的中位数5.6%(0~12.5%),2组比较,差异亦有统计学意义(Z=-3.797,P<0.001)。
流产组雌性小鼠蜕膜组织HE染色可见不同程度变性、坏死,滋养细胞层可见炎性细胞浸润,血管内可见不同程度纤维素凝结及静脉淤血,见图1A;对照组雌性小鼠蜕膜组织HE染色可见蜕膜细胞排列整齐、结构清晰、血窦丰富均匀,见图1B。
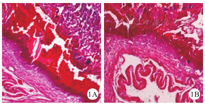

注:HE为苏木精-伊红
YAP主要表达于小鼠蜕膜细胞的细胞质,见图2。根据免疫组织化学SP法染色结果半定量评分结果,将2组YAP高、中、低表达强度小鼠数进行比较的结果显示,流产组小鼠YAP表达水平较对照组降低,并且差异有统计学意义(Z=-2.445,P=0.014)。2组小鼠蜕膜组织YAP免疫组织化学SP法染色结果进行半定量评分比较,见表3。

2组小鼠蜕膜组织不同Yes相关蛋白表达强度的小鼠数(只)
2组小鼠蜕膜组织不同Yes相关蛋白表达强度的小鼠数(只)
| 组别 | 鼠数 | 低表达 | 中表达 | 高表达 |
|---|---|---|---|---|
| 流产组 | 10 | 5 | 4 | 1 |
| 对照组 | 10 | 1 | 3 | 6 |
| Z值 | -2.445 | |||
| P值 | 0.014 |
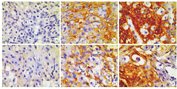

注:YAP为Yes相关蛋白,SP为链霉菌抗生物素蛋白-过氧化物酶连结
由于引起流产的原因多种多样,涉及母体不同的遗传背景、营养水平、生活与工作环境、社会背景、经济收入差异等复杂因素,建立稳定的流产动物模型对于排除复杂的混杂因素、研究流产机制具有重要意义。本研究结果显示,流产组小鼠存活胚胎数的中位数(5.0个),低于对照组小鼠存活胚胎数的中位数(7.5个),2组比较,差异有统计学意义(Z=-2.678,P=0.007);流产组小鼠流产率的中位数(33.3%),高于对照组小鼠流产率的中位数(5.6%),2组比较,差异亦有统计学意义(Z=-3.797,P<0.001),这与文献报道结果一致[9,10],再次证实♀CBA/J×♂DBA/2J小鼠流产模型流产率较高且相对恒定。
建立尽可能排除胎儿因素且稳定的流产动物模型是研究母体因素所致流产的基础。♀CBA/J×♂DBA/2J小鼠流产模型中所采用雌性CBA/J小鼠及雄性DBA/2J小鼠至少经过20代以上同胞交配而成,为近交系小鼠,基因高度纯化,其中98.6%基因位点为纯合位点,个体间差异趋近于零。小鼠流产模型中因胚胎染色体异常所致流产率仅约为4%[14]。因此,该模型排除了最容易引起流产的胚胎原因,这对于研究母体因素引起流产的作用机制更具有价值。在该模型中可见,吸收胚胎局部可见出血、血栓形成、组织坏死、胎盘和胚胎发育不良。镜下可见吸收胚胎蜕膜细胞不同程度变性、坏死,滋养细胞层可见炎性细胞浸润,血管内可见不同程度纤维素凝结及静脉淤血,提示该流产模型中蜕膜组织异常。
YAP作为Hippo信号通路的核心效应分子,由一系列上游分子(Mst1/2、Lats1/2、Sav1等)及多种转录后修饰来调节,能够促进细胞增殖、分化、再生以及维持干细胞活性[15,16]。由于YAP缺乏明显的DNA结合区域,需要与其他DAN结合转录因子,如TEAD等结合来发挥调控下游靶基因的作用[17,18]。Chen等[11]研究结果显示,YAP参与调节子宫内膜基质细胞蜕膜化。本研究通过免疫组织化学SP法染色结果发现,YAP在流产组蜕膜组织中的表达强度低于对照组,并且差异有统计学意义(Z=-2.445,P=0.014),结合蜕膜组织学的异常表现,提示YAP可能通过影响内膜基质细胞蜕膜化进程,尤其是干扰着床期的蜕膜细胞增殖,参与流产过程。
本研究仅初步探讨YAP在已流产小鼠蜕膜基质细胞中的表达情况,但YAP的差异性表达是导致流产的原因,还是流产后的表达,有待进一步研究证实。此外,流产模型中TEAD等YAP相关蛋白的表达水平及Hippo信号通路干扰后对妊娠的影响等,仍有待进一步研究明确。在今后的研究中,可以考虑在小鼠体内进行功能缺失性及获得性实验进一步验证HIPPO-YAP对蜕膜化的调节作用。






























