
探讨多囊卵巢综合征(PCOS)不孕症患者及非PCOS不孕症患者卵泡液基因表达谱的差异,旨在阐明长链非编码(Lnc)RNA参与PCOS发病过程中的可能机制。
选取2017年1月1日至5月30日,6例不孕症患者在江苏省苏北人民医院接受辅助生殖技术治疗过程中所产生的卵泡液为研究对象。根据是否为PCOS患者,将其分为PCOS组(n=3)和非PCOS组(n=3)。采用独立样本t检验,对受试者年龄、不孕年限、人体质量指数(BMI)、促黄体激素(bLH)、基础卵泡刺激素(bFSH)、雌二醇、睾酮、空腹血糖(FBG)、催乳素、抗苗勒管激素(AMH)水平等呈正态分布的计量资料进行组间比较。采用Mann-Whitney U秩和检验,对LncRNA与信使RNA(mRNA)表达水平[百万外显子的碱基片段(FPKM)值]、LncRNA与mRNA的长度等非正态分布的计量资料进行分析。本研究遵循的程序符合江苏省苏北人民医院人体试验委员会所制定的伦理学标准,得到该委员会批准。
①本研究2组患者年龄、不孕年限、BMI、bLH、bFSH、雌二醇、睾酮、FBG、催乳素、AMH水平比较,差异均无统计学意义(P>0.05)。② 2组患者LncRNA与mRNA的中位表达水平分别为0.455 FPKM(0.035~1.291 FPKM)和0.848 FPKM(0.315~1.735 FPKM),组间比较,差异有统计学意义(U=0.041,P=0.032 3)。③ LncRNA的中位长度为654 bp (499~1 069 bp),mRNA的中位长度为1 517 bp (709~2 818 bp),二者比较,差异无统计学意义(U=0.038,P=0.051 4)。④与非PCOS患者比较,PCOS患者卵泡液LncRNA差异表达基因共计1 866个,其中表达水平上调的基因为1 253个,下调基因为613个。⑤基因本体(GO)富集分析中排序优先的功能有:腺嘌呤代谢过程、腺嘌呤生物合成过程、三磷酸胞苷生物合成过程等。⑥排序优先的京都基因与基因组百科全书(KEGG)信号通路有:人类嗜T淋巴细胞病毒感染、嘌呤代谢、嘧啶代谢、趋化因子、氨基酸的生物合成、哮喘、RNA聚合酶、范可尼贫血等,主要涉及细胞生物合成、蛋白合成、细胞组分合成等生物学功能。
PCOS组及非PCOS组不孕症患者LncRNA和mRNA转录水平明显改变,提示PCOS患者卵泡液内多项生物学功能及信号通路的变化在其中发挥重要作用。

版权所有,未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别申明,本刊刊出的所有文章不代表中华医学会和本刊编辑委员会的观点。
本刊为电子杂志,以光盘形式出版。本册应读者需求按需印刷,随光盘免费赠阅。光盘如有质量问题,请向编辑部调换。
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是育龄期女性最常见的生殖内分泌疾病之一,PCOS可影响全世界5%~10%育龄妇女的身心健康[1]。PCOS的临床表现呈多态性,包括月经紊乱或稀发、闭经、多毛、肥胖等,同时亦可伴卵巢多囊性增大等。PCOS的发病机制迄今仍未阐明,可能与环境及遗传因素等有关[2,3]。长链非编码RNA(long non-coding RNA,LncRNA)是一类转录本长度>200 nt的RNA,通常不编码蛋白[4],但LncRNA可以在表观遗传调控、转录调控以及转录后调控等实现对基因表达的调控[5]。本研究通过对非PCOS不孕症患者及PCOS不孕症患者卵泡液LncRNA表达差异进行生物信息学分析,旨在为PCOS的发病机制及其诊治提供新的思路。现将研究结果报道如下。
选取2017年1月1日至5月30日,6例不孕症患者在江苏省苏北人民医院接受辅助生殖技术治疗过程中所产生的卵泡液为研究对象,不孕症患者年龄<30岁。所有卵泡液均来自江苏省苏北人民医院生物样本库。本研究纳入标准:①均为原发性不孕不育症患者;②男方精液质量检测结果提示正常;③促排卵方案一致;④PCOS患者的诊断均符合2003年鹿特丹共识[6]。排除标准:①子宫内膜异位症患者;②卵泡黄素化未破裂综合征患者;③合并内科其他疾病患者,包括贫血、甲状腺功能异常、糖尿病、免疫系统疾病等。根据是否为PCOS患者,将其分为PCOS组(n=3)和非PCOS组(n=3)。本研究遵循的程序符合江苏省苏北人民医院人体试验委员会所制定的伦理学标准,得到该委员会批准。
对PCOS的诊断标准采用2003年的鹿特丹共识:①稀发排卵或无排卵;②高雄激素血症或高雄激素的临床表现(多毛、痤疮等);③超声检查在月经周期或黄体酮撤退后出血的第3~5天进行,超声检查结果显示卵巢多囊样改变:单侧或双侧卵巢中,直径为2~9 mm的卵泡数≥12个和(或)卵巢体积≥10 mL[6]。
对受试者进行LncRNA高通量测序。样本库工作人员将纳入的6例患者在接受辅助生殖技术治疗过程中产生的卵泡液进行标准化、规范化收集,收集后室温静置30 min,并于4 ℃低温环境下,3 000 r/min离心10 min(离心半径为16.8 cm),之后分离上清、沉淀,收集上清液并置于-80 ℃环境保存待用。
Ribo-Zero去除核糖体试剂盒(批号:7E010H6,南京Vazyme公司);片段化试剂(批号:0006358486,美国Agilent公司);随机引物(批号:00546003,美国Thermo Fisher Scientific公司);RNA提取试剂盒(批号:151012397,美国Qiagen公司)。Multifuge X3R低温离心机(美国Thermo Fisher Scientific公司),ESCOAC2-6S1生物安全柜(新加坡Esco公司),Forma 907超低温冰箱(美国Thermo Fisher Scientific公司),HiSeq 2500测序仪器(美国Illumina公司),Agilent 2100生物分析仪(美国Agilent Technologies公司)。
卵泡液样本收集后,采用Qiagen RNA提取试剂盒提取RNA。提取后的总RNA采用琼脂糖凝胶电泳检测RNA完整性,采用Nanodrop检测总RNA纯度和浓度。总RNA质检合格后,通过Ribo-Zero™试剂盒去除核糖体RNA,采用片段化试剂将RNA片段化。随后以片段化的去rRNA的RNA为模板合成cDNA,PCR扩增获得最终测序文库。质检合格后的文库采用Illum ina Hiseq 2500进行测序,测序读长为双端2×150 bp(PE150)。每个样本有效数据(clean data)不少于10 G。采用HISAT+StringTie+Ballgown分析软件(美国约翰霍普金斯生物计算中心)实现RNA-Seq读取的高效比对,尤其是跨越多个外显子的读取。全部试验步骤均严格按照试剂盒、仪器说明书进行。
利用StringTie-Merge分析软件将LncRNA与mRNA各个转录本的平均表达水平进行合并,提取各样本转录本百万外显子的碱基片段(fragments per kilobase of exon per million fragments mapped,FPKM)值,分别从基因与转录本2个角度进行各样本FPKM值。
根据2组间LncRNA表达水平的不同,运用聚类软件Cluster3.0(美国斯坦福大学)进行层次聚类运算,表达程度越相似的样品聚类在一起。聚类结果在Java环境下绘制热图。
基因本体(gene ontology, GO)富集分析采用top GO软件(美国国家人类基金组研究所)[7],并参考GO数据库(http://geneontology.org/)对差异表达的LncRNA靶基因对分子功能(molecular function)、生物学过程(biological process)和细胞成分(cellular component)进行GO富集分析。
京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)信号通路分析采用KOBAS软件(日本大学化学研究所)[8],并参考KEGG数据库(http://www.genome.jp/kegg/)对差异表达的LncRNA靶基因进行KEGG信号通路分析。KEGG是有关信号通路的主要公共数据库,本研究应用超几何检验,找出显著性差异表达基因中显著性富集的主要生化代谢途径和信号通路。
本研究数据采用SPSS 20.0统计学软件包进行统计学分析。采用Ssize软件估算满足本研究统计检验的最小样本量。对计量资料的分布状态进行分析,对受试者年龄,不孕年限,人体质量指数(body mass index,BMI),基础促黄体激素(basic luteinizing hormone,bLH),基础卵泡刺激素(basic follicle stimulating hormone,bFSH),雌二醇,睾酮,空腹血糖(fasting blood glucose,FBG),催乳素,抗苗勒管激素(anti-Mullerian hormone,AMH)水平及bAFC等呈正态分布的计量资料,采用 ±s表示,组间比较,采用独立样本t检验。LncRNA与mRNA表达水平、LncRNA与mRNA的长度等非正态分布的计量资料,采用M(P25~P75)表示,组间比较,采用Mann-Whitney U秩和检验。所有统计学检验采用双侧检验,以P<0.05表示差异有统计学意义。
±s表示,组间比较,采用独立样本t检验。LncRNA与mRNA表达水平、LncRNA与mRNA的长度等非正态分布的计量资料,采用M(P25~P75)表示,组间比较,采用Mann-Whitney U秩和检验。所有统计学检验采用双侧检验,以P<0.05表示差异有统计学意义。
2组患者年龄、不孕年限、BMI、bLH、bFSH、雌二醇、睾酮、FBG、催乳素、AMH水平比较,差异均无统计学意义(P>0.05),而2组患者的bAFC水平比较,差异有统计学意义(P<0.001)。2组患者一般临床资料比较,见表1。
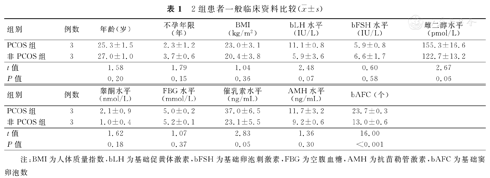
2组患者一般临床资料比较( ±s)
±s)
2组患者一般临床资料比较( ±s)
±s)
| 组别 | 例数 | 年龄(岁) | 不孕年限(年) | BMI(kg/m2) | bLH水平(IU/L) | bFSH水平(IU/L) | 雌二醇水平(pmol/L) |
|---|---|---|---|---|---|---|---|
| PCOS组 | 3 | 25.3±1.5 | 2.3±1.2 | 23.0±3.1 | 11.1±0.8 | 5.9±0.8 | 155.3±16.6 |
| 非PCOS组 | 3 | 27.0±1.0 | 3.7±0.6 | 20.4±3.8 | 5.9±3.6 | 6.6±1.7 | 122.7±13.2 |
| t值 | 1.58 | 1.79 | 1.04 | 2.48 | 0.60 | 2.67 | |
| P值 | 0.20 | 0.15 | 0.36 | 0.07 | 0.58 | 0.06 |
| 组别 | 例数 | 睾酮水平(nmol/L) | FBG水平(mmol/L) | 催乳素水平(ng/mL) | AMH水平(ng/mL) | bAFC (个) |
|---|---|---|---|---|---|---|
| PCOS组 | 3 | 2.1±0.9 | 5.0±0.2 | 37.0±6.5 | 11.7±3.2 | 23.7±0.3 |
| 非PCOS组 | 3 | 1.0±0.4 | 5.2±0.1 | 23.1±5.5 | 9.2±0.6 | 13.0±0.6 |
| t值 | 1.62 | 1.07 | 2.83 | 1.36 | 16.00 | |
| P值 | 0.18 | 0.37 | 0.05 | 0.30 | <0.001 |
注:BMI为人体质量指数,bLH为基础促黄体激素,bFSH为基础卵泡刺激素,FBG为空腹血糖,AMH为抗苗勒管激素,bAFC为基础窦卵泡数
根据PCOS组和非PCOS组卵泡液样本提取所得RNA质检结果显示,RNA提取完整性、纯度及总量均可满足下一步建库测序。
将LncRNA分为基因间LncRNA和基因内LncRNA共2类。LncRNA基因分类及分类模式柱状图,见图1。
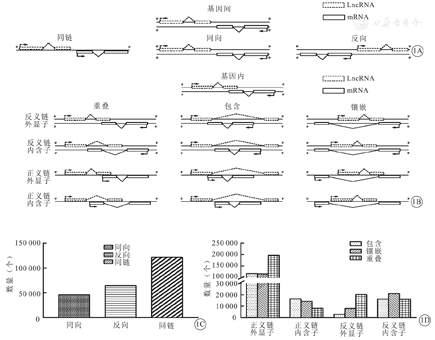

注:LncRNA为长链非编码RNA,mRNA为信使RNA
2组患者LncRNA与mRNA的中位表达水平分别为0.455 FPKM(0.035~1.291 FPKM)和0.848 FPKM(0.315~1.735 FPKM),组间比较,差异有统计学意义(U=0.041,P=0.032 3)。LncRNA与mRNA表达水平比较,见图2。


注:LncRNA为长链非编码RNA,mRNA为信使RNA
LncRNA长度呈左偏态分布,其中位长度为654 bp(499~1 069)bp,mRNA长度亦呈左偏态分布,其中位长度为1 517 bp(709~2 818 bp),其中,≥3 000 bp的LncRNA为19 737个(22.8%)。LncRNA与mRNA长度比较,差异无统计学意义(U=0.038,P=0.051 4)。筛选获得的LncRNA与mRNA长度分析,见图3。
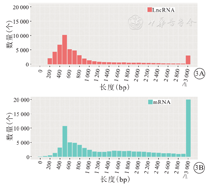

注:LncRNA为长链非编码RNA,mRNA为信使RNA
将筛选获得LncRNA与mRNA外显子数量比较结果显示,82.5% (43 754/53 033) LncRNA的外显子数量为2~4个,仅6.4% (3/53 033) LncRNA包含6个以上外显子。mRNA的外显子数量主要集中在3~6个(45.1%,39 097/86 694),46.4% (40 237/86 694) mRNA包含6个以上外显子。LncRNA与mRNA的外显子数量分析结果,见图4。
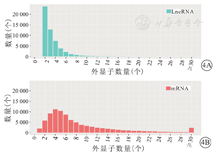

注:LncRNA为长链非编码RNA,mRNA为信使RNA
根据LncRNA差异盒形图可以观察到,芯片扫描各组样本后荧光密度值的分布结果如下。LncRNA原始数据经过标准化后2组平均值接近在一个水平上,数据中间的50%范围值一致性较高。PCOS组与非PCOS组患者卵泡液LncRNA差异表达基因共计1 866个,其中表达水平上调的基因为1 253个,下调基因为613个,这些LncRNA可能通过调控邻近mRNA的表达,从而发挥生物学功能。差异LncRNA表达分析图,见图5。
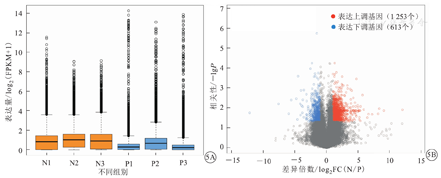

注:LncRNA为长链非编码RNA,FPKM为百万外显子的碱基片段,N1、N2、N3为非PCOS组,P1、P2、P3为PCOS组,FC(N/P)为非PCOS组与PCOS组样本质检表达量的比值,PCOS为多囊卵巢综合征
根据2.4.1所得结果以及2组间LncRNA和mRNA表达水平的不同,通过分层聚类分析使表达程度相似的样品聚类在一起,进一步分析2组间的关系。差异LncRNA聚类分析图,见图6。
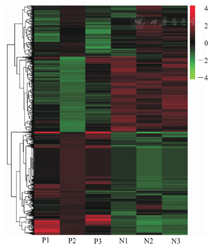

注:红色表示表达水平上调,绿色表示表达水平下调。P1、P2、P3为PCOS组,N1、N2、N3为非PCOS组。图例表示lgP。LncRNA为长链非编码RNA,PCOS为多囊卵巢综合征
本研究对差异最明显的10个LncRNA(TMPRSS2、FGF7P2、LINC00092、GGNBP1、CCDC150、ZNF702P、CENPL、RNF115、AKT3、WISP3)进行分析,寻找与其变化密切相关的mRNA。本研究测序结果显示,与mRNA关系最密切的3个LncRNA分别为LncRNA_ID: Lnc_ENST00000469395.1,mRNA_ID:ENST00000370179.7,mRNA_Gene_Symbol:PPDP-001; LncRNA_ID:Lnc_ENST00000332473.2,mRNA_ID: ENST00000614573.4, mRNA_Gene_Symbol: PDXDC1-002; LncRNA_ID:Lnc_MSTRG.69513.1, mRNA_ID: ENST00000637348.1, mRNA_Gene_Symbol:CHRNA7-029等。
通过生信方法分析LncRNA调控的mRNA,再进行GO富集分析。结果显示LncRNA调控的mRNA的功能与生物过程、分子功能和细胞组分相关。GO富集分析中排序优先的功能为:腺嘌呤代谢过程、腺嘌呤生物合成过程、三磷酸胞苷生物合成过程等。GO富集分析图,见图7。
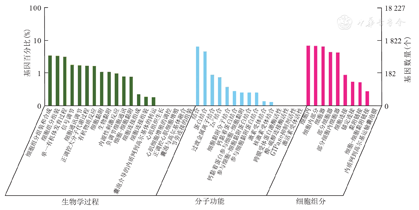

注:GO为基因本体
从差异表达的LncRNA靶基因位置富集看出排序优先的KEGG信号通路为:人类嗜T淋巴细胞病毒感染、嘌呤代谢、嘧啶代谢、趋化因子、氨基酸的生物合成、哮喘、RNA聚合酶、范可尼贫血等,主要涉及细胞生物合成、蛋白合成、细胞组分合成等生物学功能。KEGG信号通路分析图,见图8。
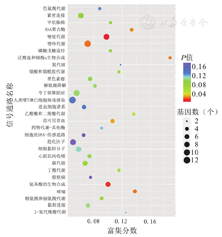

注:KEGG为京都基因与基因组百科全书
随着自然环境因素和社会心理因素的改变,年轻的生育群体中不孕不育以及PCOS患者数量呈明显升高趋势[9]。尤其我国"全面二胎"政策开放以后,生育能力已经明显下降的高龄妇女(年龄≥40岁)要求生育二胎的需求在不断增多。越来越多的人群开始关注生殖健康问题。LncRNA起初被认为是基因组转录的"噪音",是RNA聚合酶Ⅱ转录的副产物,不具有生物学功能[10,11]。但是近年研究结果显示,LncRNA参与了转录水平调控、转录后水平调控以及表观遗传调控等多种重要调控[12]。
卵泡液是卵泡从原始卵泡发育到成熟卵泡过程中所处的微环境,直接影响卵子质量以及辅助生殖患者的临床妊娠结局[13,14]。卵泡液中除了含有多种激素,卵泡刺激素(follicle stimulating hormone,FSH),黄体生成素(luteinizing hormone,LH),雌二醇及睾酮等,还含有多种生长因子与多种蛋白质、多肽、氨基酸和核苷酸[15,16]。Huang等[10]通过微阵列基因芯片对LncRNA与PCOS的研究结果发现,PCOS患者的卵丘细胞和非PCOS患者卵丘细胞中,许多LncRNA存在明显表达差异。
本研究通过对苏北人民医院生殖医学中心接受辅助生殖治疗的临床育龄期PCOS患者及非PCOS患者卵泡液样本的收集,采用LncRNA鉴定技术[17]、LncRNA高通量测序技术[18]、LncRNA验证技术等,分析2组患者卵泡液LncRNA的差异表达情况。其中差异聚类分析(分析表达量FPKM)、GO富集分析、KEGG分析、差异LncRNA火山图分析结果显示2组患者LncRNA差异表达基因中,表达水平上调的基因为1 253个,表达水平下调的基因为613个。本研究结果亦显示,GO富集分析中排序优先的功能为:腺嘌呤代谢过程、腺嘌呤生物合成过程、蛋白质的负调控、CTP生物合成过程等。信号通路显著性富集可以确定特异性基因生物信号传导和代谢途径,排序优先的KEGG信号通路为:人类嗜T淋巴细胞病毒感染、嘌呤代谢、嘧啶代谢、趋化因子、氨基酸的生物合成、哮喘、RNA聚合酶、范可尼贫血等,主要涉及细胞生物合成、蛋白合成、细胞组分合成等生物学功能。
本研究旨在发现并阐明LncRNA参与PCOS发病过程中的具体作用及可能机制,为临床治疗PCOS提供新的思路,同时为PCOS患者的早期干预、抑制疾病发展以及降低并发症发生率,寻找PCOS诊断和治疗的新靶点,从而为提高PCOS不孕症患者治疗结局及改善PCOS患者生活质量提供新契机。






























