
探讨中孕期检测结果为胎儿染色体平衡易位的细胞遗传学特点及妊娠结局。
选择2012年1月至2015年12月,于广西壮族自治区妇幼保健院经羊水穿刺染色体核型分析,诊断为胎儿染色体平衡易位的89例中孕期孕妇为研究对象,其中1例为双胎妊娠。采用经腹羊膜腔穿刺术,取羊水20 mL进行细胞培养,分析胎儿染色体核型,并在知情同意情况下,抽取胎儿父母外周血进行染色体检查。总结这90例胎儿染色体平衡易位的细胞遗传学特点及妊娠结局。本研究受试者均签署知情同意书。
本研究90例胎儿染色体平衡易位中,相互易位为53例,罗伯逊易位为37例。①53例胎儿染色体相互易位中,嵌合体易位为8例,其中2例为假性嵌合体,经复查羊水和脐带血为核型正常;有13例为世界首次报道的染色体相互易位核型。对42例胎儿父母进行外周血染色体检查的结果显示,40.5%(17/42)胎儿染色体相互易位遗传自母亲,33.3%(14/42)遗传自父亲,26.2%(11/42)为新生突变。53例染色体相互易位胎儿的妊娠结局为:3例胎儿被引产,2例胎儿因失访而妊娠结局不详,其余48例胎儿均继续妊娠而活产。②37例胎儿染色体的罗伯逊易位中,非同源罗伯逊易位为31例(83.8%),其中2例选择引产终止妊娠,其余均继续妊娠;同源罗伯逊易位为6例(16.2%),全部选择引产终止妊娠。
对父母为染色体平衡易位携带者或有其他生育异常高危因素的孕妇,应在孕期进行胎儿染色体核型分析。在遗传咨询医师指导下,控制具有不良遗传因素的新生儿出生。

版权所有,未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别申明,本刊刊出的所有文章不代表中华医学会和本刊编辑委员会的观点。
本刊为电子杂志,以光盘形式出版。本册应读者需求按需印刷,随光盘免费赠阅。光盘如有质量问题,请向编辑部调换。
染色体平衡易位是指2条染色体之间末端片段相互交换,染色体在结构改变的同时遗传物质总数保持不变[1]。染色体平衡易位为染色体结构畸变中最常见,染色体平衡易位携带者在一般人群中所占比例约为0.19%[2]。由于染色体平衡易位携带者表型及智力均正常,在人群中随机婚配,容易发生自然流产,亦使后代具有患染色体病的高风险。对于染色体平衡易位携带者,目前尚无有效治疗方法,因此妊娠后需加强对胎儿的产前诊断,并追溯胎儿携带的染色体易位是来源于父母,还是染色体新发突变,以指导妊娠。目前,羊水细胞培养是产前诊断胎儿染色体平衡易位的主要手段之一,是减少出生缺陷的有效手段。研究染色体平衡易位的生育风险,可以减少异常妊娠给孕妇及其家庭与社会带来不必要的负担。染色体平衡易位包括相互易位和罗伯逊易位,并且以罗伯逊易位较为常见。本研究采取回顾性分析方法,探讨中孕期进行羊水产前诊断检出的90例胎儿染色体平衡易位核型结果及妊娠结局,旨在了解染色体平衡易位胎儿的妊娠结局,以指导妊娠。现将研究结果报道如下。
选择2012年1月至2015年12月,于广西壮族自治区妇幼保健院经羊水穿刺染色体核型分析,诊断为胎儿染色体平衡易位的89例中孕期孕妇为研究对象,其中1例为双胎妊娠。本研究纳入标准:年龄为20~42岁,孕龄为16~22孕周的初产妇或经产妇。排除标准:羊水检查胎儿染色体为部分单体或部分三体者。本研究所有受试者均签署知情同意书。
本研究产前羊水筛查主要指征为:有不良孕产史的孕妇;高龄孕妇并有明显致畸因素接触史,如X射线接触;夫妇一方为染色体平衡异位携带者,或曾生育过染色体病患儿的孕妇;通过外周血染色体检查为21-三体高危的孕妇等。
无菌条件下,经超声引导,由优生遗传门诊科医师对孕妇经腹进行羊膜腔穿刺术。抽取20 mL羊水后,立即送至本院遗传代谢中心实验室,以1 500 r/min离心8 min(离心半径为25 cm),去上清液。基于羊水细胞培养的严谨性,需要进行双人双线培养,因此沉淀物被分为2份,同时接种于美国Irvine Scientific公司(批号为99473170701)和广州白云山拜迪生物医药公司(批号为20160111)生产的2种羊水细胞培养基中,置于37 ℃、5% CO2培养箱中,培养7~10 d,在Olympus Ckx31倒置显微镜(日本Olympus公司)下观察细胞生长情况,待细胞贴壁,并生长至5~7个较大克隆时,换培养基1次。采用胰酶消化法收获培养的羊水细胞、常规滴片、显带、染色,并采用G显带核型分析技术,进行染色体核型分析[3]。利用德国蔡司染色体分析软件进行核型分析,常规计数20个核分裂象,分析其中5个核型。若发现异常核型,则将计数与分析增加为50个核分裂象。根据2013版《人类细胞遗传学国际命名体制》(An International System for Human Cytogentic Nomenclature, ISCN),对检出的染色体核型进行命名[4]。
本研究90例胎儿染色体平衡易位中,53例为胎儿染色体相互易位,其中8例(15.1%)为嵌合体易位,包括2例(编号40、47)为假性嵌合体,对这2例假性嵌合体分别复查羊水和脐带血进行核型分析的结果均为核型正常;有13例为世界首次报道染色体相互易位的异常核型。这53例染色体相互易位胎儿中,9例胎儿的父母不愿意进行外周血染色体检查,42例胎儿父母进行外周血染色体核型检查的结果显示,40.5%(17/42)遗传自母亲,33.3%(14/42)遗传自父亲,26.2%(11/42)为新生突变。这53例染色体相互易位胎儿的妊娠结局为:3例胎儿被引产,2例胎儿因失访而妊娠结局不详,其余48例胎儿均继续妊娠而活产。本研究53例胎儿染色体相互易位检出情况及妊娠结局,见表1。
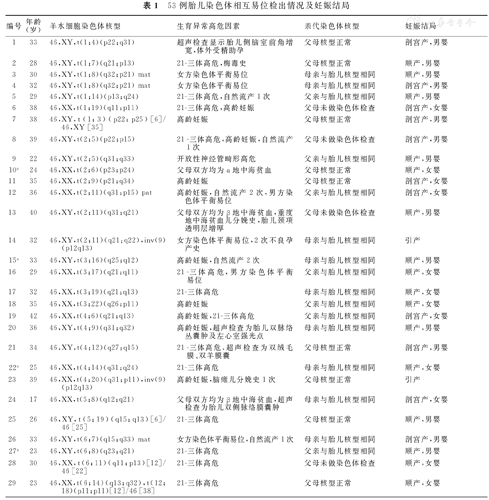
53例胎儿染色体相互易位检出情况及妊娠结局
53例胎儿染色体相互易位检出情况及妊娠结局
| 编号 | 年龄(岁) | 羊水细胞染色体核型 | 生育异常高危因素 | 亲代染色体核型 | 妊娠结局 |
|---|---|---|---|---|---|
| 1 | 33 | 46,XY,t(1;4)(p22;q31) | 超声检查显示胎儿侧脑室前角增宽,体外受精助孕 | 父母核型正常 | 剖宫产,男婴 |
| 2 | 28 | 46,XY,t(1;7)(q21;p13) | 21-三体高危,梅毒史 | 父母核型正常 | 顺产,男婴 |
| 3 | 30 | 46,XY,t(1;8)(q32;p21) mat | 女方染色体平衡易位 | 母亲与胎儿核型相同 | 顺产,男婴 |
| 4 | 32 | 46,XY,t(1;8)(q32;p21) mat | 女方染色体平衡易位 | 母亲与胎儿核型相同 | 剖宫产,男婴 |
| 5 | 29 | 46,XY,t(1;14)(p13;q24) | 21-三体高危,自然流产1次 | 父亲与胎儿核型相同 | 顺产,男婴 |
| 6 | 38 | 46,XX,t(1;19)(q11;p11) | 21-三体高危,高龄妊娠 | 父母未做染色体检查 | 剖宫产,女婴 |
| 7 | 38 | 46,XY,t(1;3)(p22;p25)[6]/46,XY [35] | 高龄妊娠 | 父母核型正常 | 剖宫产,男婴 |
| 8 | 39 | 46,XY,t(2;5)(p22;p15) | 21-三体高危,高龄妊娠,自然流产1次 | 父母未做染色体检查 | 剖宫产,男婴 |
| 9 | 22 | 46,XY,t(2;5)(q31;q33) | 开放性神经管畸形高危 | 父亲与胎儿核型相同 | 顺产,男婴 |
| 10a | 24 | 46,XX,t(2;6)(p23;p24) | 父母双方均为α地中海贫血 | 父母核型正常 | 顺产,女婴 |
| 11 | 35 | 46,XX,t(2;9)(p21;q34) | 高龄妊娠 | 父母核型正常 | 剖宫产,女婴 |
| 12 | 36 | 46,XX,t(2;11)(q31;p15) pat | 高龄妊娠,自然流产2次,男方染色体平衡易位 | 父亲与胎儿核型相同 | 剖宫产,女婴 |
| 13 | 40 | 46,XY,t(2;11)(q31;q21) | 父母双方均为β地中海贫血,重度地中海贫血儿分娩史,胎儿颈项透明层增厚 | 父母未做染色体检查 | 顺产,男婴 |
| 14 | 32 | 46,XY,t(2;11)(q21:q22),inv(9)(p12q13) | 女方染色体平衡易位,2次不良孕产史 | 母亲与胎儿核型相同 | 引产 |
| 15a | 33 | 46,XY,t(3;16)(q25;q12) | 高龄妊娠,自然流产2次 | 母亲与胎儿核型相同 | 顺产,男婴 |
| 16 | 29 | 46,XX,t(3;17)(q21;q11) | 21-三体高危,男方染色体平衡易位 | 父亲与胎儿核型相同 | 顺产,女婴 |
| 17 | 32 | 46,XX,t(3;19)(q21;q13) | 21-三体高危 | 母亲与胎儿核型相同 | 顺产,女婴 |
| 18 | 35 | 46,XX,t(3;22)(q26;p11) | 高龄妊娠 | 父亲与胎儿核型相同 | 顺产,女婴 |
| 19 | 42 | 46,XX,t(4;6)(q21;q13) | 高龄妊娠,21-三体高危 | 父亲与胎儿核型相同 | 剖宫产,女婴 |
| 20 | 36 | 46,XY,t(4;9)(q31;q32) | 高龄妊娠,超声检查为胎儿双脉络丛囊肿及左心室强光点 | 母亲与胎儿核型相同 | 顺产,男婴 |
| 21 | 34 | 46,XY,t(4;12)(q27;q15) | 21-三体高危,超声检查为双绒毛膜、双羊膜囊 | 父母核型正常 | 剖宫产,男婴 |
| 22a | 25 | 46,XX,t(4;14)(q31;q24) | 21-三体高危 | 母亲与胎儿核型相同 | 顺产,女婴 |
| 23 | 39 | 46,XX,t(4;20)(q31;p11),inv(9)(p12q13) | 高龄妊娠,脑瘫儿分娩史1次 | 父母核型正常 | 引产 |
| 24 | 17 | 46,XX,t(5;8)(q12;q21) | 父母双方均为β地中海贫血,超声检查为胎儿双侧脉络膜囊肿 | 母亲与胎儿核型相同 | 剖宫产,女婴 |
| 25 | 26 | 46,XY,t(5;19)(q15;q13)[6]/46[25] | 21-三体高危 | 父母核型正常 | 顺产,男婴 |
| 26 | 33 | 46,XY,t(6;7)(q15;q33) mat | 女方染色体平衡易位,自然流产1次 | 母亲与胎儿核型相同 | 剖宫产,男婴 |
| 27a | 23 | 46,XY,t(6;8)(q23;q21) | 21-三体高危 | 父亲与胎儿核型相同 | 顺产,男婴 |
| 28 | 30 | 46,XX,t(6;11)(q11;p13)[12]/46[22] | 21-三体高危 | 父母未做染色体检查 | 顺产,女婴 |
| 29 | 23 | 46,XX,t(6;14)(q13;q32),t(12;18)(p11;p11)[12]/46[38] | 21-三体高危 | 父母核型正常 | 顺产,女婴 |
| 编号 | 年龄(岁) | 羊水细胞染色体核型 | 生育异常高危因素 | 亲代染色体核型 | 妊娠结局 |
|---|---|---|---|---|---|
| 30 | 31 | 46,XY,t(6;15)(q11;q15)[13]/46,[41] | 21-三体高危 | 父母未做染色体检查 | 剖宫产,男婴 |
| 31 | 35 | 46,XX,t(6;15)(p21;q15)pat,16qh+ | 21-三体高危,胚胎植入前遗传学诊断助产,高龄妊娠,男方染色体平衡易位 | 父亲与胎儿核型相同 | 失访(患者电话号码不准确) |
| 32 | 29 | 46,XX,t(6;16)(q21;p13) | 21-、18-三体高危 | 母亲与胎儿核型相同 | 顺产,女婴 |
| 33 | 33 | 46,XX,t(6;18)(q21;q12) | 18-三体高危 | 父亲与胎儿核型相同 | 顺产,女婴 |
| 34a | 31 | 46,XX,t(7;9)(p11;q11) | 21-三体高危,自然流产1次 | 母亲与胎儿核型相同 | 剖宫产,女婴 |
| 35a | 36 | 46,XY,t(7;12)(q11;q22) | 高龄妊娠,21-三体高危 | 母亲与胎儿核型相同 | 剖宫产,男婴 |
| 36a | 39 | 46,XX,t(7;12)(q11;q13) | 21-、18-、13-三体高危,高龄妊娠,胎盘低置状态 | 父亲与胎儿核型相同 | 顺产,女婴 |
| 37a | 20 | 46,XX,t(8;11)(p23;p11) | 21-三体高危 | 母亲与胎儿核型相同 | 失访(患者电话号码停机) |
| 38 | 40 | 46,XX,t(9;11)(q22;q23) | 高龄妊娠 | 父母未做染色体检查 | 顺产,女婴 |
| 39 | 32 | 46,XY,t(9;18)(p13;p11) mat | 女方染色体平衡易位 | 母亲与胎儿核型相同 | 顺产,男婴 |
| 40 | 34 | 46,XY,t(10;15)(q26;q22)[3]/46,XY[37] | 试管婴儿,双胎妊娠,双胎脑室增宽 | 复查羊水,胎儿核型正常 | 剖宫产,男婴 |
| 41 | 34 | 46,XX,t(10;15)(q23;q15) | 父母双方均为α地中海贫血 | 父母未做染色体检查 | 顺产,女婴 |
| 42 | 32 | 46,XY,t(11;18)(q23;q21) | 21-三体临界风险 | 母亲与胎儿核型相同 | 顺产,男婴 |
| 43a | 38 | 46,XX,1qh+,t(11;18)(q13;q21) | 胎儿双肾盂扩张,高龄妊娠 | 父母未做染色体检查 | 顺产,女婴 |
| 44 | 39 | 46,XY,t(11;22)(q25;q13)pat | 高龄妊娠 | 父亲与胎儿核型相同 | 顺产,男婴 |
| 45b | 31 | 46,XX,t(12;22)(q21;p12) | 男方染色体平衡易位 | 父亲与胎儿核型相同 | 剖宫产,女婴 |
| 46b | 31 | 46,XX,t(12;22)(q21;p12) | 男方染色体平衡易位 | 父亲与胎儿核型相同 | 剖宫产,女婴 |
| 47 | 29 | 46,XX,t(13;17)(q14;q11)[12]/46[39] | 不良孕产史 | 复查脐带血,胎儿核型正常 | 剖宫产,女婴 |
| 48a | 31 | 46,XX,t(15;17)(q15;q23) | 21-三体高危 | 母亲与胎儿核型相同 | 顺产,女婴 |
| 49a | 35 | 46,XX,t(15;17)(q26;q21) | 21-三体高危,高龄妊娠,乙肝表面抗原、e抗原和核心抗体阳性 | 父母核型正常 | 引产 |
| 50a | 31 | 46,XY,t(15;18)(q21;p11) | 18-三体高危 | 父亲与胎儿核型相同 | 剖宫产,男婴 |
| 51 | 38 | 46,XX,t(17;18)(p13;p11) | 高龄妊娠 | 父母未做染色体检查 | 剖宫产,女婴 |
| 52a | 28 | 46,XY,t(X;11)(P22.3;P11) | 21-三体高危 | 母亲与胎儿核型相同 | 剖宫产,男婴 |
| 53 | 25 | 46,t(X;2;7)(q28;q32;p15),del(X)(p22),inv(9)(p12q13)[5]/46,XX,inv(9)(p12q13)[56] | 父母双方均为α地中海贫血,胎盘稍增厚 | 父母核型正常 | 顺产,女婴 |
注:a全世界首次报道核型;b双胎之一
本研究90例胎儿染色体平衡易位中,37例为罗伯逊易位。其中,非同源罗伯逊易位为31例(83.8%),2例选择引产,其余均继续妊娠;而同源罗伯逊易位为6例(16.2%),全部选择引产。本研究37例胎儿染色体的罗伯逊易位检出情况及妊娠结局,见表2。
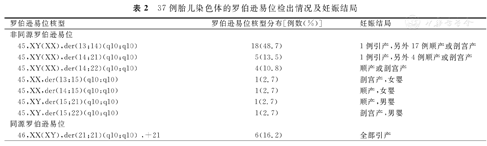
37例胎儿染色体的罗伯逊易位检出情况及妊娠结局
37例胎儿染色体的罗伯逊易位检出情况及妊娠结局
| 罗伯逊易位核型 | 罗伯逊易位核型分布[例数(%)] | 妊娠结局 | |
|---|---|---|---|
| 非同源罗伯逊易位 | |||
| 45,XY(XX),der(13;14)(q10;q10) | 18(48.7) | 1例引产,另外17例顺产或剖宫产 | |
| 45,XY(XX),der(14;21)(q10;q10) | 5(13.5) | 1例引产,另外4例顺产或剖宫产 | |
| 45,XY(XX),der(14;22)(q10;q10) | 4(10.8) | 顺产或剖宫产 | |
| 45,XX,der(13;15)(q10;q10) | 1(2.7) | 剖宫产,女婴 | |
| 45,XX,der(14;15)(q10;q10) | 1(2.7) | 顺产,女婴 | |
| 45,XY,der(15;21)(q10;q10) | 1(2.7) | 顺产,男婴 | |
| 45,XY,der(15;22)(q10;q10) | 1(2.7) | 剖宫产,男婴 | |
| 同源罗伯逊易位 | |||
| 46,XX(XY),der(21;21)(q10;q10) ,+21 | 6(16.2) | 全部引产 | |
染色体结构异常主要包括易位、倒位、缺失等。其中,平衡易位在染色体异常中最常见,是导致不良孕产史的主要原因之一[5]。染色体相互易位涉及2条或2条以上染色体,2条染色体末端片段发生断裂并相互交换后,着丝粒融合,形成2条新的衍生染色体。染色体相互易位可引起染色体片段的位置改变,但其基因总数不变,故称为平衡易位。染色体平衡易位携带者由于无遗传物质丢失而表型正常,但在配子形成过程中,容易形成异常配子,是导致自然流产、死胎和胎儿畸形的主要原因[6]。
染色体平衡易位核型主要来源于2个途径:由父(母)传递而来,或者配子形成过程中或受精卵分裂时产生。本研究对中孕期羊水检查为胎儿染色体平衡易位进行回访调查,建议胎儿的父母进行外周血染色体检查,并根据父母与胎儿的染色体检查结果,给予是否可以继续妊娠的指导。本研究42例染色体相互易位的胎儿父母愿意进行染色体检查,结果显示31例胎儿染色体相互易位由父母遗传而来,其染色体核型与父亲或母亲核型一样,另外11例胎儿染色体相互易位为配子形成过程中,产生新的染色体易位。本研究编号为40和47的胎儿初次羊水检查时,结果为染色体相互易位嵌合体核型,建议进行遗传门诊咨询及复查,后经复查羊水或脐带血检查,结果为染色体核型正常,故该2例胎儿为假性嵌合体。编号为53的孕妇妊娠胎儿为复杂易位嵌合体,其接受羊水基因芯片检查的结果发现为致病基因,建议其引产,但孕妇及家属坚持保留胎儿,并顺产一活产女婴,至本研究随访结束时,尚未发现婴儿表型异常。对于本研究11例父母染色体正常的胎儿染色体相互易位突变者,应考虑除遗传因素外的其他因素所致,如电子辐射、环境污染、化学毒物及病原体感染等。对于这些胎儿,需进行超声监测,以指导是否继续妊娠。总之,对已婚妇女,应指导其选择合适生育年龄,避免接触不良环境,加强孕前及孕期保健,按时进行产前检查。
文献报道,染色体平衡易位携带者虽然无遗传物质丢失、表型正常,但其染色体异常对后代危害极大[7,8]。染色体相互易位时,生殖细胞在减数分裂过程中,可产生18种不同类型配子,其中1种为正常配子,1种为表型正常的平衡易位配子,其余16种均为不平衡配子,不平衡配子均发育为部分三体或部分单体,从而发生自然流产、死胎、胎儿畸形或新生儿死亡等不良妊娠结局[7,8]。因此,对染色体平衡易位携带者,其胎儿染色体核型若正常,可继续妊娠;若与本研究31例胎儿一样,胎儿的染色体核型与亲代一致,出生后也为表型正常的染色体平衡易位携带者,考虑到将来同样面临生育异常的问题,则需征求胎儿父母意见,决定胎儿去留;若胎儿的染色体核型异常,则建议其终止妊娠。
罗伯逊易位是染色体平衡易位的特殊形式之一[9]。同源罗伯逊易位携带者,由于不能产生正常配子,只能产生单体或三体胚胎,因此不能生育正常后代,应劝其绝育或采用辅助生育技术而获取正常后代。本研究染色体核型为46,XX(XY),der(21;21)(q10;q10),+21的6例同源罗伯逊易位胎儿,均全部引产。非同源罗伯逊易位携带者,可以产生正常配子、可携带易位的平衡配子和其余几种不平衡配子。罗伯逊易位在人群中的平均发生率约为1/1 000[10]。非同源罗伯逊易位携带者能产生6种类型的配子,因此生育正常胎儿几率为1/6,生育表型正常的易位携带者为1/6,生育三体或单体患儿为4/6,这可导致流产、死胎、生育畸形儿等多种可能[11]。因此,需要进行胎儿染色体核型分析,以指导妊娠。
对于夫妇一方为染色体平衡易位携带者,可在早孕期抽取绒毛组织,或在中孕期抽取羊水细胞,检查胎儿染色体核型是否正常,以决定是否继续妊娠[12]。染色体平衡易位携带者在生育后代时,分娩表型及智力均正常的新生儿的几率较低,因此染色体平衡易位携带者在早、中孕期需进行产前诊断,以获得临床遗传咨询医师有价值的生育指导[13]。本研究部分胎儿的父母拒绝进行外周血染色体检查,因此不能追溯异常染色体来源。为避免染色体异常新生儿出生,染色体平衡易位携带者应在孕期及时进行产前诊断,或采取辅助生殖技术,选择染色体正常的胚胎进行宫内移植,以降低染色体平衡易位携带者的生育风险[14]。
由于染色体核型分析对诊断微小缺失存在局限性,在决定染色体平衡易位胎儿是否继续妊娠时,还应考虑染色体平衡易位携带者是否出现小片段基因缺失。随着现代医学、遗传学、分子生物学迅速发展,极大提高染色体病的基础研究和临床诊治水平,可采用微阵列比较基因组杂交技术,对染色体微小缺失或重排进行检测[15]。
感谢中南大学湘雅医学院中国医学遗传学国家重点实验室,对本研究世界首次报道染色体核型进行鉴定、确认






























