
探讨妊娠期糖尿病(GDM)患者白细胞NOS2及SFTPD基因与糖代谢异常的相关性。
选择2014年1月至2016年12月,延安市人民医院妇产科收治的125例孕妇为研究对象。根据孕妇是否罹患GDM,将其分别纳入GDM组(n=87)和非GDM组(n=38)。采集2组受试者空腹肘静脉血,并分离白细胞,采用实时荧光定量PCR测定受试者白细胞NOS2和SFTPD mRNA相对表达水平。采集2组受试者孕前、分娩前体重,孕前人体质量指数(BMI),血清三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、C反应蛋白(CRP),糖化血红蛋白(HbA1c),空腹血糖,口服葡萄糖耐量试验(OGTT) 1、2 h血糖,血浆胰岛素,稳态模型评估的胰岛素抵抗指数(HOMA-IR),以及稳态模型评估的胰岛β细胞分泌功能指数(HOMA-β)。采用成组t检验,对2组孕妇上述指标进行比较。对于2组受试者白细胞NOS2和SFTPD mRNA相对表达水平与相关临床指标的相关性分析,采用Pearson相关性分析。采用Ingenuity路径分析(IPA)数据库构建与白细胞NOS2、SFTPD基因相关的分子网络,对其相关生物学功能进行分析。本研究符合2013年修订的《世界医学协会赫尔辛基宣言》,征得2组受试者知情同意,并签署临床研究知情同意书。2组受试者年龄、孕前BMI、孕期体重增加值等一般临床资料比较,差异均无统计学意义(P>0.05)。
①GDM组受试者空腹及OGTT 1、2 h血糖值与HbA1c值分别为(89.9±18.6) mg/dL、(187.3±30.0) mg/dL、(163.3±22.3) mg/dL、(5.4±0.4)%,均分别显著高于非GDM组的(77.5±7.8) mg/dL、(152.3±36.1) mg/dL、(113.9±21.3) mg/dL、(5.2±0.4)%,并且差异均有统计学意义(t=3.95、P<0.001, t=5.63、P<0.001、t=11.55、P<0.001,t=2.57、P=0.021)。②GDM组受试者白细胞NOS2和SFTPD mRNA相对表达水平分别为(0.08±0.05)、(0.16±0.07),均显著高于非GDM组的(0.04±0.03)、(0.06±0.02),并且差异均有统计学意义(t=8.92、3.26,P<0.001)。③2组受试者白细胞NOS2和SFTPD mRNA相对表达水平与妊娠期血清CRP均呈弱正相关关系(r=0.23、P=0.022, r=0.34、P<0.001);SFTPD mRNA相对表达水平与空腹血糖、HOMA-IR均呈弱正相关关系(r=0.19、P=0.041, r=0.21、P=0.040)。白细胞NOS2与SFTPD mRNA相对表达水平呈强正相关关系(r=0.77、P<0.001)。④在IPA数据库中检索到12种相关因素与白细胞NOS2基因过表达相关,而未检索到与白细胞SFTPD基因过表达相关因素。12种白细胞NOS2基因相关因素与免疫、炎症反应及血管生成相关,可分为4类:细胞/生长因子、趋化因子、酶、转录因子。
GDM孕妇葡萄糖代谢受损,可能是其白细胞NOS2和SFTPD基因过表达的主要预测因子。NOS2和SFTPD基因表达异常与孕期葡萄糖代谢功能障碍和(或)炎症有关。本研究确定了12种与NOS2基因相关的调控免疫、炎症反应及血管生成的细胞因子、酶和转录因子。

版权所有,未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别申明,本刊刊出的所有文章不代表中华医学会和本刊编辑委员会的观点。
本刊为电子杂志,以光盘形式出版。本册应读者需求按需印刷,随光盘免费赠阅。光盘如有质量问题,请向编辑部调换。
妊娠期糖尿病(gestational diabetes mellitus,GDM)是糖尿病的一种特殊类型,GDM是2型糖尿病(type 2 diabetes mellitus,T2DM)的一种后备状态,是指孕前糖代谢正常或存在潜在糖耐量减退、孕期才出现或确诊的糖尿病。糖尿病孕妇中,超过80%为GDM。GDM发生率世界各国报道不一,为3%~17%[1]。GDM导致的围生期不良结局包括子痫前期、早产、剖宫产术分娩、巨大儿、新生儿呼吸窘迫综合征等[2]。GDM患者糖代谢异常多数于产后可恢复正常,但是将来发展为T2DM的几率增高。母亲罹患T2DM和心血管疾病,可能导致新生儿于儿童期或青春期发生肥胖、代谢综合征等增加[3]。GDM与炎症因子、免疫稳态和代谢失衡密切相关[4]。免疫相关基因NOS2编码的诱导型一氧化氮合成酶(inducible nitric oxide synthase,iNOS),胶原性钙依赖性凝集素,以及聚集蛋白表面活性蛋白D(surfactant protein D,SP-D)不仅与炎症有关,而且与葡萄糖和脂质代谢有关,被临床高度关注。NOS2蛋白可调节血管舒张、血小板聚集、免疫功能、血管生成等多种生理功能[5]。然而,炎症反应等产生的过量一氧化氮(nitric oxide,NO)可与超氧阴离子(O2—·)发生反应,生成过氧亚硝酸盐阴离子(ONOO—),而该阴离子可通过介导机体的氧化和硝化作用,影响机体细胞信号传导。缺乏iNOS的胰岛素抵抗小鼠发生肥胖风险极低,并且葡萄糖耐量异常得到改善;NOS2转基因小鼠可发生1型糖尿病(type 1 diabetes mellitus,T1DM),胰岛β细胞产生的过量NO可引起细胞DNA损伤[6]。由SFTPD基因编码的表面活性蛋白D(surfactant protein,SP-D),是介导机体清除病原体和调节炎症反应的重要先天性免疫调节剂。肥胖和T2DM患者体内血清SP-D浓度降低,空腹血糖值和血清葡萄糖值呈负相关关系[7]。SFTPD基因多态性与胰岛素抵抗、T2DM相关[8]。因此,本研究对晚孕期GDM和正常葡萄糖耐量(normal glucose tolerance,NGT)的非GDM孕妇的白细胞NOS2和SFTPD基因表达及其与GDM患者糖代谢异常的相关性进行分析,旨在为临床诊治GDM患者提供理论基础。现将研究结果报道如下。
选择2014年1月至2016年12月,延安市人民医院妇产科收治的125例孕妇为研究对象。根据孕妇是否罹患GDM,将其分别纳入GDM组(n=87)和非GDM组(n=38)。所有孕妇于孕龄为24~28孕周时进行75 g口服葡萄糖耐量试验(oral glucose tolerance test,OGTT)。本研究纳入标准:年龄为18~40岁;对GDM诊断符合2010年国际糖尿病与妊娠研究组(International Association of Diabetes and Pregnancy Study Groups)推荐的GDM诊断标准[8];无糖尿病史及糖尿病家族史。排除标准:具有糖尿病家族史、GDM史、孕前糖尿病史、全身性感染的孕妇,以及近期服用影响碳水化合物代谢药物的孕妇。本研究符合2013年修订的《世界医学协会赫尔辛基宣言》的要求,并与所有受试者均签署临床研究知情同意书。
采集2组孕妇孕前、分娩前的体重,以及孕前人体质量指数(body mass index,BMI)等一般临床资料。分娩前,采集2组孕妇空腹肘静脉血,检测血脂代谢指标。其中,血清三酰甘油(triglycerides,TG),总胆固醇(total cholesterol,TC),高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)和低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)水平,采用酶联免疫吸附法进行测定。糖化血红蛋白(glycosylated hemoglobin A1c,HbA1c)水平,采用胶乳增强免疫比浊法进行测定。血清C反应蛋白(C-reactive protein,CRP)水平,通过COBAS INTEGRA分析仪(美国Roche公司),采用免疫比浊法进行测定。血浆胰岛素水平,采用酶联免疫吸附法进行测定。计算所有受试者稳态模型评估的胰岛素抵抗指数(homeostasis model assessment of insulin resistance,HOMA-IR),以及稳态模型评估的胰岛β细胞分泌功能指数(homeostasis model assessment of β cell function index,HOMA-β)。
采集受试者空腹肘静脉血10 mL,采用肝素抗凝后备用。采用红细胞裂解缓冲液(批号:R1010,北京索莱宝生物科技有限公司)裂解肝素抗凝血液标本中的红细胞后,以500×g离心10 min,取下层白细胞沉淀,使用磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤2次。使用酸-苯酚试剂(TRI Reagent® Solution,批号:20160711,美国Ambion公司),从白细胞沉淀中提取总RNA,置于-80 ℃条件下保存、备用。
使用Oligo (dT)18引物溶液(批号:GMS12080,美国Genmed Scientifics公司)和RevertAidTM H Minus MMuLV逆转录酶试剂盒(批号:K1622,美国Thermo Fisher Scientific公司),对上述提取的总RNA逆转录成cDNA。再使用MaximaTM SYBR Green/ROX qPCR Master Mix(2X)试剂盒(批号:K0221,美国Thermo Fisher Scientific公司)对cDNA进行定量PCR检测,分析NOS2和SFTPD mRNA表达水平。根据GenBank数据库,设计引物序列,GAPDH基因为内参基因,见表1。采用实时荧光定量PCR系统(美国Applied Biosystems公司),对引物序列进行扩增。PCR扩增结束时,通过解链曲线分析,对PCR扩增产物的特异性进行检测。同时,通过对PCR扩增产物进行琼脂糖凝胶电泳,进一步验证PCR扩增产物的特异性。所有样品均设置2个复孔,取2次检测结果的平均值作为最终检测结果。NOS2和SFTPD mRNA相对表达水平,由公式2—ΔΔCt[9]计算得出。

实时荧光定量PCR扩增引物序列
实时荧光定量PCR扩增引物序列
| 基因名称 | 引物序列(5′-3′) | 扩增产物长度(bp) |
|---|---|---|
| NOS2 | 正向引物:CCCAAATACGAGTGGTTTCG | 133 |
| 反向引物:TCTCTGTGCCCATGTACCA | ||
| SFTPD | 正向引物:TGCTTTCCTGAGCATGACTG | 164 |
| 反向引物:AAGCCCTGTCATTCCACTTG | ||
| GAPDH | 正向引物:GGTGGTCTCCTCTGACTTCAACA | 127 |
| 反向引物:GTTGCTGTAGCCAAATTCGTTGT |
根据已有文献报道的NOS2和SFTPD基因调控网络和途径,将检索到的NOS2和SFTPD相关差异表达基因提交至Ingenuity路径分析(Ingenuity Pathway Analysis, IPA)数据库(http://www.ingcentity.com),利用其调控网络分析(network analysis)功能,分别构建与NOS2、SFTPD基因相关的分子网络,并对NOS2、SFTPD过表达涉及的相关生物学功能进行分析。在分子网络中,相关因素采用节点表示,相关因素之间的生物学关系,则采用节点之间的连线表示。
采使用SPSS 17.0统计学软件包对本研究所有数据进行统计学分析。采用Ssize软件,确定满足本研究统计检验的最小样本量。采用Shapiro-Wilk检验,对计量资料是否符合正态分布进行检验。对于受试者年龄、孕前BMI、孕期体重增加值,血清TG、TC、HDL-C、LDL-C,以及空腹、OGTT 1 h及2 h血糖等呈正态分布的计量资料,采用 ±s表示,2组比较采用成组t检验。对于2组受试者白细胞NOS2和SFTPD mRNA相对表达水平与相关临床指标的相关性分析,采用Pearson相关性分析。所有统计学检验采用双侧检验,以P<0.05表示差异有统计学意义。
±s表示,2组比较采用成组t检验。对于2组受试者白细胞NOS2和SFTPD mRNA相对表达水平与相关临床指标的相关性分析,采用Pearson相关性分析。所有统计学检验采用双侧检验,以P<0.05表示差异有统计学意义。
2组孕妇年龄、孕前BMI、孕期体重增加值等一般临床资料比较,差异均无统计学意义(P>0.05)。GDM组空腹与OGTT 1、2 h血糖及HbA1c,均显著高于非GDM组,并且差异均有统计学意义(P<0.05),2组孕妇脂质代谢指标(血清TG、TC、HDL-C、LDL-C),炎症指标(血清CRP),以及胰岛素抵抗和分泌指标(血浆胰岛素、HOMA-IR与HOMA-β)分别比较,差异均无统计学意义(P>0.05)。2组孕妇一般临床资料及实验室检测指标比较,见表2。
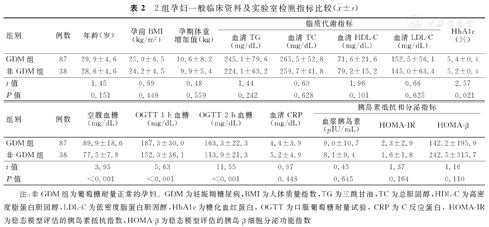
2组孕妇一般临床资料及实验室检测指标比较( ±s)
±s)
2组孕妇一般临床资料及实验室检测指标比较( ±s)
±s)
| 组别 | 例数 | 年龄(岁) | 孕前BMI(kg/m2) | 孕期体重增加值(kg) | 脂质代谢指标 | ||||
|---|---|---|---|---|---|---|---|---|---|
| 血清TG(mg/dL) | 血清TC(mg/dL) | 血清HDL-C(mg/dL) | 血清LDL-C(mg/dL) | HbA1c(%) | |||||
| GDM组 | 87 | 29.9±4.6 | 25.0±6.5 | 10.6±8.2 | 245.1±79.6 | 265.5±52.8 | 71.6±21.6 | 152.5±56.1 | 5.4±0.4 |
| 非GDM组 | 38 | 28.6±4.6 | 24.2±4.5 | 9.9±5.4 | 224.1±63.2 | 259.7±41.8 | 79.2±15.2 | 145.0±63.4 | 5.2±0.4 |
| t值 | 1.45 | 0.69 | 0.48 | 1.44 | 0.60 | 1.96 | 0.66 | 2.57 | |
| P值 | 0.151 | 0.449 | 0.559 | 0.242 | 0.628 | 0.101 | 0.625 | 0.021 | |
| 组别 | 例数 | 空腹血糖(mg/dL) | OGTT 1 h血糖(mg/dL) | OGTT 2 h血糖(mg/dL) | 血清CRP(mg/dL) | 胰岛素抵抗和分泌指标 | ||
|---|---|---|---|---|---|---|---|---|
| 血浆胰岛素(μIU/mL) | HOMA-IR | HOMA-β | ||||||
| GDM组 | 87 | 89.9±18.6 | 187.3±30.0 | 163.3±22.3 | 4.4±3.9 | 9.0±10.7 | 2.3±2.9 | 142.2±195.9 |
| 非GDM组 | 38 | 77.5±7.8 | 152.3±36.1 | 113.9±21.3 | 5.2±4.9 | 8.1±9.4 | 1.6±1.8 | 242.5±315.7 |
| t值 | 3.95 | 5.63 | 11.55 | 0.97 | 0.45 | 1.37 | 1.16 | |
| P值 | <0.001 | <0.001 | <0.001 | 0.448 | 0.645 | 0.164 | 0.110 | |
注:非GDM组为葡萄糖耐量正常的孕妇。GDM为妊娠期糖尿病,BMI为人体质量指数,TG为三酰甘油,TC为总胆固醇,HDL-C为高密度脂蛋白胆固醇,LDL-C为低密度脂蛋白胆固醇,HbA1c为糖化血红蛋白,OGTT为口服葡萄糖耐量试验,CRP为C反应蛋白,HOMA-IR为稳态模型评估的胰岛素抵抗指数,HOMA-β为稳态模型评估的胰岛β细胞分泌功能指数
实时荧光定量PCR分析结果显示,与非GDM组相比,GDM组白细胞NOS2和SFTPD mRNA相对表达水平均明显升高,并且差异均有统计学意义(P<0.001)。2组孕妇白细胞NOS2和SFTPD mRNA相对表达水平比较,见表3、图1。
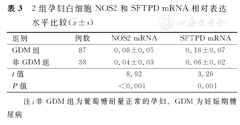
2组孕妇白细胞NOS2和SFTPD mRNA相对表达水平比较( ±s)
±s)
2组孕妇白细胞NOS2和SFTPD mRNA相对表达水平比较( ±s)
±s)
| 组别 | 例数 | NOS2 mRNA | SFTPD mRNA |
|---|---|---|---|
| GDM组 | 87 | 0.08±0.05 | 0.16±0.07 |
| 非GDM组 | 38 | 0.04±0.03 | 0.06±0.02 |
| t值 | 8.92 | 3.26 | |
| P值 | <0.001 | 0.001 |
注:非GDM组为葡萄糖耐量正常的孕妇。GDM为妊娠期糖尿病
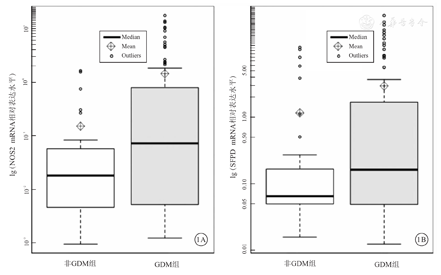

注:非GDM组为葡萄糖耐量正常的孕妇。GDM为妊娠期糖尿病,Median为中位数,Mean为均数,Outliers为离群值
对2组孕妇白细胞NOS2和SFTPD mRNA相对表达水平与相关临床指标进行相关性分析的结果显示,白细胞NOS2和SFTPD mRNA相对表达水平与妊娠期血清CRP均呈弱正相关关系(r=0.23、P=0.022, r=0.34、P<0.001);白细胞SFTPD mRNA相对表达水平与空腹血糖、HOMA-IR均呈弱正相关关系(r=0.19、P=0.041, r=0.21、P= 0.040),见表3。白细胞NOS2与SFTPD mRNA相对表达水平呈强正相关关系(r=0.77、P <0.001)。2组孕妇白细胞NOS2和SFTPD mRNA相对表达水平与相关临床指标的相关性分析,见 表4。
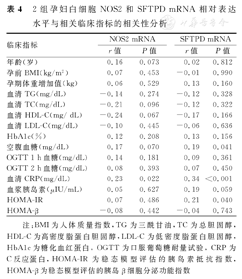
2组孕妇白细胞NOS2和SFTPD mRNA相对表达水平与相关临床指标的相关性分析
2组孕妇白细胞NOS2和SFTPD mRNA相对表达水平与相关临床指标的相关性分析
| 临床指标 | NOS2 mRNA | SFTPD mRNA | ||
|---|---|---|---|---|
| r值 | P值 | r值 | P值 | |
| 年龄(岁) | 0.16 | 0.073 | 0.02 | 0.812 |
| 孕前BMI(kg/m2) | 0.07 | 0.453 | -0.01 | 0.990 |
| 孕期体重增加值(kg) | 0.06 | 0.529 | 0.13 | 0.160 |
| 血清TG(mg/dL) | -0.14 | 0.274 | -0.12 | 0.328 |
| 血清TC(mg/dL) | -0.21 | 0.096 | -0.12 | 0.322 |
| 血清HDL-C(mg/ dL) | -0.24 | 0.067 | -0.17 | 0.166 |
| 血清LDL-C(mg/dL) | -0.10 | 0.445 | -0.06 | 0.636 |
| HbA1c(%) | 0.12 | 0.208 | 0.13 | 0.156 |
| 空腹血糖(mg/dL) | 0.17 | 0.070 | 0.19 | 0.041 |
| OGTT 1 h血糖(mg/dL) | 0.14 | 0.181 | 0.09 | 0.361 |
| OGTT 2 h血糖(mg/dL) | 0.08 | 0.393 | 0.07 | 0.450 |
| 血清CRP(mg/dL) | 0.23 | 0.022 | 0.34 | <0.001 |
| 血浆胰岛素(μIU/mL) | 0.05 | 0.627 | 0.19 | 0.059 |
| HOMA-IR | 0.07 | 0.486 | 0.21 | 0.040 |
| HOMA-β | -0.08 | 0.442 | -0.04 | 0.743 |
注:BMI为人体质量指数,TG为三酰甘油,TC为总胆固醇,HDL-C为高密度脂蛋白胆固醇,LDL-C为低密度脂蛋白胆固醇,HbA1c为糖化血红蛋白,OGTT为口服葡萄糖耐量试验,CRP为C反应蛋白,HOMA-IR为稳态模型评估的胰岛素抵抗指数,HOMA-β为稳态模型评估的胰岛β细胞分泌功能指数
采用IPA数据库分析已有文献报道的NOS2和SFTPD基因调控网络和途径,并建立二者的分子网络图的结果显示,在IPA数据库检索到12种白细胞NOS2基因相关因素,而未检索到白细胞SFTPD基因相关因素,见图2。12种白细胞NOS2基因相关因素和免疫、炎症反应及血管生成等相关,可分为以下4类。①细胞/生长因子:由白细胞介素(interleukin,IL)相关基因,如IL-1β、-6、-10基因分别编码的IL-1β、-6与-10;TNFA基因编码的肿瘤坏死因子(tumor necrosis factor,TNF);IFNG基因编码的γ-干扰素(interferon gama,IFNG);VEGFA基因编码的血管内皮生长因子(vascular endothelial growth factor,VEGF)A,以及TGFB1基因编码的转化生长因子(transforming growth factor,TGF)-β1。②趋化因子:Ccl2基因编码的单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)/CCL2。③酶:PTGS2基因编码的环氧合酶(cyclooxygenase,COX)-2。④转录因子:HIF1A基因编码的缺氧诱导因子(hypoxia inducible factor,HIF)-1a;STAT3基因编码的信号传导子及转录激活子(signal transducer and activator of transcription,STAT)3,以及PPARG基因编码的过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor gama,PPARG)。
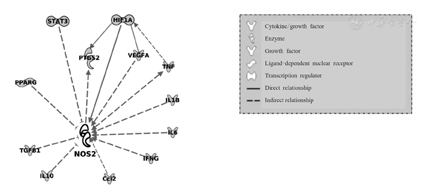

注:VEGFA为血管内皮生长因子A,TNF为肿瘤坏死因子,IL1B为白细胞介素1B,IL6为白细胞介素6,IFNG为γ-干扰素,Ccl2为趋化因子,IL10为白细胞介素10,TGFB1为转化生长因子β1,PPARG为过氧化物酶体增殖物激活受体γ,STAT3为信号传导子及转录激活子3,PTGS2为前列腺素G/H合成酶2,HIF1A为缺氧诱导因子1A。Cytokine/growth factor为细胞/生长因子,Enzyme为酶,Growth factor为生长因子,Ligand-dependent nuclear receptor为配体依赖性核受体,Transcription regulator为转录调节因子,Direct relationship为直接关系,Indirect relationship为间接关系
目前尚缺乏有关GDM患者白细胞中免疫相关基因NOS2、SFTPD表达与糖代谢异常关系的文献报道[10,11]。本研究选择符合纳入与排除标准的87例GDM孕妇和38例非GDM孕妇为研究对象,分别纳入GDM组和非GDM组,GDM组白细胞NOS2和SFTPD mRNA相对表达水平均明显高于与非GDM组,并且差异均有统计学意义(P<0.001)。这提示,GDM患者高血糖环境可能促进白细胞NOS2和SFTPD基因过表达,这2种基因在GDM的发病机制中,可能具有病理生理学意义。GDM患者白细胞中炎症反应、胰岛素抵抗、葡萄糖与脂质代谢异常,以及氧化应激相关基因表达,存在复杂改变[10]。这提示,机体高血糖环境可以在转录水平上调节NOS2和SFTPD等基因表达。NOS2基因过表达导致NO水平增高,这与糖尿病并发症的发生相关[11]。本研究结果发现,GDM孕妇白细胞NOS2 mRNA相对表达水平相对于非GDM孕妇上调近10倍,这支持高血糖与NOS2基因过表达及亚硝化应激有关的假设,具体机制可能为高血糖诱导的氧化应激导致机体过度产生活性氧,而活性氧又与NO反应,产生硝化应激。本研究结果亦显示,2组孕妇白细胞NOS2 mRNA相对表达水平与妊娠期血清CRP呈弱正相关关系(r=0.34,P<0.001)。CRP是主要由肝脏产生的免疫系统激活标志物的急性期血浆蛋白,CRP可刺激iNOS的激活和基因表达,并且通过核因子-κB依赖机制促进血管平滑肌细胞IL-6和MCP-1表达。CRP在炎症、动脉粥样硬化的发生中具有重要作用。白细胞NOS2过表达且血清CRP水平升高的孕妇,动脉粥样硬化发生风险增大。
SP-D是一种肺特异性蛋白,可增强机体清除病原体,调节炎症反应。SP-D可能是炎症、肥胖和胰岛素抵抗相互影响的重要因素[7]。本研究结果显示,GDM孕妇白细胞SFTPD mRNA相对表达水平较非GDM孕妇显著增高,并且差异均有统计学意义(P<0.001)。这提示,GDM孕妇白细胞SFTPD基因表达水平上调,可能为高血糖环境诱导机体发生氧化应激和炎症反应,进而促进具有抗氧化和抗炎特性的SP-D高表达。本研究白细胞SFTPD mRNA相对表达水平与空腹血糖值、HOMA-IR和血清CRP存在弱正相关关系(r=0.19、0.21、0.34,P<0.05)。文献报道,妊娠小鼠胰腺B细胞中SP-D表达升高时,可见促炎细胞因子IL-1β、TNF-α存在,由此推测白细胞SP-D表达可能与妊娠期炎症相关[12]。
为了探讨与NOS2和SP-D相互作用的可能因素,本研究基于已有文献报道的NOS2和SFTPD基因调控网络和途径,采用IPA数据库分别构建与NOS2、SFTPD基因相关的分子网络图的结果显示,在IPA数据库检索到12种NOS2基因相关因素,而未检索到SFTPD基因相关因素。这12种NOS2基因相关因素包括以下4类。①细胞/生长因子:IL-1β、-6、-10, TNF-α、IFNG、VEGFA、TGF-β1;②趋化因子:MCP-1/CCL2;③酶:COX-2;④转录因子:HIF-1a、STAT3、PPARG[13]。这表明,NOS2可能参与增加促炎细胞因子表达的相关病理过程。研究结果证实,IL-1β、IFNG、TNF-α、IL-6和MCP-1/CCL2等促炎细胞因子,可刺激胰腺B细胞、肌细胞、脂肪细胞及噬菌体产生NOS2[14]。IL-10高表达与动脉粥样硬化斑块iNOS表达显著降低及细胞死亡有关[15]。糖尿病患者血浆中上述细胞因子水平发生变化,因此通过抑制细胞因子介导的iNOS,可诱导巨噬细胞和血管平滑肌细胞产生抗炎作用。与iNOS相关的另一个重要因素为VEGFA,为促进胚胎发育、伤口愈合、血管炎、血管纤维化的内皮细胞丝裂原。VEGFA通过VEGF受体-2的刺激,上调人脐静脉内皮细胞中iNOS和内皮型NOS生成[16]。VEGFA可调控妊娠期血管发生和内皮细胞通透性,参与调节GDM患者白细胞NOS2表达。本研究对于NOS2和SFTPD基因及其相关因素的生物信息学分析结果显示,NOS2基因亦可能是一些转录因子的重要靶点,如STAT3、PPARG和HIF-1a。文献报道,STAT3和PPARG对肾小球系膜细胞和胰腺B细胞中iNOS基因表达具有抑制作用[17,18],PPARG是参与葡萄糖和脂质代谢及炎症相关基因表达的核受体超家族配体激活受体,可保护胰腺B细胞免受IL-1β诱导核因子-κB活性降低所致的B细胞功能障碍[19]。与STAT3和PPARG相反,HIF-1α、VEGFA和PTGS2等可上调NOS2表达[20]。PTGS2基因编码的前列腺素G/H合成酶2,也被称为COX-2,在前列腺素生物合成中起着关键作用,PTGS2基因亦是非甾体抗炎止痒药物的治疗靶点。NO与前列腺素E2(由NOS2和COX-2产生),均为重要炎症介质,NO产生的iNOS可诱导COX-2表达[21]。
综上所述,本研究结果认为:①GDM孕妇白细胞NOS2和SFTPD基因表达上调,可能与血糖增高影响NOS2和SFTPD免疫相关基因转录调控的缘故。②NOS2 mRNA相对表达水平与血清CRP呈正相关关系,SFTPD mRNA相对表达水平与血清CRP、空腹血糖及HOMA-IR呈正相关关系,NOS2和SFTPD基因过表达,可能与孕期血糖代谢功能障碍和(或)炎症有关。③在IPA数据库检索到与NOS2基因过表达相关因素为12种,包括调控炎症反应的细胞因子与调控生长的生长因子、趋化因子、酶和转录因子。进一步对GDM孕妇和非GDM孕妇白细胞中差异表达基因及其功能的研究,可能对于阐明NOS2基因在GDM发病机制中的作用具有一定价值。






























