
探讨人乳头瘤病毒(HPV)-E6/E7 mRNA检测,在宫颈癌初筛(宫颈癌初筛Cervista法检测)结果为高危型HPV DNA呈阳性受试者的临床价值。
选取2015年11月30日至2016年11月30日,在湖州市妇幼保健院妇科就诊的437例高危型HPV DNA呈阳性受试者为研究对象。按照年龄,将其分为≥25~30岁组(n=118)、≥30~40岁组(n=117)、≥40~50岁组(n=129)、≥50~60岁组(n=52)、≥60~65岁组(n=21)。对所有受试者进行新柏液基薄层细胞学检查(TCT)和支链DNA(bDNA)技术检测宫颈脱落细胞HPV-E6/E7 mRNA表达情况及阴道镜检查,并对可疑部位取组织标本进行活组织病理学检查,以病理学检查结果为"金标准"。比较不同年龄组、不同组织病理学诊断结果受试者HPV-E6/E7 mRNA表达情况,评估HPV-E6/E7 mRNA检测在宫颈病变筛查中的价值。不同年龄组、不同组织病理学诊断结果受试者的HPV-E6/E7 mRNA阳性率比较,以及HPV-E6/E7 mRNA检测与TCT预测组织病理学诊断结果为宫颈病变≥高级别鳞状上皮内瘤变(HSIL)的敏感度、特异度、阳性预测值、阴性预测值比较,采用χ2检验或Fisher确切概率法。本研究遵循的程序符合2013年修订的《世界医学协会赫尔辛基宣言》要求,并与所有受试者签署临床研究知情同意书。
①不同年龄组高危型HPV DNA呈阳性受试者的HPV-E6/E7 mRNA阳性率比较,差异无统计学意义(P>0.05)。②对437例高危型HPV DNA呈阳性受试者的组织病理学诊断结果显示,正常宫颈组织为149例,低级别鳞状上皮内瘤变(LSIL)为60例,HSIL为215例[宫颈上皮内瘤变(CIN)2、3级各为73例和142例],宫颈鳞状细胞癌(SCC)为9例,宫颈腺癌为4例。③组织病理学诊断结果为宫颈病变≥HSIL受试者的HPV-E6/E7 mRNA阳性率为98.2%(224/228),显著高于组织病理学诊断结果为宫颈病变≤LSIL者(45.5%,95/209),并且差异有统计学意义(χ2=151.507,P<0.001)。④在437例高危型HPV DNA呈阳性受试者中,HPV-E6/E7 mRNA检测对于预测组织病理学诊断结果为宫颈病变≥HSIL的敏感度和阴性预测值,均显著高于TCT,分别为98.2%(224/228) vs 71.1%(162/228)和96.6%(114/118) vs 68.7%(145/211),并且差异均有统计学意义(χ2=64.870、35.140,P<0.001);其特异度显著低于TCT ,分别为54.6% (114/209)与69.4%(145/209),并且差异亦有统计学意义(χ2=8.925,P=0.003);而二者的阳性预测值比较,差异无统计学意义(χ2=0.137,P=0.711)。⑤在TCT结果分别为无上皮内病变或恶性病变(NILM)与未明确意义的非典型鳞状上皮细胞(ASC-US)的高危型HPV DNA呈阳性受试者中,HPV-E6/E7 mRNA检测,对于预测组织病理学诊断结果为宫颈病变≥HSIL的敏感度、特异度、阳性预测值、阴性预测值分别为97.0%(64/66)、56.6%(82/145)、50.4%(64/127)、97.6%(82/84)与100.0%(32/32)、62.5%(20/32)、72.7%(32/44)、100.0%(20/20)。
使用bDNA技术检测HPV-E6/E7 mRNA表达情况,对宫颈癌初筛结果为高危型HPV DNA呈阳性受试者的宫颈病变进一步筛查具有一定临床价值。采用bDNA技术对高危型HPV DNA呈阳性,而TCT结果为NILM或ASC-US受试者进行分流,可降低宫颈病变漏诊率和阴道镜转诊率。

版权所有,未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别申明,本刊刊出的所有文章不代表中华医学会和本刊编辑委员会的观点。
本刊为电子杂志,以光盘形式出版。本册应读者需求按需印刷,随光盘免费赠阅。光盘如有质量问题,请向编辑部调换。
人乳头瘤病毒(human papilloma virus,HPV)感染,特别是高危型HPV持续感染是宫颈癌癌前病变和宫颈癌的主要病因[1]。但是,多数HPV感染是无症状的和一过性的,而且多数新发HPV感染可在2年内自行消退[2],这使得HPV DNA检测虽然具有较高敏感度,但是特异度相对较低[3]。细胞学检查是高危型HPV呈阳性受试者的分流方法,但是由于制片的误差和阅片者的主观性等,使得细胞学检查对高危型HPV呈阳性受试者进一步筛查具有一定局限性,而且导致的漏诊率较高。高危型HPV-E6/E7基因在宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)与宫颈癌组织中的表达情况及其相关性,可为宫颈癌的临床诊断及开展基因治疗提供实验依据[4]。因此,监测高危型HPV-E6/E7 mRNA表达情况,具有非常重要意义。本研究对高危型HPV DNA呈阳性受试者进行新柏液基薄层细胞学检查(ThinPrep liquid-based cytology test,TCT),并采用支链DNA(branched DNA,bDNA)技术检测其宫颈脱落细胞HPV-E6/E7 mRNA表达情况,旨在探讨高危型HPV-E6/E7 mRNA表达在宫颈癌筛查中的临床意义及应用价值。现将研究结果报道如下。
选取2015年11月30日至2016年11月30日,在湖州市妇幼保健院妇科门诊就诊的437例高危型HPV DNA检测(宫颈癌初筛Cervista法)呈阳性女性为研究对象。按照437例高危型HPV DNA呈阳性受试者年龄,将其分为≥25~30岁组(n=118)、≥30~40岁组(n=117)、≥40~50岁组(n=129)、≥50~60岁组(n=52)、≥60~65岁组(n=21)。本研究遵循的程序符合2013年修订的《世界医学协会赫尔辛基宣言》要求,受试者自愿接受TCT,采用bDNA技术对宫颈脱落细胞进行高危型HPV-E6/E7 mRNA检测,阴道镜检查及宫颈组织标本的组织病理学检查,并签署临床研究知情同意书。
采用Cervista HPV试剂[批号:147683、15371300,豪洛捷医疗科技(北京)有限公司](酶切信号放大法)和设备(杭州钻柏科技有限公司),参照美国食品与药品管理局(Food and Drug Administration,FDA)批准的定性体外诊断方法,检测14种高危型HPV亚型(HPV-16、-18、-31、-33、-35、-39、-45、-51、-52、-56、-58、-59、-66、-68)。若其中1种高危型HPV DNA呈阳性,即被诊断为高危型HPV DNA呈阳性。
本研究受试者纳入标准:①高危型HPV DNA检测(宫颈癌初筛Cervista法)呈阳性;②年龄为25~65岁;③有性生活史的非孕期女性。排除标准:①有宫颈治疗、手术治疗、盆腔放疗史;②HPV疫苗接种史;③纳入研究前3 d内有阴道冲洗及用药者。
由妇产科专业医师采集受试者宫颈外口及宫颈管的脱落细胞,采用ThinPrep全自动TCT系统(美国Hologic公司)进行宫颈细胞检测。由妇科病理学医师负责进行受试者宫颈细胞学分类诊断,结果判定参照2001 Bethesda系统分类标准[5]。
采用HPV-E6/E7 mRNA检测试剂盒(bDNA信号放大技术)[批号:1608A、1608A5,科蒂亚(新乡)生物技术有限公司],对14种高危型HPV亚型(HPV-16、-18、-31、-33、-35、-39、 -45、 -51、 -52、 -56、 -58、 -59、 -66、 -68)E6/E7 mRNA进行检测。bDNA技术具体步骤如下:利用捕获杂交信号放大原理,采用捕获探针直接捕获受试者TCT标本中宫颈细胞裂解后释放的HPV-E6/E7 mRNA,经探针3步信号级联放大后,采用Quanti Virus™冷光仪[科蒂亚(新乡)生物技术有限公司]检测HPV-E6/E7 mRNA表达情况。Quanti Virus™冷光仪可直接将光子数转变为HPV-E6/E7 mRNA的拷贝数输出。Quanti Virus™冷光仪中还直接内置阈值计算软件[科蒂亚(新乡)生物技术有限公司]等,经仪器综合分析后,若受试者HPV-E6/E7 mRNA值≥1 copy,则判断为HPV-E6/E7 mRNA呈阳性;若受试者HPV-E6/E7 mRNA值<1 copy,则判为HPV-E6/E7 mRNA呈阴性。
采用电子阴道镜,由妇科医师进行操作,全面检查受试者外阴、阴道及宫颈、阴道部,对异常部位(醋酸白斑区、碘不染色区、异常血管区等)取组织标本,进行组织病理学检查。所有宫颈组织标本经石蜡包埋、切片,苏木精-伊红染色,由2位资深病理科医师阅片后作出组织病理学诊断。采集标本的组织病理学诊断分为:正常宫颈组织,低级别鳞状上皮内瘤变(low-grade squamous intraepithelial lesion,LSIL),高级别鳞状上皮内瘤变(high-grade squamous intraepithelial lesion,HSIL),包括CIN 2~3级,以及宫颈鳞状细胞癌(squamous cell carcinoma,SCC)及宫颈腺癌。
本研究数据采用SPSS 22.0统计学软件包进行统计学分析。采用Ssize软件,确定满足本研究统计检验的最小样本量。以采集标本的组织病理学检查结果为"金标准",计算TCT及HPV-E6/E7 mRNA检测(bDNA技术)诊断宫颈病变的敏感度、特异度、阳性预测值、阴性预测值,以及HPV-E6/E7 mRNA检测在宫颈癌筛查中的作用及意义。对于HPV-E6/E7 mRNA阳性率、敏感度、特异度、阳性预测值、阴性预测值等计数资料,采用率(%)表示。不同年龄组、不同组织病理学诊断结果受试者HPV-E6/E7 mRNA阳性率比较,以及HPV-E6/E7 mRNA检测与TCT预测组织病理学诊断结果为宫颈病变≥HSIL的敏感度、特异度、阳性预测值、阴性预测值比较,采用χ2检验;若最小理论频数<1,则采用Fisher确切概率法。所有统计学检验采用双侧检验,以P<0.05表示差异有统计学意义。
本研究437例高危型HPV DNA呈阳性受试者中,HPV-E6/E7 mRNA阳性率为73.0%(319/437)。不同年龄组HPV-E6/E7 mRNA阳性率比较,差异无统计学意义(P>0.05),见表1。
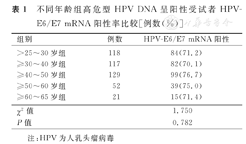
不同年龄组高危型HPV DNA呈阳性受试者HPV-E6/E7 mRNA阳性率比较[例数(%)]
不同年龄组高危型HPV DNA呈阳性受试者HPV-E6/E7 mRNA阳性率比较[例数(%)]
| 组别 | 例数 | HPV-E6/E7 mRNA阳性 |
|---|---|---|
| >25~30岁组 | 118 | 84(71.2) |
| ≥30~40岁组 | 117 | 82(70.1) |
| ≥40~50岁组 | 129 | 99(76.7) |
| ≥50~60岁组 | 52 | 39(75.0) |
| ≥60~65岁组 | 21 | 15(71.4) |
| χ2值 | 1.750 | |
| P值 | 0.782 |
注:HPV为人乳头瘤病毒
本研究437例高危型HPV DNA呈阳性受试者的组织病理学诊断结果:正常宫颈组织为149例,LSIL为60例,HSIL为215例,宫颈SCC为9例,宫颈腺癌为4例。TCT结果:无上皮内病变或恶性病变(no intraepithelial lesion or malignant,NILM)为211例,未确定意义的非典型鳞状细胞(atypical-squamous cells of undetermined significance,ASC-US)为64例,LSIL为74例,非典型鳞状上皮细胞不除外高级别鳞状上皮内病变(atypical squamous cells, cannot exclude high-grade squamous intraepithelial lesion,ASC-H)为27例,HSIL为60例,宫颈SCC为1例,见表2。
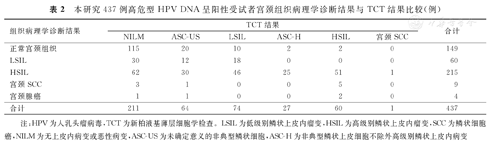
本研究437例高危型HPV DNA呈阳性受试者宫颈组织病理学诊断结果与TCT结果比较(例)
本研究437例高危型HPV DNA呈阳性受试者宫颈组织病理学诊断结果与TCT结果比较(例)
| 组织病理学诊断结果 | TCT结果 | 合计 | |||||
|---|---|---|---|---|---|---|---|
| NILM | ASC-US | LSIL | ASC-H | HSIL | 宫颈SCC | ||
| 正常宫颈组织 | 115 | 20 | 10 | 2 | 2 | 0 | 149 |
| LSIL | 30 | 12 | 18 | 0 | 0 | 0 | 60 |
| HSIL | 62 | 30 | 46 | 25 | 51 | 1 | 215 |
| 宫颈SCC | 3 | 1 | 0 | 0 | 5 | 0 | 9 |
| 宫颈腺癌 | 1 | 1 | 0 | 0 | 2 | 0 | 4 |
| 合计 | 211 | 64 | 74 | 27 | 60 | 1 | 437 |
注:HPV为人乳头瘤病毒,TCT为新柏液基薄层细胞学检查。LSIL为低级别鳞状上皮内瘤变,HSIL为高级别鳞状上皮内瘤变,SCC为鳞状细胞癌,NILM为无上皮内病变或恶性病变,ASC-US为未确定意义的非典型鳞状细胞,ASC-H为非典型鳞状上皮细胞不除外高级别鳞状上皮内病变
本研究437例高危型HPV DNA呈阳性受试者中,随着宫颈病变程度增加,HPV-E6/E7 mRNA阳性率也逐渐增加。组织病理学诊断结果为LSIL受试者的HPV-E6/-E7 mRNA阳性率与正常宫颈组织受试者比较,HSIL受试者与宫颈SCC、腺癌受试者比较,差异均无统计学意义(P>0.05)。组织病理学诊断结果为宫颈病变≥HSIL受试者的HPV-E6/E7 mRNA阳性率,显著高于织病理学诊断结果为宫颈病变≤LSIL者,并且差异有统计学意义(P<0.001),见表3。
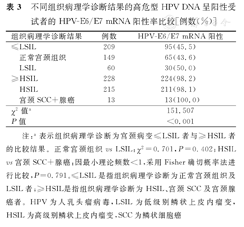
不同组织病理学诊断结果的高危型HPV DNA呈阳性受试者的HPV-E6/E7 mRNA阳性率比较[例数(%)]
不同组织病理学诊断结果的高危型HPV DNA呈阳性受试者的HPV-E6/E7 mRNA阳性率比较[例数(%)]
| 组织病理学诊断结果 | 例数 | HPV-E6/E7 mRNA阳性 | |
|---|---|---|---|
| ≤LSIL | 209 | 95(45.5) | |
| 正常宫颈组织 | 149 | 65(43.6) | |
| LSIL | 60 | 30(50.0) | |
| ≥HSIL | 228 | 224(98.2) | |
| HSIL | 215 | 211(98.1) | |
| 宫颈SCC+腺癌 | 13 | 13(100.0) | |
| χ2值a | 151.507 | ||
| P值 | <0.001 | ||
注:a表示组织病理学诊断为宫颈病变≤LSIL者与≥HSIL者的比较结果。正常宫颈组织vs LSIL:χ2=0.701,P=0.402;HSIL vs宫颈SCC+腺癌:因最小理论频数<1,采用Fisher确切概率法进行比较,P=0.791。≤LSIL是指组织病理学诊断为正常宫颈组织及LSIL者;≥HSIL是指组织病理学诊断为HSIL、宫颈SCC及宫颈腺癌者。HPV为人乳头瘤病毒,LSIL为低级别鳞状上皮内瘤变,HSIL为高级别鳞状上皮内瘤变,SCC为鳞状细胞癌
在437例高危型HPV DNA呈阳性受试者中,HPV-E6/E7 mRNA检测对于预测组织病理学诊断结果为宫颈病变≥HSIL的敏感度和阴性预测值分别为98.2%(224/228)、96.6%(114/118),均显著高于TCT以≥ASC-US为阳性阈值的敏感度(71.1%,162/228)和阴性预测值(68.7%,145/211),并且差异均有统计学意义(P<0.001);但是显著低于TCT以≥ASC-US为阳性阈值的特异度,分别为54.5%(114/209)与69.4%(145/209),二者比较,差异亦有统计学意义(P=0.003);二者的阳性预测值比较,差异无统计学意义(P>0.05),见表4、表5。
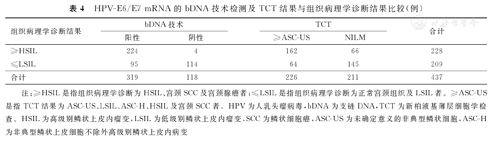
HPV-E6/E7 mRNA的bDNA技术检测及TCT结果与组织病理学诊断结果比较(例)
HPV-E6/E7 mRNA的bDNA技术检测及TCT结果与组织病理学诊断结果比较(例)
| 组织病理学诊断结果 | bDNA技术 | TCT | 合计 | ||
|---|---|---|---|---|---|
| 阳性 | 阴性 | ≥ASC-US | NILM | ||
| ≥HSIL | 224 | 4 | 162 | 66 | 228 |
| ≤LSIL | 95 | 114 | 64 | 145 | 209 |
| 合计 | 319 | 118 | 226 | 211 | 437 |
注:≥HSIL是指组织病理学诊断为HSIL、宫颈SCC及宫颈腺癌者;≤LSIL是指组织病理学诊断为正常宫颈组织及LSIL者。≥ASC-US是指TCT结果为ASC-US、LSIL、ASC-H、HSIL及宫颈SCC者。HPV为人乳头瘤病毒,bDNA为支链DNA,TCT为新柏液基薄层细胞学检查。HSIL为高级别鳞状上皮内瘤变,LSIL为低级别鳞状上皮内瘤变,SCC为鳞状细胞癌,ASC-US为未确定意义的非典型鳞状细胞,ASC-H为非典型鳞状上皮细胞不除外高级别鳞状上皮内病变
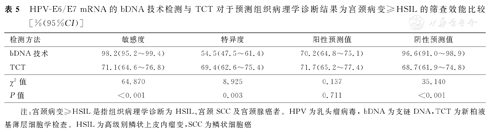
HPV-E6/E7 mRNA的bDNA技术检测与TCT对于预测组织病理学诊断结果为宫颈病变≥HSIL的筛查效能比较[%(95%CI)]
HPV-E6/E7 mRNA的bDNA技术检测与TCT对于预测组织病理学诊断结果为宫颈病变≥HSIL的筛查效能比较[%(95%CI)]
| 检测方法 | 敏感度 | 特异度 | 阳性预测值 | 阴性预测值 |
|---|---|---|---|---|
| bDNA技术 | 98.2(95.2~99.4) | 54.5(47.5~61.4) | 70.2(64.8~75.1) | 96.6(91.0~98.9) |
| TCT | 71.1(64.6~76.8) | 69.4(62.6~75.4) | 71.7(65.2~77.4) | 68.7(61.9~74.8) |
| χ2值 | 64.870 | 8.925 | 0.137 | 35.140 |
| P值 | <0.001 | 0.003 | 0.711 | <0.001 |
注:宫颈病变≥HSIL是指组织病理学诊断为HSIL、宫颈SCC及宫颈腺癌者。HPV为乳头瘤病毒,bDNA为支链DNA,TCT为新柏液基薄层细胞学检查。HSIL为高级别鳞状上皮内瘤变,SCC为鳞状细胞癌
HPV-E6/E7 mRNA检测在TCT结果为NLIM和ASC-US的高危型HPV DNA呈阳性受试者中,预测组织病理学诊断结果为宫颈病变≥HSIL的敏感度(97.0%、100.0%)和阴性预测值(97.6%、100.0%)均很高,而特异度和阳性预测值却均较低。HPV-E6/E7 mRNA检测在TCT结果为LSIL的高危型HPV DNA呈阳性受试者中,预测组织病理学诊断结果为宫颈病变≥HSIL的敏感度(97.8%)很高,特异度和阳性预测值较低,阴性预测值较高(90.9%)。HPV-E6/E7 mRNA检测在TCT结果为宫颈病变≥ASC-H的高危型HPV DNA呈阳性受试者中,预测组织病理学诊断宫颈病变≥HSIL的敏感度(98.8%)和阳性预测值(97.7%)均很高,而特异度和阴性预测值却均较低。HPV-E6/E7 mRNA检测在不同TCT结果的高危型HPV DNA呈阳性受试者中的筛查效能,见表6,表7,表8,表9。
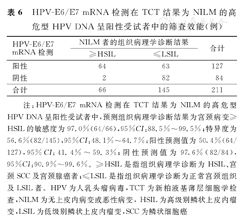
HPV-E6/E7 mRNA检测在TCT结果为NILM的高危型HPV DNA呈阳性受试者中的筛查效能(例)
HPV-E6/E7 mRNA检测在TCT结果为NILM的高危型HPV DNA呈阳性受试者中的筛查效能(例)
| HPV-E6/E7 mRNA检测 | NILM者的组织病理学诊断结果 | 合计 | |
|---|---|---|---|
| ≥HSIL | ≤LSIL | ||
| 阳性 | 64 | 63 | 127 |
| 阴性 | 2 | 82 | 84 |
| 合计 | 66 | 145 | 211 |
注:HPV-E6/E7 mRNA检测在TCT结果为NILM的高危型HPV DNA呈阳性受试者中,预测组织病理学诊断结果为宫颈病变≥HSIL的敏感度为97.0%(64/66),95%CI:88.5%~99.5%;特异度为56.6%(82/145),95%CI:48.1%~64.7%;阳性预测值为50.4%(64/127),95%CI:41.4%~59.3%;阴性预测值为97.6%(82/84),95%CI:90.9%~99.6%。≥HSIL是指组织病理学诊断为HSIL、宫颈SCC及宫颈腺癌者;≤LSIL是指组织病理学诊断为正常宫颈组织及LSIL者。HPV为人乳头瘤病毒,TCT为新柏液基薄层细胞学检查,NILM为无上皮内病变或恶性病变,HSIL为高级别鳞状上皮内瘤变,LSIL为低级别鳞状上皮内瘤变,SCC为鳞状细胞癌
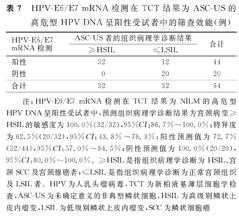
HPV-E6/E7 mRNA检测在TCT结果为ASC-US的高危型HPV DNA呈阳性受试者中的筛查效能(例)
HPV-E6/E7 mRNA检测在TCT结果为ASC-US的高危型HPV DNA呈阳性受试者中的筛查效能(例)
| HPV-E6/E7 mRNA检测 | ASC-US者的组织病理学诊断结果 | 合计 | |
|---|---|---|---|
| ≥HSIL | ≤LSIL | ||
| 阳性 | 32 | 12 | 44 |
| 阴性 | 0 | 20 | 20 |
| 合计 | 32 | 32 | 64 |
注:HPV-E6/E7 mRNA检测在TCT结果为NILM的高危型HPV DNA呈阳性受试者中,预测组织病理学诊断结果为宫颈病变≥HSIL的敏感度为100.0%(32/32),95%CI:86.7%~100.0%;特异度为62.5%(20/32),95%CI:43.8%~78.3%;阳性预测值为72.7%(32/44),95%CI:57.0%~84.5%;阴性预测值为100.0%(20/20),95%CI:80.0%~100.0%。≥HSIL是指组织病理学诊断为HSIL、宫颈SCC及宫颈腺癌者;≤LSIL是指组织病理学诊断为正常宫颈组织及LSIL者。HPV为人乳头瘤病毒,TCT为新柏液基薄层细胞学检查,ASC-US为未确定意义的非典型鳞状细胞,HSIL为高级别鳞状上皮内瘤变,LSIL为低级别鳞状上皮内瘤变,SCC为鳞状细胞癌

HPV-E6/E7 mRNA检测在TCT结果为LSIL的高危型HPV DNA呈阳性受试者中的筛查效能(例)
HPV-E6/E7 mRNA检测在TCT结果为LSIL的高危型HPV DNA呈阳性受试者中的筛查效能(例)
| HPV-E6/E7 mRNA检测 | LSIL者的组织病理学诊断结果 | 合计 | |
|---|---|---|---|
| ≥HSIL | ≤LSIL | ||
| 阳性 | 45 | 18 | 63 |
| 阴性 | 1 | 10 | 11 |
| 合计 | 46 | 28 | 74 |
注:HPV-E6/E7 mRNA检测在TCT结果为LSIL的高危型HPV DNA呈阳性受试者中,预测组织病理学诊断结果为宫颈病变≥HSIL的敏感度为97.8%(45/46),95%CI:87.0%~99.9%;特异度为35.7%(10/28),95%CI:19.3%~55.9%;阳性预测值为71.4%(45/63),95%CI:58.5%~81.8%;阴性预测值为90.9%(10/11),95%CI:57.1%~99.5%。≥HSIL是指组织病理学诊断为HSIL、宫颈SCC及宫颈腺癌者;≤LSIL是指组织病理学诊断为正常宫颈组织及LSIL者。HPV为人乳头瘤病毒,TCT为新柏液基薄层细胞学检查,LSIL为低级别鳞状上皮内瘤变,HSIL为高级别鳞状上皮内瘤变,SCC为鳞状细胞癌

HPV-E6/E7 mRNA检测在TCT结果为≥ASC-H的高危型HPV DNA呈阳性受试者中的筛查效能(例)
HPV-E6/E7 mRNA检测在TCT结果为≥ASC-H的高危型HPV DNA呈阳性受试者中的筛查效能(例)
| HPV-E6/E7 mRNA检测 | ≥ASC-H者的组织病理学诊断结果 | 合计 | |
|---|---|---|---|
| ≥HSIL | ≤LSIL | ||
| 阳性 | 83 | 2 | 85 |
| 阴性 | 1 | 2 | 3 |
| 合计 | 84 | 4 | 88 |
注:HPV-E6/E7 mRNA检测在TCT结果为≥ASC-H的高危型HPV DNA呈阳性受试者中,预测组织病理学诊断结果为宫颈病变≥HSIL的敏感度为98.8%(83/84),95%CI:92.6%~99.9%;特异度为50.0%(2/4),95%CI:92.0%~90.8%;阳性预测值为97.7%(83/85),95%CI:91.0%~99.6%;阴性预测值为66.7%(2/3),95%CI:12.5%~98.2%。≥HSIL是指组织病理学诊断为HSIL、宫颈SCC及宫颈腺癌者;≤LSIL是指组织病理学诊断为正常宫颈组织及LSIL者。HPV为人乳头瘤病毒,TCT为新柏液基薄层细胞学检查,ASC-H为细胞学检查为非典型鳞状上皮细胞不除外高级别鳞状上皮内病变,HSIL为高级别鳞状上皮内瘤变,LSIL为低级别鳞状上皮内瘤变,SCC为鳞状细胞癌
HPV-E6/E7作为HPV癌基因,是导致宫颈细胞癌变的关键,HPV-E6/E7 mRNA是HPV癌基因的转录产物。检测结果若为HPV-E6/E7 mRNA呈阳性,则说明HPV是活动的,可能具有翻译成HPV-E6/E7蛋白而发挥致癌作用。研究表明,癌基因HPV-E6/E7表达,是CIN和宫颈癌发生的必要步骤,其表达产物HPV-E6/E7蛋白是导致宫颈癌发生的关键[6]。随着对HPV-E6/E7蛋白在宫颈癌发病机制中的作用研究逐渐深入,研究者提出,对HPV-E6/E7蛋白表达过程中反映其转录活性的HPV-E6/E7 mRNA进行检测,对于预测宫颈癌进展的准确性可能更高[7,8]。目前认为,高危型HPV-E6/E7 mRNA表达,是反映HPV感染和宫颈病变进展的临床标志物[9,10]。HPV-E6/E7 mRNA检测技术之一bDNA技术,是一种"三明治"结构的核酸杂交检测方法,即采用bDNA分子放大捕获目标DNA/RNA信号,可以检测14种高危型HPV亚型,其优势在于无需经过指数增长扩增过程,放大倍数稳定,重复性、稳定性均较高[11]。
本研究结果显示,不同年龄组受试者高危型HPV-E6/E7 mRNA阳性率比较,差异无统计学意义(P>0.05),其中以>40~50岁组受试者高危型HPV-E6/E7 mRNA阳性率最高。中国妇女HPV感染呈双峰状,即17~24岁和40~44岁2个高峰,这可能与不同年龄女性的机体免疫力有关[12]。这与本研究结果基本一致。同时,本研究结果显示,HPV-E6/E7 mRNA阳性率随着宫颈组织病理学分级的增高而增高,这与Ratnam等[13]研究结果一致。本研究中,组织病理学诊断结果为宫颈病变≥HSIL者的HPV-E6/E7 mRNA阳性率,显著高于组织病理学诊断结果为宫颈病变≤LSIL者,并且差异有统计学意义(P<0.001)。这提示,HPV-E6/E7 mRNA阳性率与宫颈病变严重程度密切相关,HPV-E6/E7 mRNA高表达,可能促进宫颈病变的发生和发展。因此,HPV-E6/E7 mRNA表达情况与宫颈病变程度的密切关系,为其作为宫颈病变初筛结果为高危型HPV DNA呈阳性受试者的分流手段,提供了依据。
在宫颈癌初筛结果的处理中,对于初筛结果为高危型HPV DNA呈阳性者,可以采取TCT进一步分流。但是,TCT对高危型HPV DNA呈阳性者进行分流的敏感度欠佳,而且TCT结果的准确性依赖于细胞病理学医师的既往经验,而国内细胞病理学医师稀缺,作为一项需要人工判断检测结果的检测方法,受人为因素的主观影响大,而导致诊断结果的重复性差。美国Athena(高危型HPV检测单独用于宫颈癌初筛)研究结果显示,在社会人口因素、宫颈癌高危因素及癌前病变发生率相似的背景下,TCT结果在不同检测机构间具有较大差异,TCT对CIN2检测的敏感度为42%~73%[14]。本研究比较HPV-E6/E7 mRNA检测和TCT以宫颈病变≥ASC-US为阳性阈值,对高危型HPV DNA呈阳性受试者的分流价值发现,HPV-E6/E7 mRNA检测筛查宫颈病变≥HSIL的敏感度和阴性预测值较TCT高,这与TCT较高的特异度形成互补,这2种方法结合,可能对宫颈癌初筛结果为高危型HPV DNA呈阳性受试者的分流,起到优化作用。同时,HPV-E6/E7 mRNA检测筛查宫颈病变≥HSIL的阳性预测值与TCT比较,差异无统计学意义(P>0.05),这可能与采取bDNA技术检测HPV-E6/E7 mRNA有关。当HPV-E6/E7 mRNA拷贝数达到一定范围后,HPV-E6/E7 mRNA检测可能对预测组织病理学诊断结果为宫颈病变≥HSIL的风险更有重要意义[15],对此尚进一步研究、证实。
本研究进一步分析HPV-E6/E7 mRNA检测在宫颈癌初筛结果为高危型HPV DNA呈阳性受试者的不同TCT结果中的筛查效能显示,在211例TCT结果为NILM受试者中,使用HPV-E6/E7 mRNA检测进一步分流,可显著提高预测组织病理学诊断结果为宫颈病变≥HSIL的敏感度和阴性预测值,在HPV-E6/E7 mRNA呈阴性的84例NILM受试者中,组织病理学诊断结果为宫颈病变≥HSIL者为2例,而且这2例均为CIN2患者;在HPV-E6/E7 mRNA呈阳性的127例NILM受试者中,组织病理学诊断结果为宫颈病变≥HSIL者为64例,按照高危型HPV DNA呈阳性的处理流程,对于TCT初筛结果为NILM的高危型HPV DNA呈阳性者,建议在随后1年复查细胞学检查+HPV检查[16]。这64例组织病理学诊断结果为宫颈病变≥HSIL者,因为未被及时转诊阴道镜检查,进一步进行组织病理学诊断,而势必在第一次宫颈癌初筛时被漏诊。这在Liu等[17]研究中也有类似报道。因此,在宫颈癌初筛结果为高危型HPV DNA呈阳性,TCT结果为NILM的受试者中,进一步进行HPV-E6/E7 mRNA检测,对于HPV-E6/E7 mRNA呈阴性者,不需要进行阴道镜检查,若HPV-E6/E7 mRNA呈阳性,则应转诊阴道镜检查予以确诊,降低漏诊率。在TCT结果为ASC-US的64例受试者中,采用HPV-E6/E7 mRNA检测进一步分流,可显著提高预测组织病理学诊断结果为宫颈病变≥HSIL的敏感度和阴性预测值;而在HPV-E6/E7 mRNA呈阴性的20例受试者中,则未出现组织病理学诊断结果为宫颈病变≥HSIL者。因此,在宫颈癌初筛结果为高危型HPV DNA呈阳性,TCT结果为ASC-US的受试者中,若HPV-E6/E7 mRNA呈阴性,则不需要立即转诊阴道镜检查,仅需后续密切随访观察。因此,在最初需要进行阴道镜检查的64例TCT结果为ASC-US的受试者中,采用HPV-E6/E7 mRNA检测分流,仅44例受试者需要进一步进行阴道镜检查予以确诊,这大大降低了阴道镜转诊率。在TCT结果为LSIL的74例受试者中,采用HPV-E6/E7 mRNA检测进一步分流,虽然对于预测组织病理学诊断结果为宫颈病变≥HSIL的敏感度和阴性预测值显著提高,但是在HPV-E6/E7 mRNA呈阴性的11例受试者中,1例受试者的组织病理学诊断结果为宫颈病变≥HSIL,若采用HPV-E6/E7 mRNA检测进一步分流,在HPV-E6/E7 mRNA呈阴性受试者中,仍然有一定比例组织病理学诊断结果为宫颈病变≥HSIL者被漏诊。因此,对于TCT结果为LSIL的高危型HPV DNA呈阳性者,采用HPV-E6/E7 mRNA检测进一步分流的意义不大,应直接转诊阴道镜检查予以确诊。同样,在88例TCT结果为宫颈病变≥ASC-H受试者中,采用HPV-E6/E7 mRNA检测进一步分流,阴性预测值并未提高。因此,对于宫颈癌初筛结果为高危型HPV DNA呈阳性,TCT结果为宫颈病变≥ASC-H者,无需采用HPV-E6/E7 mRNA检测进一步分流,应直接转诊阴道镜检查予以确诊。
综上所述,使用bDNA技术检测HPV-E6/E7 mRNA表达情况,对宫颈癌初筛结果为高危型HPV DNA呈阳性受试者的细胞学检查进一步分流,可降低漏诊率与阴道镜检查转诊率。但是,由于本研究纳入样本量相对较小,而且为机会性筛查人群,样本存在一定偏倚,尚需要大样本、前瞻性研究进一步评估高危型HPV-E6/E7 mRNA检测在宫颈病变筛查中的价值,我们需要进一步追踪阴道镜检查结果为阴性的受试者,研究高危型HPV-E6/E7 mRNA检测在评估组织病理学诊断结果为宫颈病变≥HSIL者宫颈癌发病风险中的作用。






























