
探讨宫颈DNA倍体分析联合宫颈细胞学检查,在宫颈癌筛查中的应用价值。
采用回顾性研究方法,选取2016年1月1日至10月31日,在四川大学华西第二医院门诊进行宫颈癌筛查的862例女性为研究对象。对其进行宫颈DNA倍体分析、新柏液基薄层细胞学检查(TCT),对宫颈DNA倍体分析或TCT结果呈阳性者,均进行阴道镜检查,并取宫颈组织进行活组织病理学检查,以此结果作为诊断宫颈病变的"金标准",计算宫颈DNA倍体分析、TCT及2种方法联合筛查宫颈癌及其癌前病变的敏感度、特异度、阳性预测值和阴性预测值,比较这3种筛查方案的准确性。本研究遵循的程序符合2013年修订的《世界医学协会赫尔辛基宣言》要求。
①本组862例受试者的宫颈活组织病理学检查诊断结果为:正常宫颈组织为655例(76.0%)、宫颈上皮内瘤变(CIN)1~3级分别为109例(12.7%)、45例(5.2%)及39例(4.5%),宫颈癌为14例(1.6%),CIN2+(宫颈病变≥CIN2)检出率为11.4%(98/862)。宫颈DNA倍体分析结果的阳性率为32.5%(280/862),CIN2+检出率为10.9%(94/862)。TCT结果的阳性率为31.6%(272/862),CIN2+检出率为10.8%(93/862)。宫颈DNA倍体分析联合TCT筛查结果的阳性率为35.7%(308/862),CIN2+检出率为11.0%(95/862)。②宫颈DNA倍体分析、TCT及2种方法联合筛查CIN2+的敏感度分别为95.9%(94/98)、94.9%(93/98)与96.9%(95/98),特异度分别为75.7%(578/764)、76.6%(585/764)与72.1%(551/764),阳性预测值分别为33.6%(94/280)、34.2%(93/272)与30.8%(95/308),阴性预测值分别为99.3%(578/582)、99.2%(585/590)与99.5%(551/554)。宫颈DNA倍体分析与TCT联合筛查CIN2+的敏感度、阴性预测值,均分别高于这2种方案单独筛查。
宫颈DNA倍体分析与TCT联合筛查宫颈癌及其癌前病变,可提高筛查结果的准确性。因本研究仅为回顾性研究,这2种方案联合筛查宫颈癌及其癌前病变的价值,仍有待大样本、多中心、前瞻性随机对照研究予以证实。

版权所有,未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别申明,本刊刊出的所有文章不代表中华医学会和本刊编辑委员会的观点。
本刊为电子杂志,以光盘形式出版。本册应读者需求按需印刷,随光盘免费赠阅。光盘如有质量问题,请向编辑部调换。
宫颈癌是妇科常见恶性肿瘤之一,其发病率仅次于乳腺癌[1,2],为导致全球女性死亡的第二大原因[1]。据统计,全球每年宫颈癌新发患者约为50万例,其中80%以上来自发展中国家[1,2]。流行病学调查研究结果显示,宫颈癌与高危型人乳头瘤病毒(human papilloma virus, HPV)持续感染,首次性生活年龄小或多个性伴侣,性激素分泌失调,生活水平低、生活环境差及免疫功能低下等因素有关[3]。美国宫颈癌筛查策略的实施,使其近5年宫颈癌发病率每年约下降1.9%[4]。在我国,近年对适龄女性宫颈癌及其癌前病变的早期筛查和有效干预措施不断增强[4,5]。我国每年宫颈癌新发患者约为13万例,占世界宫颈癌新发患者的1/4,主要集中在中、西部地区,并且发病年龄呈年轻化趋势[1,2,5]。近年随着宫颈细胞学检查技术不断改善与发展,宫颈癌检出率明显增高,我国宫颈癌发病率及其导致的患者死亡率明显降低[6,7,8,9]。宫颈DNA倍体异常细胞分析,是诊断宫颈癌及其癌前病变的特异性指标[10]。部分国家已将宫颈DNA倍体分析应用于临床筛查宫颈癌及其癌前病变,但是因该技术的特殊要求,对其临床应用价值迄今尚存在争议,目前该技术在我国临床尚未广泛推广[11,12,13,14]。为探讨宫颈DNA倍体分析对筛查宫颈癌及其癌前病变的价值,本研究对采取宫颈DNA倍体分析和宫颈细胞学检查的862例女性的临床病例资料进行回顾性分析,探讨宫颈DNA倍体分析联合宫颈细胞学检查对于筛查宫颈癌及其癌前病变的准确性。现将研究结果报道如下。
选择2016年1月1日至10月31日,在四川大学华西第二医院门诊进行宫颈癌筛查的862例女性为研究对象,其年龄为19~72岁,平均年龄为43岁。所有受试者均自愿接受宫颈DNA倍体分析和新柏液基薄层细胞学检查(ThinPrep liquid-based cytology test,TCT)。对宫颈DNA倍体分析或TCT结果呈阳性者,均进行阴道镜检查,并取宫颈组织进行活组织病理学检查。本研究遵循的程序符合2013年修订的《世界医学协会赫尔辛基宣言》要求。
本研究纳入标准:①性生活史超过1年;②自愿接受宫颈脱落细胞DNA倍体分析、TCT及宫颈活组织病理学检查;③纳入研究前1周内无阴道用药史;④无阴道瘙痒等炎性症状。排除标准:①既往有宫颈病变史,3年内TCT、HPV检查结果呈阳性或宫颈DNA倍体分析结果呈阳性病史;②有宫颈手术史、子宫切除术史或其他影响宫颈脱落细胞DNA倍体分析或TCT结果的妇科疾病史;③合并严重肝、肾、心、脑及其他系统基础疾病者。
受试者取膀胱截石位,采用无菌棉签擦净宫颈分泌物,使用宫颈拭子于宫颈口顺时针方向旋转5圈,采集宫颈脱落细胞,进行DNA倍体分析及TCT。对宫颈脱落细胞悬液以2 000 r/min(离心半径为11 cm)离心5 min后,弃上清液,清除黏液,重新悬浮下层细胞后,制备细胞薄片,采用福尔根(Feulgen)染色法进行染色、封片。采用DNA倍体定量分析系统(武汉呵尔医疗科技发展有限公司)对细胞薄片进行扫描,以细胞薄片中正常细胞作为参照,系统根据收集到的细胞核染色体分布、形态特征、局部特定特征等参数,自动对受检细胞进行分类和计数。采用DNA指数(DNA index,DI)表示细胞中DNA含量。对于0.75≤DI<1.25的细胞,判断为正常细胞;对于1.25≤DI≤2.50的细胞,判断为疑似病变细胞或增生细胞;对于DI>2.50的细胞,判断为病变细胞。
宫颈DNA倍体分析对宫颈癌的诊断标准为:①正常受试者:细胞薄片内以正常细胞为主,未观察到病变细胞,并且疑似病变细胞或增生细胞比例<5%;②可疑受试者:观察到1~2个病变细胞,或者疑似病变细胞或增生细胞比例为5%~10%;③阳性患者:观察到≥3个病变细胞,或者疑似病变细胞或增生细胞比例>10%[12]。将正常和可疑受试者,均判断为宫颈DNA倍体分析结果呈阴性。所有DI>2.50的病变细胞,均经资深病理科医师复核确认,以保证宫颈DNA倍体分析结果的准确性。
对宫颈脱落细胞的TCT结果判断标准:参照2001年修订的国际标准巴氏分级系统(the Bethesda System,TBS)诊断标准[11]。TCT阳性是指未确定意义的非典型鳞状上皮细胞(atypical-squamous cell of undetermined significance,ASC-US)及以上病变。
对宫颈DNA倍体分析结果或TCT结果呈阳性的受试者,均进行电子阴道镜检查,并取可疑部位宫颈组织进行活组织病理学检查。组织切片经苏木精-伊红(hematoxylin-eosin,HE)染色后,由2位资深病理科医师阅片,按照2003年版世界卫生组织颁布的子宫颈肿瘤组织学分类标准[13],作出宫颈病变的组织病理学诊断。宫颈活组织病理学检查结果被分为:正常宫颈组织,宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)1~3级,以及宫颈癌(宫颈鳞状细胞癌和宫颈腺癌)。若宫颈活组织病理学检查诊断宫颈病变为CIN2、3及宫颈癌者,记为CIN2+,则诊断为宫颈病变呈阳性;若宫颈活组织病理学检查诊断为正常或CIN1级者,则诊断为宫颈病变呈阴性。
本研究数据采用SPSS 22.0统计学软件进行统计学分析。采用Ssize软件,确定满足本研究统计检验的最小样本量。对于宫颈DNA倍体分析、TCT阳性率,CIN2+检出率等计数资料,采用率(%)表示。以宫颈活组织病理学检查结果为"金标准",计算宫颈DNA倍体分析、TCT及这2种方法联合筛查CIN2+的敏感度、特异度、阳性预测值、阴性预测值。所有统计学检验采用双侧检验,以P<0.05表示差异有统计学意义。
对本组862例受试者采取不同宫颈癌筛查方法进行筛查:①宫颈活组织病理学检查诊断结果,正常宫颈组织为655例(76.0%)、CIN1级为109例(12.7%)、CIN2级为45例(5.2%)、CIN3级为39例(4.5%)、宫颈癌为14例(1.6%),CIN2+检出率为11.4%(98/862)。②宫颈DNA倍体分析结果的阳性率为32.5%(280/862),CIN2+检出率为10.9%(94/862)。③TCT结果中,无上皮内病变或恶性病变(no intraepithelial lesion or malignant,NILM)为590例,ASC-US为148例,低级别鳞状上皮内瘤变(low-grade squamous intraepithelial lesion,LSIL)为92例,高级别鳞状上皮内瘤变(high-grade squamous intraepithelial lesion,HSIL)为32例,宫颈病变≥ASC-US的阳性率为31.6%(272/862),CIN2+检出率为10.8%(93/862)。④宫颈DNA倍体分析联合TCT筛查结果的阳性率为35.7%(308/862),CIN2+检出率为11.0%(95/862)。
宫颈DNA倍体分析与TCT对宫颈活组织病理学检查结果为正常宫颈组织、CIN1级、CIN2级、CIN3级、宫颈癌的筛查结果阳性率分别为16.9%(111/655)、68.8%(75/109)、93.3%(42/45)、97.4%(38/39)、100.0%(14/14)与15.9%(104/655)、68.8%(75/109)、91.1%(41/45)、97.4%(38/39)、100.0%(14/14)。本组862例受试者宫颈活组织病理学检查、宫颈DNA倍体分析及TCT结果比较,见表1。
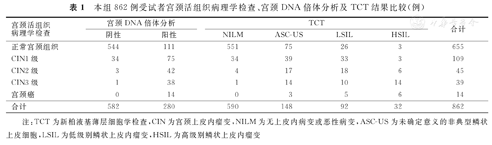
本组862例受试者宫颈活组织病理学检查、宫颈DNA倍体分析及TCT结果比较(例)
本组862例受试者宫颈活组织病理学检查、宫颈DNA倍体分析及TCT结果比较(例)
| 宫颈活组织病理学检查 | 宫颈DNA倍体分析 | TCT | 合计 | ||||
|---|---|---|---|---|---|---|---|
| 阴性 | 阳性 | NILM | ASC-US | LSIL | HSIL | ||
| 正常宫颈组织 | 544 | 111 | 551 | 75 | 26 | 3 | 655 |
| CIN1级 | 34 | 75 | 34 | 39 | 33 | 3 | 109 |
| CIN2级 | 3 | 42 | 4 | 17 | 18 | 6 | 45 |
| CIN3级 | 1 | 38 | 1 | 14 | 10 | 14 | 39 |
| 宫颈癌 | 0 | 14 | 0 | 3 | 5 | 6 | 14 |
| 合计 | 582 | 280 | 590 | 148 | 92 | 32 | 862 |
注:TCT为新柏液基薄层细胞学检查,CIN为宫颈上皮内瘤变,NILM为无上皮内病变或恶性病变,ASC-US为未确定意义的非典型鳞状上皮细胞,LSIL为低级别鳞状上皮内瘤变,HSIL为高级别鳞状上皮内瘤变
宫颈DNA倍体分析、TCT及2种方法联合筛查CIN2+的敏感度分别为95.9%(94/98)、94.9%(93/98)与96.9%(95/98),特异度分别为75.7%(578/764)、76.6%(585/764)与72.1%(551/764),阳性预测值分别为33.6%(94/280)、34.2%(93/272)与30.8%(95/308),阴性预测值分别为99.3%(578/582)、99.2%(585/590)与99.2%(585/590)。宫颈DNA倍体分析、TCT及2种方法联合筛查对宫颈活组织病理学检查诊断结果为CIN2+的筛查效能比较,见表2。
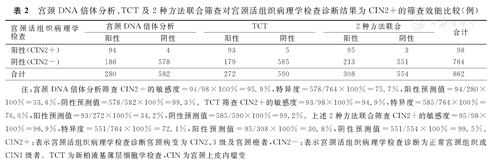
宫颈DNA倍体分析、TCT及2种方法联合筛查对宫颈活组织病理学检查诊断结果为CIN2+的筛查效能比较(例)
宫颈DNA倍体分析、TCT及2种方法联合筛查对宫颈活组织病理学检查诊断结果为CIN2+的筛查效能比较(例)
| 宫颈活组织病理学检查 | 宫颈DNA倍体分析 | TCT | 2种方法联合 | 合计 | |||
|---|---|---|---|---|---|---|---|
| 阳性 | 阴性 | 阳性 | 阴性 | 阳性 | 阴性 | ||
| 阳性(CIN2+) | 94 | 4 | 93 | 5 | 95 | 3 | 98 |
| 阴性(CIN2-) | 186 | 578 | 179 | 585 | 213 | 551 | 764 |
| 合计 | 280 | 582 | 272 | 590 | 308 | 554 | 862 |
注:宫颈DNA倍体分析筛查CIN2+的敏感度=94/98×100%=95.9%,特异度=578/764×100%=75.7%,阳性预测值=94/280×100%=33.6%,阴性预测值=578/582×100%=99.3%。TCT筛查CIN2+的敏感度=93/98×100%=94.9%,特异度=585/764×100%=76.6%,阳性预测值=93/272×100%=34.2%,阴性预测值=585/590×100%=99.2%。上述2种方法联合筛查CIN2+的敏感度=95/98×100%=96.9%,特异度=551/764×100%=72.1%,阳性预测值=95/308×100%=30.8%,阴性预测值=551/554×100%=99.5%。CIN2+:表示宫颈活组织病理学检查诊断宫颈病变为CIN2、3级及宫颈癌者,CIN2-:表示宫颈活组织病理学检查诊断为正常宫颈组织或CIN1级者。TCT为新柏液基薄层细胞学检查,CIN为宫颈上皮内瘤变
人体中正常细胞共计46条(23对)染色体,即二倍体细胞。正常情况下,宫颈细胞均停滞在静止期,当发生良性或恶性宫颈病变时,宫颈细胞异常增殖,于细胞核内合成大量核酸,染色体片段增多或丢失,发生基因重组,导致细胞核内DNA含量变化,进一步导致染色体数量变化,而产生非整倍体肿瘤细胞株[14]。张璐[14]对190例宫颈活组织病理学检查结果为正常宫颈组织或炎症、LSIL、HSIL、宫颈鳞状细胞癌患者,进行宫颈DNA倍体分析结果的阳性率分别为53.47%、72.22%、82.86%、97.22%,而上述4种宫颈活组织病理学检查结果受试者的宫颈DNA倍体分析结果的阳性率比较,差异有统计学意义(P<0.05)。肿瘤是机体正常组织细胞过度增殖形成的赘生物,其产生与细胞周期调控发生异常相关。因此,当宫颈病变级别逐渐升高时,宫颈细胞异常增殖亦逐渐增加,导致细胞核DNA结构及数量发生变化[15]。宫颈DNA倍体分析技术作为一种新的宫颈癌筛查手段,具有准确度高、敏感度高和重复性好的优点[16,17,18]。
本研究862例受试者的宫颈活组织病理学检查诊断结果为:正常宫颈组织为655例(76.0%)、CIN1级为109例(12.7%)、CIN2级为45例(5.2%)、CIN3级为39例(4.5%)、宫颈癌为14例(1.6%),CIN2+检出率为11.4%(98/862)。宫颈DNA倍体分析结果的阳性率为32.5%(280/862),CIN2+检出率为10.9%(94/862)。TCT结果的阳性率为31.6%(272/862),CIN2+检出率为10.8%(93/862)。上述2种方法联合筛查结果的阳性率为35.7%(308/862),CIN2+检出率为11.0%(95/862)。本研究正常宫颈组织、CIN1级、CIN2级、CIN3级、宫颈癌患者的宫颈DNA倍体分析结果的阳性率分别为16.9%(111/655)、68.8%(75/109)、93.3%(42/45)、97.4%(38/39)、100.0%(14/14),该阳性率随着宫颈病变程度增加而增高。这表明,宫颈DNA倍体异常细胞数量与CIN及宫颈癌的发生密切相关,对临床筛查和诊断宫颈癌具有重要意义。
TCT可以使宫颈细胞涂片比较均匀,减少血细胞、宫颈黏液和炎性碎片影响,从而降低TCT结果的假阴性率,已被广泛应用于临床筛查宫颈病变[19,20,21]。本研究以宫颈活组织病理学检查诊断结果为"金标准",对宫颈DNA分析、TCT及2种方法联合筛查宫颈病变的价值进行分析的结果显示,宫颈DNA倍体分析、TCT及2种方法联合筛查CIN2+的敏感度分别为95.9%(94/98)、94.9%(93/98)与96.9%(95/98),特异度分别为75.7%(578/764)、76.6%(585/764)与72.1%(551/764),阳性预测值分别为33.6%(94/280)、34.2%(93/272)与30.8%(95/308),阴性预测值分别为99.3%(578/582)、99.2%(585/590)与99.2%(585/590)。由此可见,宫颈DNA分析与TCT联合筛查CIN2+的敏感度、阴性预测值,均高于这2种方案单独筛查,由此可有效减少漏诊、误诊,弥补2种方案单独筛查的不足[22,23,24]。
综上所述,宫颈DNA倍体分析联合TCT筛查宫颈癌及其癌前病变,可提高筛查的准确性。但是,因本研究仅为回顾性研究,这2种方案联合筛查宫颈癌及其癌前病变的价值,仍有待大样本、多中心、前瞻性随机对照试验进一步研究、证实。






























