
探讨不同剂量重组人生长激素(rhGH)治疗儿童中枢性性早熟(CPP)的疗效。
选择2016年3月至2018年1月,于秦皇岛市妇幼保健院就诊的50例女性CPP患儿为研究对象。按照随机数字表法,将其分为SH组[n=25,采取0.5 IU/(kg·d)大剂量重组人生长激素(rhGH)单药治疗]与SS组[n=25,采取0.2 IU/(kg·d)小剂量rhGH单药治疗]。采用重复测量资料的方差分析方法,对2组患儿治疗前及治疗后6、12个月时的骨龄、骨龄差/实际年龄差(ΔBA/ΔCA)、生长速率(GV)、预测成年期身高(PAH)、子宫体积、卵巢体积、促黄体激素(LH)、卵泡刺激素(FSH)水平变化进行统计学比较。采用χ2检验,对2组患儿治疗前及治疗后6、12个月时的乳房发育、阴毛及腋毛生长情况进行统计学比较。本研究遵循的程序符合秦皇岛市妇幼保健院医学伦理委员会制定的批准,经过该伦理委员会批准(批准文号:20160511),并与受试儿监护人签署临床研究知情同意书。
① 2组患儿治疗前与治疗后6、12个月的骨龄、ΔBA/ΔCA、GV和PAH,经重复测量资料的方差分析结果显示,不同处理措施与测定时间因素间存在交互作用(F处理×时间=6.958、7.087、6.996、6.560,P=0.003、0.001、0.001、0.008);进一步固定处理措施因素进行分析的结果显示,SH组、SS组患儿治疗前及治疗后6、12个月的骨龄、ΔBA/ΔCA、GV和PAH分别进行组内总体比较,差异均有统计学意义(SH组:F=9.342、8.209、8.082、8.976,P=0.013、0.015、0.016、0.014;SS组:F=8.114、8.005、7.880、8.112,P=0.015、0.016、0.017、0.015)。SH组、SS组患儿治疗后12个月的骨龄、PAH,均较组内治疗前显著增加,ΔBA/ΔCA、GV均较组内治疗前显著降低,并且差异均有统计学意义(SH组:t=3.152、P=0.014,t=2.713、P<0.001,t=1.223、P=0.021,t=3.759、P=0.016;SS组:t=2.169、P=0.024,t=3.425、P<0.001,t=2.855、P=0.027,t=4.683、P=0.012)。②2组患儿治疗前、后不同时间点的子宫体积、卵巢体积、LH、FSH水平,经重复测量资料的方差分析结果显示:不同处理措施与测定时间因素间存在交互作用(F处理×时间=6.408、7.119、6.417、6.422,P=0.023、0.001、0.021、0.015);进一步固定处理措施因素进行分析的结果显示,SH组、SS组患儿治疗前及治疗后6、12个月的上述各指标分别进行组内总体比较,差异均有统计学意义(SS组:F=9.114、8.127、8.045、8.528,P=0.014、0.016、0.017、0.015;SS组:F=8.561、8.140、8.392、8.007,P=0.016、0.017、0.018、0.016)。SH组、SS组患儿治疗后12个月的子宫体积、卵巢体积、LH和FSH水平,均较组内治疗前显著降低,并且差异均有统计学意义(SH组:t=3.154、P=0.022,t=2.668、P=0.013,t=5.312、P=0.036,t=3.269、P=0.027;SS组:t=2.455、P=0.032,t=3.648、P=0.021,t=2.569、P=0.016,t=4.113、P=0.027)。③2组患儿治疗前及治疗后6、12个月的乳房发育率、阴毛生长率及腋毛生长率分别比较,差异均无统计学意义(P>0.05)。
采取小剂量rhGH单药治疗CPP患儿,可有效延缓患儿GV,降低雌激素分泌水平,控制病情进展,其临床疗效与大剂量rhGH单药治疗疗效相当。

版权所有,未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别申明,本刊刊出的所有文章不代表中华医学会和本刊编辑委员会的观点。
本刊为电子杂志,以光盘形式出版。本册应读者需求按需印刷,随光盘免费赠阅。光盘如有质量问题,请向编辑部调换。
中枢性性早熟(central precocious puberty,CPP)又被称为真性性早熟,是由于下丘脑-垂体-性腺轴功能过早启动,促性腺激素释放激素(gonadotropin-releasing hormone,GnRH)脉冲分泌增强所致。随着社会的不断进步和人民生活水平不断提高,儿童生长发育水平亦不断提高[1,2],CPP发病率呈增加趋势[3,4,5]。CPP对儿童心理、生理的成长发育均可造成巨大影响,严重者甚至可影响患儿正常学习和生活状态,故该病引起了社会、家长及儿科医师的广泛关注。因此,临床早期诊断和及时治疗CPP,是降低CPP不良影响的关键。采取重组人生长激素(recombinant human growth hormone,rhGH)联合GnRH类似物治疗CPP患儿2~4年后,可有效改善该病患儿成年期最终身高,但是联合治疗对于生理范围内的矮小或者正常时间进入青春期的CPP患儿疗效一般,而且治疗费用昂贵,多数家庭难以负担[6]。目前,关于CPP的单药治疗,尤其是不同剂量rhGH单药治疗CPP患儿疗效的文献报道较少。因此,本研究通过应用不同剂量rhGH对CPP患儿进行治疗,探讨其疗效,旨在为寻找该病患儿的有效治疗方式和改善患儿生活质量提供参考依据。现将研究结果报道如下。
选择2016年3月至2018年1月,于秦皇岛市妇幼保健院就诊的50例女性CPP患儿为研究对象,其年龄为7.5~9.5岁。其中,早期乳腺发育患儿为48例,阴毛生长患儿为50例,腋毛生长患儿为43例;盆腔超声检查结果提示,所有患儿子宫体积>3 cm3,卵巢体积>1 cm3,并且卵泡平均直径>4 mm。采取随机数字表法,将这50例患儿随机分为SH组(n=25,采取大剂量rhGH单药治疗)和SS组(n=25,采取小剂量rhGH单药治疗)。2组患儿的年龄及性早熟体征比较,差异均无统计学意义(P>0.05)。本研究遵循的程序符合秦皇岛市妇幼保健院医学伦理委员会制定的标准,得到该伦理委员会批准(批准文号:20160511),并与受试儿监护人签署临床研究知情同意书。
本研究受试儿纳入标准:①8岁前出现第二性征者,如乳房发育或者10岁前发生月经初潮;②促性腺激素水平达到青春期水平,促黄体激素(luteinizing hormone,LH)峰值>12 U/L,LH峰值/卵泡刺激素(follicle stimulating hormone,FSH)峰值的比值(LH峰值/FSH峰值)>0.6;③卵巢体积>1 cm3,多个卵泡平均直径>4 mm;④骨龄>实际年龄;⑤父母均无侏儒症家族史者;⑥治疗依从性好,并且能按时随访者。排除标准:①因药物原因所致的CPP患儿;②合并慢性疾病、免疫系统相关疾病和严重心、脑血管疾病者;③MRI或CT检查结果提示存在脑、肾上腺和卵巢等器官病变者;④中途失访者。
对于SH组患儿,每晚睡前皮下注射rhGH(批号:20160104,长春金赛药业股份有限公司),注射剂量为0.5 IU/(kg·d);对于SS组患儿,每晚睡前皮下注射rhGH(批号:20160104,长春金赛药业股份有限公司),注射剂量为0.2 IU/(kg·d)。2组均为每4个月为1个疗程,每例患儿均接受3个疗程治疗。
本研究观察指标如下。①治疗前及治疗后6、12个月,观察2组患儿的骨龄,骨龄差/实际年龄差(bone age difference/actual age difference,ΔBA/ΔCA),生长速率(growth velocity,GV)和预测成年期身高(predicted adult height,PAH)。采用《中国人手腕骨发育标准-中华05 V.骨成熟度百分位数曲线的修订》[7],对患儿ΔBA/ΔCA进行评估。采用Bayley-Pinneau法[8],对患儿PAH进行评估。②观察2组患儿治疗前及治疗后6、12个月时,子宫及卵巢体积、LH和FSH水平。③观察2组患儿第二性征改变情况,包括乳房发育、阴毛及腋毛生长情况。
采用SPSS 22.0统计学软件包进行对本研究数据进行统计学分析。采用Ssize软件确定满足本研究统计检验的最小样本量。对于呈正态分布、方差齐的计量资料,如骨龄、ΔBA/ΔCA、GV、PAH、子宫及卵巢体积、LH、FSH水平等,采用 ±s表示,治疗前、后组内比较,采用配对t检验,各不同时间监测点数据比较,采用重复测量资料的方差分析。对于计数资料,如乳房发育率、阴毛生长率、腋毛生长率等,采用率(%)表示,组间比较采用χ2检验。所有统计学检验采用双侧检验,以P<0.05表示差异有统计学意义。
±s表示,治疗前、后组内比较,采用配对t检验,各不同时间监测点数据比较,采用重复测量资料的方差分析。对于计数资料,如乳房发育率、阴毛生长率、腋毛生长率等,采用率(%)表示,组间比较采用χ2检验。所有统计学检验采用双侧检验,以P<0.05表示差异有统计学意义。
2组患儿治疗前与治疗后6、12个月的骨龄、ΔBA/ΔCA、GV和PAH,经重复测量资料的方差分析结果显示:①不同处理措施与测定时间因素间存在交互作用(F处理×时间=6.958、7.087、6.996、6.560,P=0.003、0.001、0.001、0.008);②进一步固定处理措施因素进行分析的结果显示,SH组、SS组患儿治疗前及治疗后6、12个月的骨龄、ΔBA/ΔCA、GV和PAH分别进行组内总体比较,差异均有统计学意义(P<0.05);进一步固定测定时间因素进行分析的结果显示,2组患儿治疗前及治疗后6、12个月的骨龄、ΔBA/ΔCA、GV和PAH组间比较,差异均无统计学意义(P>0.05)。对2组患儿治疗后12个月的骨龄、ΔBA/ΔCA、GV、PAH与组内治疗前比较的结果显示,差异均有统计学意义(P<0.05)。2组CPP患儿治疗前、后不同时间点各生理参数比较,见表1。
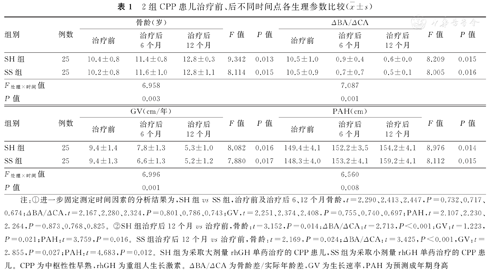
2组CPP患儿治疗前、后不同时间点各生理参数比较( ±s)
±s)
2组CPP患儿治疗前、后不同时间点各生理参数比较( ±s)
±s)
| 组别 | 例数 | 骨龄(岁) | F值 | P值 | ΔBA/ΔCA | F值 | P值 | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 治疗前 | 治疗后6个月 | 治疗后12个月 | 治疗前 | 治疗后6个月 | 治疗后12个月 | ||||||
| SH组 | 25 | 10.4±0.8 | 11.4±0.8 | 12.8±0.3 | 9.342 | 0.013 | 10.5±1.0 | 0.9±0.4 | 0.6±0.0 | 8.209 | 0.015 |
| SS组 | 25 | 10.2±0.8 | 11.6±1.0 | 12.8±1.1 | 8.114 | 0.015 | 10.5±0.9 | 0.7±0.7 | 0.5±0.1 | 8.005 | 0.016 |
| F处理×时间值 | 6.958 | 7.087 | |||||||||
| P值 | 0.003 | 0.001 | |||||||||
| 组别 | 例数 | GV(cm/年) | F值 | P值 | PAH(cm) | F值 | P值 | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 治疗前 | 治疗后6个月 | 治疗后12个月 | 治疗前 | 治疗后6个月 | 治疗后12个月 | ||||||
| SH组 | 25 | 9.4±1.4 | 7.8±1.3 | 5.3±1.0 | 8.082 | 0.016 | 149.4±4.1 | 152.2±3.5 | 154.2±4.1 | 8.976 | 0.014 |
| SS组 | 25 | 9.4±1.3 | 6.6±1.3 | 5.2±1.2 | 7.880 | 0.017 | 148.3±4.0 | 153.2±4.1 | 159.2±4.1 | 8.112 | 0.015 |
| F处理×时间值 | 6.996 | 6.560 | |||||||||
| P值 | 0.001 | 0.008 | |||||||||
注:①进一步固定测定时间因素的分析结果为,SH组vs SS组,治疗前及治疗后6、12个月骨龄,t=2.290、2.413、2.447,P=0.732、0.717、0.674;ΔBA/ΔCA,t=2.167、2.280、2.324,P=0.801、0.786、0.743;GV,t=2.251、2.374、2.408,P=0.755、0.740、0.697;PAH,t=2.107、2.230、2.264,P=0.873、0.768、0.825。②SH组治疗后12个月vs治疗前,骨龄:t=3.152,P=0.014;ΔBA/ΔCA:t=2.713,P<0.001;GV:t=1.223,P=0.021;PAH:t=3.759,P=0.016。SS组治疗后12个月vs治疗前,骨龄:t=2.169,P=0.024;ΔBA/ΔCA:t=3.425,P<0.001,GV:t=2.855,P=0.027;PAH:t=4.683,P=0.012。SH组为采取大剂量rhGH单药治疗的CPP患儿,SS组为采取小剂量rhGH单药治疗的CPP患儿。CPP为中枢性性早熟,rhGH为重组人生长激素。ΔBA/ΔCA为骨龄差/实际年龄差,GV为生长速率,PAH为预测成年期身高
2组患儿治疗前、后不同时间点的子宫体积、卵巢体积、LH、FSH水平,经重复测量资料的方差分析结果显示:①不同处理措施与测定时间因素间存在交互作用(F处理×时间=6.408、7.119、6.417、6.422,P=0.023、0.001、0.021、0.015);②进一步固定处理措施因素进行分析的结果显示,SH组、SS组患儿治疗前及治疗后6、12个月的上述各指标分别进行组内总体比较,差异均有统计学意义(P<0.05);进一步固定测定时间因素进行分析的结果显示,2组患儿治疗前及治疗后6、12个月的上述各指标组间比较,差异均无统计学意义(P>0.05)。对2组患儿治疗后12个月的子宫体积、卵巢体积、LH和FSH水平与组内治疗前比较的结果显示,差异均有统计学意义(P<0.05)。2组患儿治疗前、后不同时时间点的子宫与卵巢体积及LH、FSH水平比较,见表2。
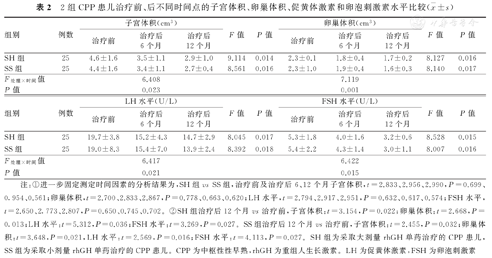
2组CPP患儿治疗前、后不同时间点的子宫体积、卵巢体积、促黄体激素和卵泡刺激素水平比较( ±s)
±s)
2组CPP患儿治疗前、后不同时间点的子宫体积、卵巢体积、促黄体激素和卵泡刺激素水平比较( ±s)
±s)
| 组别 | 例数 | 子宫体积(cm3) | F值 | P值 | 卵巢体积(cm3) | F值 | P值 | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 治疗前 | 治疗后6个月 | 治疗后12个月 | 治疗前 | 治疗后6个月 | 治疗后12个月 | ||||||
| SH组 | 25 | 4.6±1.6 | 3.5±1.1 | 2.9±1.0 | 9.114 | 0.014 | 2.3±0.1 | 1.8±0.4 | 1.7±0.2 | 8.127 | 0.016 |
| SS组 | 25 | 4.4±1.6 | 3.4±1.1 | 2.7±0.4 | 8.561 | 0.016 | 2.3±1.0 | 1.9±0.4 | 1.6±0.3 | 8.140 | 0.017 |
| F处理×时间值 | 6.408 | 7.119 | |||||||||
| P值 | 0.023 | 0.001 | |||||||||
| 组别 | 例数 | LH水平(U/L) | F值 | P值 | FSH水平(U/L) | F值 | P值 | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 治疗前 | 治疗后6个月 | 治疗后12个月 | 治疗前 | 治疗后6个月 | 治疗后12个月 | ||||||
| SH组 | 25 | 19.7±3.8 | 15.2±4.3 | 14.7±2.9 | 8.045 | 0.017 | 5.3±1.8 | 4.0±1.6 | 3.2±0.6 | 8.528 | 0.015 |
| SS组 | 25 | 19.0±8.3 | 15.4±7.0 | 13.9±2.4 | 8.392 | 0.018 | 5.4±2.2 | 4.3±1.4 | 3.0±1.1 | 8.007 | 0.016 |
| F处理×时间值 | 6.417 | 6.422 | |||||||||
| P值 | 0.021 | 0.015 | |||||||||
注:①进一步固定测定时间因素的分析结果为,SH组vs SS组,治疗前及治疗后6、12个月子宫体积,t=2.833、2.956、2.990,P=0.699、0.954、0.561;卵巢体积,t=2.700、2.833、2.867,P=0.778、0.663、0.620;LH水平,t=2.794、2.917、2.951,P=0.632、0.617、0.574;FSH水平,t=2.650、2.773、2.807,P=0.650、0.745、0.702。②SH组治疗后12个月vs治疗前,子宫体积:t=3.154,P=0.022;卵巢体积:t=2.668,P=0.013;LH水平:t=5.312,P=0.036;FSH水平:t=3.269,P=0.027。SS组治疗后12个月vs治疗前,子宫体积:t=2.455,P=0.032;卵巢体积:t=3.648,P=0.021,LH水平:t=2.569,P=0.016;FSH水平:t=4.113,P=0.027。SH组为采取大剂量rhGH单药治疗的CPP患儿,SS组为采取小剂量rhGH单药治疗的CPP患儿。CPP为中枢性性早熟,rhGH为重组人生长激素。LH为促黄体激素,FSH为卵泡刺激素
2组患儿治疗前及治疗后6、12个月时,乳房发育率、阴毛生长率及腋毛生长率分别比较,差异均无统计学意义(P>0.05)。2组患儿治疗前、后不同时间点第二性征变化情况,见表3。

2组CPP患儿治疗前、后不同时间点第二性征变化情况比较[例数(%)]
2组CPP患儿治疗前、后不同时间点第二性征变化情况比较[例数(%)]
| 组别 | 例数 | 乳房发育 | 阴毛生长 | 腋毛生长 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 治疗前 | 治疗后6个月 | 治疗后12个月 | 治疗前 | 治疗后6个月 | 治疗后12个月 | 治疗前 | 治疗后6个月 | 治疗后12个月 | ||
| SH组 | 25 | 23(92.0) | 14(56.0) | 9(36.0) | 25(100.0) | 15(60.0) | 10(40.0) | 22(88.0) | 13(52.0) | 8(32.0) |
| SS组 | 25 | 25(100.0) | 13(52.0) | 9(36.0) | 25(100.0) | 13(52.0) | 9(36.0) | 21(84.0) | 10(40.0) | 8(32.0) |
| χ2值 | 0.951 | 1.390 | 0.932 | 0.000 | 1.296 | 0.986 | 1.188 | 1.303 | 0.931 | |
| P值 | 0.452 | 0.489 | 0.508 | 1.000 | 0.501 | 0.443 | 0.503 | 0.561 | 0.509 | |
注:SH组为采取大剂量rhGH单药治疗的CPP患儿,SS组为采取小剂量rhGH单药治疗的CPP患儿。CPP为中枢性性早熟,rhGH为重组人生长激素
CPP患儿主要表现为乳房发育、阴毛和腋毛生长较正常儿童过早出现[4,5]。此外,还可出现骨骺线过早闭合、月经初潮提前和生长迟缓,影响患儿成年期最终身高[10,11]。该病发病率女性高于男性,由于患儿性腺发育较早,因此其生长发育时间较正常儿童缩短、骨龄增大、骨骺线闭合提前,导致患儿成年期最终身高低于遗传靶向身高。同时,该病也会引发过早出现第二性征和生殖器官发育,给患儿带来负面的心理和社会问题[15,16]。Raben[17]指出,自大脑垂体中提取的人生长激素(human growth hormone,hGH),是治疗垂体性侏儒症患儿特发性生长激素缺乏症(idiopathic growth hormone deficiency)的最有效药物。但是,由于天然提取的hGH数量有限,而且具有导致传染病的风险,因此并未广泛用于临床。随着重组DNA技术的进步,rhGH的成功合成,为CPP患儿身材矮小的临床治疗带来希望[21,22,23,24,25]。rhGH是通过基因技术合成的与人体自身分泌的hGH结构相同的活性大分子物质,可促进骨骼线性生长,但是目前临床对于应用rhGH治疗CPP患儿的剂量,尚未达成共识[18,19,26]。
本研究通过对采取不同剂量rhGH治疗CPP患儿的疗效进行分析的结果显示,随着治疗时间延长,2组患儿治疗前、后骨龄和PAH,呈逐渐上升趋势,而ΔBA/ΔCA和GV呈下降趋势。这表明,rhGH可延缓CPP患儿骨龄成熟,延迟骨骺线闭合时间,降低GV,促进骨骼线性生长;另一方面,可为身高的增长争取宝贵时间,提高患儿PAH。这与文献报道[20,27,28,29,30,31,32,33]结果一致。此外,本研究结果还显示,2组患儿治疗后12个月时,子宫体积、卵巢体积、LH和FSH水平均较治疗前显著降低,并且差异均有统计学意义(P<0.05)。这表明,rhGH在降低CPP患儿雌激素水平方面具有一定疗效。郑丕媚等[24]研究结果显示,rhGH可通过改善CPP患儿神经内分泌功能,从而达到治疗CPP的目的。
本研究结果还显示,随着治疗时间延长,2组患儿乳房发育率、阴毛生长率及腋毛生长率,均呈下降趋势,由此可见rhGH可有效延缓CPP患儿的第二性征发育。2组患儿治疗前及治疗后6、12个月时,乳房发育率、阴毛生长率及腋毛生长率分别比较,差异均无统计学意义(P<0.05),这提示小剂量rhGH与大剂量rhGH治疗CPP患儿的临床疗效相当。
综上所述,采取小剂量rhGH单药治疗CPP患儿,可有效延缓患儿GV,改善神经内分泌功能,控制病情进展,其临床疗效与大剂量rhGH单药治疗疗效相当,可为临床有效治疗CPP患儿提供新方案。
所有作者均声明不存在利益冲突






























