
探讨儿童感染性心内膜炎(IE)的临床及超声心动图(UCG)特点。
选择2013年5月至2018年5月,于四川大学华西第二医院确诊的28例IE患儿为研究对象。采用回顾性分析方法,分析其临床病例资料,总结儿童IE的临床及UCG特点。本研究遵循的程序符合2013年修订的《世界医学协会赫尔辛基宣言》要求,并且与所有患儿监护人签署临床研究知情同意书。
①临床特点:28例IE患儿中,85.7%(24/28)存在发热症状;血培养阳性率为64.3%(18/28),其中最常见病原体为金黄色葡萄球菌,占血培养阳性结果的33.3%(6/18)。②UCG特点:71.4%(20/28) IE患儿存在先天性心脏病。25例(89.3%,25/28) IE患儿存在心内赘生物,其中2例为多部位受累,其余23例均为单一部位受累。心内赘生物以二尖瓣受累最常见,占检出心内赘生物患儿的40.0%(10/25),二尖瓣前叶及后叶受累各占20.0%(5/25);其次为肺动脉壁近动脉导管开口处及主动脉瓣受累各占16.0%(4/25)。心脏以左房左室增大所占比例最高,为35.7%(10/28)。85.7%(24/28) IE患儿的左心室收缩功能正常。此外,还可出现瓣膜穿孔、反流等。
儿童IE的临床表现多样化,并且多变,增加了该病的诊断难度。增强对本病的认知,充分掌握其UCG特征,对快速、准确诊断及早期治疗该病,达到改善IE患儿预后的目的十分重要。

版权所有,未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别申明,本刊刊出的所有文章不代表中华医学会和本刊编辑委员会的观点。
本刊为电子杂志,以光盘形式出版。本册应读者需求按需印刷,随光盘免费赠阅。光盘如有质量问题,请向编辑部调换。
感染性心内膜炎(infective endocarditis, IE)是由病原微生物,如细菌、病毒、真菌、立克次体等经血行途径引起心内膜感染,可累及心瓣膜、大动脉内膜等,并伴有赘生物形成。该病的主要临床特点包括导致患儿全身感染(发热)、心脏杂音、心律失常、心功能不全、全身性血管栓塞及免疫反应等。在亚洲人群中,IE发病率约为7.6例/10万人,男性发病率高于女性,男、女患病比例约为2∶1[1]。IE在儿童中的发病率略低于成年人[2]。文献报道,随着接受先天性心脏病手术患儿的增加,儿童IE发病率呈增加趋势[3,4,5]。该病亦是儿童严重感染性疾病之一。近年在流行病学及抗菌药物治疗、手术管理等方面有很多有价值的研究。在对IE的诊断中,心内膜受累证据依赖于超声心动图(ultrasonic cardiogram,UCG)检查,因此本研究回顾性分析28例IE患儿的临床及UCG资料,总结儿童IE的临床和UCG特点,旨在加强儿科及超声科医师对儿童IE的认识,从而提高对该病的诊断水平,改善患儿预后。现将研究结果报道如下。
选择2013年5月至2018年5月,于四川大学华西第二医院确诊的28例IE患儿为研究对象。其中,男性患儿为8例,女性为20例;年龄为1~14岁,平均为7.8岁。本研究纳入标准:年龄≤14岁,符合IE诊断者。排除标准:罹患风湿性疾病及心肌病的患儿。本研究符合2013年修订的《世界医学协会赫尔辛基宣言》要求,并且与所有患儿监护人签署临床研究知情同意书。
采用中华医学会儿科学分会心血管学组、《中华儿科杂志》编辑委员会提出的"儿童感染性心内膜炎诊断标准建议",对IE进行诊断[6]。
采用回顾性分析方法,对本组患儿的临床病例资料进行分析,包括一般临床资料、患儿入院时的血常规和生化检查、血培养及心电图结果等。对本组患儿采用Philips iE33(荷兰飞利浦电子公司)及GE Vivid E9(美国通用电气公司)彩色多普勒超声诊断仪,使用M型超声、二维超声和彩色多普勒血流成像,进行UCG检查,主要观察心脏瓣膜赘生物形成情况、瓣膜损害征象、心脏血流动力学改变及心脏结构与功能异常改变等。
本研究数据资料采用SPSS 17.0统计学软件包进行统计学处理。对计数资料,如各种临床及超声表现的发生率或所占比例,采用百分比(%)表示;左室射血分数、左室短轴缩短率等呈正态分布的计量资料,采用 ±s表示。
±s表示。
本组28例IE患儿的临床特点如下。①临床表现:85.7%(24/28)患儿存在发热症状,25.0%(7/28)有咳嗽、咳痰,14.3%(4/28)有贫血表现,10.7%(3/28)出现心累、乏力,3.6%(1/28)有颅内感染表现。②心电图检查结果:5例(17.9%,5/28)患儿出现心律失常,包括2例房性早搏、1例窦性心动过缓、1例心房颤动及1例一度房室传导阻滞。③血培养:64.3%(18/28)患儿血培养结果呈阳性,包括革兰阳性菌感染为15例、革兰阴性菌为2例及真菌为1例。15例革兰阳性菌感染患儿中,葡萄球菌属感染为9例、链球菌属为5例、肠球菌为1例。本组IE患儿最常见感染病原体为金黄色葡萄球菌,占血培养阳性结果的33.3%(6/18);其次为链球菌属,占27.8%(5/18)。
本组28例IE患儿中,20例(71.4%,20/28)IE患儿的UCG检查结果显示存在先天性心脏病,包括动脉导管未闭为9例(45.0%,9/20),室间隔缺损为5例(25.0%,5/20),房间隔缺损为4例(20.0%,4/20),右室双出口为1例(5.0%,1/20),左室-右房通道为1例(5.0%,1/20)。20例被确诊为先天性心脏病的患儿中,5例为先天性心脏病术后,包括动脉导管未闭封堵术后2例,室间隔缺损封堵术后3例。
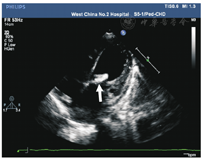
本组28例IE患儿中,89.3%(25/28)IE患儿存在心内赘生物,包括多部位受累2例(8.0%,2/25),分别为右房壁、肺动脉瓣、三尖瓣受累1例,以及主动脉瓣、二尖瓣受累1例;其余23例患儿均为单一部位受累。这25例IE患儿的心内赘生物平均大小为10.7 mm×9.0 mm。心内赘生物以二尖瓣受累最多见,占40.0%(10/25)(图1),二尖瓣前叶及后叶受累各占20.0%(5/25);其次为肺动脉壁近动脉导管开口处、主动脉瓣,各占16.0%(4/25);其后依次为三尖瓣、肺动脉瓣各占12.0%(3/25),右房壁占4.0%(1/25)。

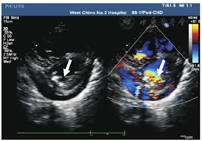
本组28例IE患儿中,3例出现瓣膜穿孔(图2),包括2例为二尖瓣前叶穿孔,1例为三尖瓣前叶穿孔;1例为二尖瓣后叶腱索断裂;6例为二尖瓣大量反流、3例为三尖瓣大量反流、1例为主动脉瓣大量反流;1例为心包积液。其余13例患儿心脏瓣膜检查未见异常。

本组28例IE患儿中,左房左室增大占35.7%(10/28),房室大小正常占25.0%(7/28),全心增大占14.3%(4/28),右房右室增大、左房增大、左室增大各占7.1%(2/28),右房双室增大占3.6%(1/28)。左心室收缩功能正常占85.7%(24/28),收缩功能减低占14.3%(4/28);左室射血分数为(64.7±6.5)%;左室短轴缩短率为(34.7±5.1)%。
儿童IE为一类较为严重的儿童感染性疾病,在住院患儿中,该病的年发生率为1/2 000~1/1 300,而且导致的患儿病死率较高[7]。随着近年来抗菌药物的广泛应用,IE患儿的临床症状多呈不典型表现,由此增加了临床对该病的诊断难度。临床医师增强对本病的认知,充分掌握其临床及影像学特征,对快速、准确诊断,以及早期、正确治疗该病,从而改善患儿预后,十分重要。
IE易发生于伴有器质性心脏病的患者,成年人IE最多见的器质性心脏病为主动脉或二尖瓣退行性病变及风湿性心脏病[8]。对于儿童,特别先天性心脏病儿童,是最常见的IE好发群体[7,9,10,11]。本研究结果亦显示,28例IE患儿中,71.4%(20/28)伴有先天性心脏病,其中以动脉导管未闭(45.0%,9/20)最多见。
IE患儿的临床表现与病变累及的部位及其严重程度、有无伴发器质性心脏病有关。IE患儿的主要临床表现如下。①全身性感染表现:发热、乏力、贫血、反复呼吸道感染等;②心脏受累表现:心脏病理性杂音,在有基础心脏病的患儿中,表现为不同于原有杂音的新出现的杂音,以及心律失常、心力衰竭等;③免疫反应表现:Osler结节、关节炎、肾小球肾炎等;④血管损害表现:皮肤淤斑、淤点,全身性血管栓塞等。发热是IE患者最常见的临床表现,但是在老年人、严重衰弱、机体基础条件差的患者中,可无发热表现[8,12]。IE导致的心律失常,以心房颤动、期前收缩多见,这可能与含病原微生物的赘生物损害心肌细胞,导致心脏传导系统障碍有关[12,13]。IE导致的心力衰竭多由病情进展,心脏瓣膜破坏加重、反流增加,以及心功能减低所致[13]。与成年IE患者相同,儿童IE患儿的全身性血管栓塞发生率亦较高,栓塞中最常见的为脑栓塞和脾栓塞[14]。本研究结果显示,85.7%(24/28)IE患儿存在发热症状,为本组IE患儿最常见临床症状,这与文献报道一致[11,12]。本研究心电图检查结果亦显示,5例患儿出现心律失常,包括房性早搏、窦性心动过缓等,这与Coward等[14]研究结果一致。本研究患儿均无血管栓塞情况出现,这可能与患儿年龄尚小、病程较短有关。
儿童IE的致病病原体主要为革兰阳性菌,包括链球菌,如α-溶血性链球菌,葡萄球菌,如金黄色葡萄球菌,以及肠球菌等。既往研究结果显示,IE的致病病原体以链球菌感染最多见,肠球菌少见,儿童肠球菌IE发生率显著低于成年人[15,16]。近年来研究结果显示,儿童IE以金黄色葡萄球菌感染最多,葡萄球菌成为IE的第1位致病菌;葡萄球菌所致的IE发病率增加,可能与各种医疗技术进步、新型材料应用、各种经血管的创伤性检查和治疗增加,以及复杂先天性心脏病患儿存活率增高有关[17,18,19]。本研究结果显示,28例IE患儿的血培养阳性率为64.3%(18/28),其中33.3%为金黄色葡萄球菌,27.8%为链球菌属感染,与文献报道一致[17,18,19]。
UCG检查是IE诊治过程中不可或缺的检查方法,对IE的早期诊断、指导临床治疗及判断预后都非常重要。Sanfilippo等[16]研究结果显示,IE最具有特征性的UCG表现为心内赘生物形成,以主动脉瓣和二尖瓣受累多见。通过UCG检查,可掌握心内赘生物的位置、大小、形状和数目。IE的其他主要UCG表现还包括:受累瓣膜可出现穿孔、脱垂或破裂,人工瓣膜或缺损补片有新的裂口,以及腱索断裂等;瓣环、瓣周或室间隔上形成脓肿;彩色多普勒血流成像,可显示受累瓣膜关闭不全及其程度;M型超声可显示心脏功能受损情况。本研究结果显示,最常受累的心瓣膜为二尖瓣(40.0%),其次分别为肺动脉壁近动脉导管开口处(16.0%)、主动脉瓣(16.0%)。本研究肺动脉壁近动脉导管开口处发现赘生物的比例较高,这可能与本组动脉导管未闭患儿较多有关。
文献报道,经胸UCG诊断IE具有较高敏感度,IE儿童的心内赘生物检出率显著高于成年IE患者,同时UCG检查的费用低并且无创,应作为诊断IE的首选方法[10,11]。虽然标准的经胸UCG检查在大多数情况下,尤其对于婴幼儿,已经可以达到检出病变的目的,但是对于肥胖或肌肉发达青少年、心脏手术术后患者、存在呼吸功能受损或肺过度充气的患者而言,超声成像的条件较差,可能不足以准确显示病变[17]。在上述情况下,采取经食道UCG检查,可作为IE的辅助诊断方法,而且具有非常重要的临床意义。
临床上需将IE与金黄色葡萄球菌、肺炎球菌、革兰阴性杆菌所致的败血症相区别。由于IE的临床表现多样,进行鉴别诊断时,需仔细查体,判断是否存在血管栓塞表现、是否出现新的病理性心脏杂音,同时需完善UCG检查。对于亚急性起病的IE患者,需与左心房黏液瘤相区别,后者的UCG表现为左心房内疏松异常点片状回声团,边缘较规整,多呈椭圆形,内部回声强度较均匀,基底部在房间隔上,瘤体可随心动周期来回往返于房室之间,多不浸润瓣膜。
综上所述,随着抗菌药物广泛使用,IE的病原学特征发生改变,临床表现亦多样化并且多变。因此,临床对于罹患先天性心脏病、心脏手术后及心瓣膜病的IE高风险人群,或者有IE病史者,当其出现不明原因发热、消瘦、贫血等症状时,应进行血培养和UCG检查,以进一步明确诊断。
所有作者均声明不存在利益冲突






























